Теория мономолекулярной адсорбции
Молекулам газа выгодно адсорбироваться на твердой поверхности: в газе межмолекулярные взаимодействия малы, а на поверхности – велики. Поэтому адсорбция газа на твердой поверхности снижает ее удельную поверхностную энергию на границе с газовой фазой (Δ σ < 0 и Δ Gs < 0). Адсорбция на границе газ – твердая поверхность (адсорбент) описывается уравнением изотермы мономолекулярной адсорбции Ленгмюра:
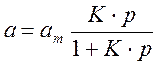 , (1.31)
, (1.31)
где a – равновесная адсорбция газа (моль/г адсорбента или моль/м2 поверхности адсорбента);
аm – максимально возможная адсорбция или сорбционная емкость монослоя, т.е. слоя “толщиной” с размер молекулы газа;
p – парциальное давление адсорбируемого газа;
K – константа адсорбционно-десорбционного равновесия при данной температуре.
Кинетический и термодинамический выводы этого уравнения даются в курсе лекций по физической химии. Кроме того, там же рассматриваются другие теоретические модели адсорбции и условия их применимости к реальным системам.
В случае адсорбции из жидкого раствора на твердой поверхности в уравнении (1.31) вместо p следует писать с – концентрацию адсорбируемого вещества в растворе. При адсорбции из раствора наиболее эффективно (с большей константой адсорбции K при прочих равных условиях) на твердой поверхности будут адсорбироваться молекулы вещества, наиболее близкого по строению (в частности, по полярности) к веществу адсорбента.
|
|
|
Для практического использования уравнение (1.31) удобно представить в линейной форме:
1/а = 1/аm + (1/аm K) (1/ с). (1.32)
Изотерма адсорбции в координатах этого уравнения приведена на рис. 1.7. Экстраполяция зависимости к 1/с = 0(к бесконечно большой равновесной концентрации адсорбируемого вещества) дает величину 1/аm и позволяет рассчитывать аm - максимальную адсорбцию из раствора, характерную для данного адсорбента, т.е. сорбционную емкость адсорбента.
Из тангенса угла наклона этой зависимости к оси абсцисс, определяемого из полученной опытным путем зависимости как tg = Δ(1/а)/ Δ(1/c) (см. рис. 1.7) и равного (уравнение 1.32) tg = 1/аm K, можно вычислить константу адсорбции при температуре опыта.
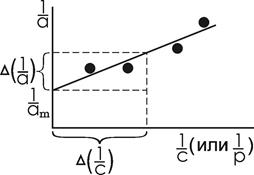
Рис. 1.7. Зависимость величины адсорбции на твердом адсорбенте от равновесной концентрации (или парциального давления) адсорбируемого вещества в жидком растворе (или в газовой фазе) в координатах уравнения Лэнгмюра (уравнение 1.32)
Определенную экспериментально величину аm (моль/г) можно использовать для определения удельной поверхности адсорбента Ω УД (м2 / г адсорбента), если известна площадь ω (м2), занимаемая на поверхности одной молекулой адсорбированного вещества (определяется из размеров молекулы):
|
|
|
Ω УД =  ω NА, (1.33)
ω NА, (1.33)
где NА - число Авогадро (6,02 · 1023).
В свою очередь, известную величину Ω УД можно использовать для расчета  или ωлюбого вещества по его равновесной адсорбции а на данном адсорбенте.
или ωлюбого вещества по его равновесной адсорбции а на данном адсорбенте.
Начальный, практически линейный участок изотермы Ленгмюра (уравнение 1.31), на котором K∙p << 1 (при низких парциальных давлениях газов) и а= аm ∙K∙p, называется областью Генри. В этой области равновесная адсорбция прямопрпорциональна парциальному давлению газа: а = Кг∙p, а коэффициент пропорциональности Кг=Kam называется константой Генри. Закон Генри лежит в основе метода газожидкостной хроматографии.
Хроматография
Хроматография – один из наиболее мощных методов анализа качественного и количественного состава газовых смесей, сточных и природных вод и т.п., базирующийся на закономерностях адсорбции.
Метод газовой хроматографии (ГХ). Газовый хроматограф состоит из колонки с адсорбентом, через которую проходит газ-носитель, устройства для ввода проб (изначально это могут быть жидкие вещества, но быстро испаряющиеся при высоких темпеатурах), детектора, самописца, интегратора.
Рассмотрим механизм разделения газа на индивидуальные вещества в хроматографической колонке. Введем понятие константы адсорбции  , равной отношению числа адсорбированных молекул к числу молекул в газовой фазе. Эта константа пропорциональна константе Генри (Kг).
, равной отношению числа адсорбированных молекул к числу молекул в газовой фазе. Эта константа пропорциональна константе Генри (Kг).
|
|
|
Пусть газ-носитель проходит колонку за t0 секунд. За какое время tR пройдет колонку и попадет в детектор вещество с константой адсорбции  ? Очевидно, что в каждый момент времени на одну движущуюся молекулу этого вещества приходится
? Очевидно, что в каждый момент времени на одну движущуюся молекулу этого вещества приходится  недвижущихся (адсорбированных). Иными словами, у каждой молекулы этого вещества на одну секунду движения приходится
недвижущихся (адсорбированных). Иными словами, у каждой молекулы этого вещества на одну секунду движения приходится  секунд простоя, поэтому время выхода вещества из колонки и попадания в детектор выражается как tR = t0 (1+
секунд простоя, поэтому время выхода вещества из колонки и попадания в детектор выражается как tR = t0 (1+  ).
).
Итак, вещества с разными  попадают в детектор через разное время. Это и есть хроматографическое разделение смеси на хроматографические пики.
попадают в детектор через разное время. Это и есть хроматографическое разделение смеси на хроматографические пики.
Время выхода (tR) характеризует природу вещества, а площадь хроматографического пика – концентрацию данного вещества в смеси.
Наиболее распространенный детектор в ГХ – катарометр, принцип действия которого основан на разнице в сопротивлении (проводимости) нагретой металлической проволоки, обдуваемой либо чистым газом-носителем, либо смесью газа-носителя с другим веществом. Чувствительность такого детектора 10-9 %.
|
|
|
Подробное рассмотрение зависимости tR от качественного состава газовой смеси на примере углеводородов приводится в курсе лекций по физической химии. С помощью современных хроматографов можно идентифицировать в образце бензина несколько сотен индивидуальных соединений и по соотношению их концентраций определить, где этот бензин был произведен.
Дата добавления: 2015-12-21; просмотров: 20; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
