Микроскопические и макроскопические
Переменные
Термодинамика занимается изучением свойств тел и изменением состояния вещества, не рассматривая их атомно-молекулярной структуры. Этот подход используется в классической или, как ее еще называют, феноменологической термодинамике. На основании обобщения огромного фактического материала в классической термодинамике постулируется ряд основополагающих гипотез – начала термодинамики, которые затем перешли в ряд фундаментальных законов. Выводы термодинамики как науки актуальны для естествознания в целом, ибо имеют весьма общий характер.
Молекулярно – кинетическая теория объясняет, описывает макроскопические параметры термодинамических систем (давление, температура и др.) как суммарный результат воздействия частиц, из которых эта система состоит. Для этого используются статистические методы и аппарат теории вероятностей, позволяющие рассматривая поведение каждой частицы получить зависимости, описывающие поведение всего ансамбля в целом. Микроскопическими характеристиками атомов молекул являются их массы, скорости, кинетические энергии, потенциальная энергия взаимодействия, энтропия, энтальпия, внутренняя энергия и другие потенциалы.
Наблюдая за термодинамической системой необходимо вводить понятия микро - и макросостояний. Некоторое конкретно взятое макросостояние термодинамической системы может обеспечиваться достаточно большим числом различных микросостояний. Это требует введения оценочных параметров таких свойств системы как макрообъекта, которых нет у отдельно взятой частицы: давление, температура и т. д.
|
|
|
Под давлением в естествознании понимается сила, действующая на единицу поверхности
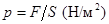 .
.
Единица измерения давления один Паскаль, равный 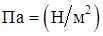 .
.
Для расчета давления в идеальном газе Максвеллом в рамках молекулярно-кинетической теории (МКТ) была получена зависимость, известная как основное уравнение МКТ
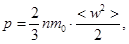
где n – концепция молекул; m 0 – масса молекулы; 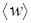 – среднеквадратичная скорость молекулы.
– среднеквадратичная скорость молекулы.
Температура является энергетической макроскопической характеристикой состояния системы и отражает меру отклонения ее внутренней энергии от внутренней энергии системы принятой за ноль отсчета. Единицей измерения является 1º С в эмпирической шкале и 1 К в термодинамической шкале, причем 1º С=1 К. Это не означает, что температура тела в этих шкалах отражается одинаковым численными значениями. Между ними имеется определенная взаимосвязь
 ,
,
где Т – температура системы в абсолютной термодинамической шкале; t – температура системы в эмпирической шкале.
Для системы, состоящей из идеального газа, может быть получена зависимость расчета температуры через кинетическую энергию молекулы
|
|
|
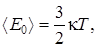
где 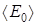 – среднеквадратичная кинетическая энергия одной молекулы, Дж;
– среднеквадратичная кинетическая энергия одной молекулы, Дж;  постоянная Больцмана, Дж/К; Т – термодинамическая температура, К.
постоянная Больцмана, Дж/К; Т – термодинамическая температура, К.
Под идеальным газом понимается модель газа, состоящая из частиц (атомов) не имеющих размеров (материальных точек), не взаимодействующих друг с другом, движение которых по всем направлениям равновероятны, а энергия распределена по всем степеням свободы равномерно, соударения молекул между собой и со стенками сосуда абсолютно упруги.
Важной характеристикой в термодинамике, определяющей тепловое состояние покоящейся системы, является внутренняя энергия U (Дж), или удельная внутренняя энергия u (Дж/кг).
Для идеального газа, исключающего взаимодействие молекул, внутренняя энергия состоит лишь из кинетической составляющей. При этом необходимо сделать оговорку, если не учитывать химическую, внутриатомную и внутриядерную ее компоненты. Кинетическая энергия системы при ее движении как целого, а также ее потенциальная энергия, определяемая отстоянием ее центра масс от нулевого уровня, во внутреннюю энергию не входят.
Термодинамические системы могут обмениваться энергией между собой в двух формах в виде передачи теплоты или работы.
|
|
|
Передача работы происходит на макроуровне, при котором возможно наблюдение конечного перемещения систем или их деформация – изменение геометрии, положения в пространстве.
Передача теплоты происходит на микроуровне при наличии, как правило, теплового контакта. Исключение составляет теплообмен излучением. Таким образом, теплота и работа представляют собой количественные меры, оценивающие передачу энергии от одного объекта (системы) к другому. Они не являются параметрами состояния, а относятся к функциям происходящих процессов.
Дата добавления: 2015-12-16; просмотров: 16; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
