Параметры состояния рабочего тела. Уравнение состояния идеального газа
Р,Т,v – термические парам. состояния. u,S,h – калорические.
Р – абсолютное давление газа представляет собой средний результат силового воздействия молекул на стенки сосуда и равно отношению нормальной составляющей силы к площади, на которую действует сила. 1Па=1 Н/м*2; 1кПа= 10*3 Па; 1МПа= 10*6 Па; 1бар=10*5Па=0,1МПа
V – удельный объем – это объем, занимаемый единицей массы вещества m и выражаемый в м*3/кг
Т – абсолютная темп. – мера интенсивности теплового движения молекул тела и определяется средней кинетической энергией движения молекул газа.
Шкала Кельвина – К,шкала Цельсия - °С; 1С=273,16К. ΔТ=Δt.
u – удельная внутренняя энергия – это внутренняя энергия отнесенная к 1 кг массы тела. Дж/кг.
h – удельная энтальпия. Если газ находится в среде с давлением р, то с любым состоянием его связана некоторая энергия u+ pv= h, получившая название удельная энтальпия газа в данном состоянии. Дж/кг, кДж/ кг.
S – энтропия – параметр состояния, дифференциал которого равен отношению бесконечно малого количества теплоты δQ в элементарном обратимом процессе к абсолютной температуре Т, постоянной на бесконечно малом участке процесса. Дж/(кгК).Идеальный газ – это газ где размерами молекул можно пренебречь и между молекулами этого газа не происходит никакого взаимодействия.
Для идеального газа уравнение состояния имеет вид: pv= RT, где R – удельная газовая постоянная, R=Rμ/μ, R= 8,314.
|
|
|
Теплота и работа
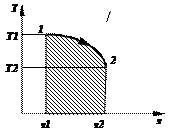
Работа – это механический эффект взаимодействия рабочего тела с окружающей средой, который связан с изменением объема, когда на всю поверхность рабочего тела действует равномерно распределенное давление внешней среды, что равно давлению рабочего тела р. Для обратимых процессов: δL = pdV
или L = 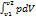 , Дж. Правило знаков. Знак термодинамической работы определяется знаком произведения pdV. Отметим, что в выражение для работы входит значение давления собственно газа, т.е. абсолютное давление газа. Однако, т.к. ранее было установлено, что всегда pа > 0, то знак работы определяется знаком изменения dV:
, Дж. Правило знаков. Знак термодинамической работы определяется знаком произведения pdV. Отметим, что в выражение для работы входит значение давления собственно газа, т.е. абсолютное давление газа. Однако, т.к. ранее было установлено, что всегда pа > 0, то знак работы определяется знаком изменения dV:
- при dV> 0® рабочее тело (газ) расширяясь совершает работу против внешних сил, работа положительна dL > 0 и берется в вычислениях со знаком «+»;
- при dV< 0® внешние силы совершают работу над рабочим телом (газом), работа отрицательна dL < 0 и берется в вычислениях со знаком «-».
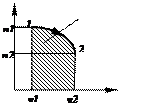 Располагаемая работа – механический эффект взаимодействия рабочего тела со
Располагаемая работа – механический эффект взаимодействия рабочего тела со
средой при перемещении его
из области с давлением р1 в область с давлением р2. Lp= - 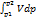 , Дж
, Дж
Теплота – это форма передачи энергии в виде неупорядоченного движения частиц. δQ= TdS,Дж; Q= 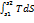 Правило знаков. Знак теплоты определяется знаком произведения TdS. Отметим, что в выражение для теплоты входит значение давления собственно газа, т.е. абсолютное давление газа. Из приведенного выше рисунка шкалы Кельвина ясно, что всегда T > 0, то знак теплоты определяется знаком изменения dS:
Правило знаков. Знак теплоты определяется знаком произведения TdS. Отметим, что в выражение для теплоты входит значение давления собственно газа, т.е. абсолютное давление газа. Из приведенного выше рисунка шкалы Кельвина ясно, что всегда T > 0, то знак теплоты определяется знаком изменения dS:
|
|
|
- при dS> 0® к рабочему телу теплота подводится теплота положительна dQ > 0 и берется в вычислениях со знаком «+»;
- при dS< 0® теплота отводится от рабочего тела, теплота отрицательна dQ < 0 и берется в вычислениях со знаком «-».
 | |||
| |||
Теплоемкость
Теплоемкость -это физ. Свойство материала равное отношению теплоты к изменению температуры в данном процессе. Теплоемкость – это количество теплоты, которое необходимо подвести к рабочему телу, чтобы увеличить его температуру на 1 Кельвин (градус Цельсия). При элементарном, бесконечно малом подводе или отводе теплоты теплоемкость называют истинной. Cx= δQ/dT, Схср.=Ĉx= Q/ΔT; х – обозначает процесс: Ср или Сv. В зависимости от выбранной единицы количества вещества различают теплоемкости:
|
|
|
Удельную, отнесенную к 1 кг вещества: Сх, кДж/(кгК)
Объемную, отнесенную к 1 м*3 вещества при н.у.(температуре 273,16К(0°С) и давлении 101,325 кПа(760 мм. рт. ст.)):Ćх, кДж/(м*3К);
Молярную, отнесенную к 1 кмоль вещества: μСх, кДж/ (кмольК)
Эти теплоемкости связаны между собой соотношениями Сх=μСх/μ=Ćхv; Ćх= μСх/ 22,4= Схр.
Особый интерес представляют теплоемкость в процессе при постоянном объеме Сv(изохорная теплоемкость, равная отношению удельного количества теплоты в изохорном процессе δqv к изменению температуры рабочего тела dT): Cv= δqv/dT и теплоемкость в процессе при постоянном давлении Ср(изобарная теплоемкость, равная отношению удельного количества теплоты в изобарном процессе δqp к изменению температуры рабочего тела dT): Cp=δqp/dT
 Зная теплоемкость тела теплоту обратимого процесса
Зная теплоемкость тела теплоту обратимого процесса
можно определить: δq=δQ/m=cdT;
q= 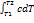
Первый закон ТД
1 ТД – для тепломеханических систем теплота подведенная к телу идет на совершение работы и на изменение внутренней энергии тела. Q=ΔU + L – записанный в таком виде общий принцип сохранения энергии в ТД процессе наз. матем. выражением 1ТД. Энергию, соответствующую малекулярно-хаотическому движению, в ТД наз. внутренней энергией;состоит она из кинет. Энергии движения молекул и потенц. Энергии сил межмолекулярного взаимодействия.В любом термодинамическом процессе разность подведенной к рабочему телу теплоты и произведенной этим телом работы не зависит от пути процесса, определяется только начальным и конечным состоянием рабочего тела и может быть определена как изменение внутренней энергии тела. Если газ находится в среде с давлением р, то с любым состоянием его связана некоторая энергия d(U+ pV)=dH, получившая название энтальпия газа в данном состоянии.
|
|
|
Выражение 1ТД через энтальпию: δq=dh+δlp; q= Δh+ lp. Математическая запись 1ТД для закрытых с-м Q=ΔU+L; q+Δu+l;δq=du+δl. Для цикла Qц=Lц;Qц=Lpц.
Дата добавления: 2015-12-19; просмотров: 31; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

 всегда в термодинамической шкале температур Кельвина Т > 0. Следовательно, если
всегда в термодинамической шкале температур Кельвина Т > 0. Следовательно, если 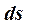 > 0 – теплота имеет знак «+», т.е. подводится к рабочему телу; если
> 0 – теплота имеет знак «+», т.е. подводится к рабочему телу; если