Основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они ассоциируются.
| Катионы | Анионы |
| Кальций (Ca2+) | Гидрокарбонат (HCO3-) |
| Магний (Mg2+) | Сульфат (SO42-) |
| Стронций (Sr2+) | Хлорид (Cl-) |
| Железо (Fe2+) | Нитрат (NO3-) |
| Марганец (Mn2+) | Силикат (SiO32-) |
На практике стронций, железо и марганец оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al3+) и трехвалентное железо (Fe3+) также влияют на жесткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, "вклад" в жесткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+).
Различают следующие виды жесткости.
Общая жесткость. Определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
Карбонатная жесткость. Обусловлена наличием в воде гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция и гидроксида магния.
Некарбонатная жесткость. Обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость).
Выделяют 2 типа жесткости воды:
- временная – карбонатная жесткость, обусловлена присутствием на ряду с кальцием, магнием и железом гидрокарбонатных анионов;
|
|
|
- постоянная – некарбонатная жесткость, характеризуется присутствием сульфатных, нитратных и хлоридных анионов, соли кальция и магния которых прекрасно растворяются в воде;
- общая жесткость определяется как суммарная величина наличия солей магния и кальция в воде, то есть суммой карбонатной и некарбонатной жесткости.
Принято классифицировать жесткость воды следующим образом:
- мягкая вода – жесткость 3,0 мг-экв/л и более
- средняя жесткость – от 3,0 до 6,0 мг-экв/л
- жесткая вода – свыше 6,0 мг-экв/мл.
Задание:
1. Определение карбонатной жёсткости
Методика определения:
В коническую колбу вносим 50 мл воды, добавляем 2 капли метилового оранжевого. Пробу титруем 0,1 М раствором соляной кислоты до перехода в оранжевую.
Карбонатную жёсткость определяем по следующей формуле:
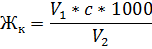
V1 – объём раствора соляной кислоты, пошедший на титрование пробы в присутствии метилового оранжевого, мл
V2 - объём пробы, мл
C – концентрация раствора соляной кислоты (моль/л)
Жк - карбонатная жёсткость
Сделайте вывод.
Контрольные работы:
1. Что такое жёсткость?
2. Наличием каких ионов обусловливается жёсткость?
|
|
|
3. Какие виды жёсткости существуют?
Дата добавления: 2015-12-18; просмотров: 16; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
