Атомное строение тел. Различные состояния вещества.
Кроме того, что свойства соединения зависят от его состава, очевидно, что большое значение имеет атомное строение тел, т.е. расположение атомов в пространстве. Действительно, напомним самый простой пример: хотя вода и лед имеют один и тот же химический состав, свойства их существенно различны.
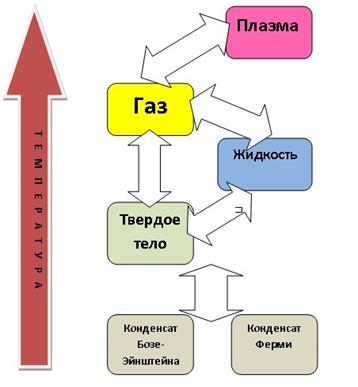
Очевидно, что с понятием структуры связаны и агрегатные состояния вещества. Большинство веществ может существовать в трёх агрегатных состояниях — твёрдом, жидком и газообразном. Например – вода, которая при обычном давлении (p= 760 мм рт.ст.) может находиться в виде льда (при t < 0ОС), жидкости (от нуля до 100ОС) и водяного пара (при t>100OC).
Четвёртым агрегатным состоянием вещества считают плазму.
Переход из одного агрегатного состояния вещества в другое сопровождается скачкообразным изменением расстояний между молекулами (атомами) (и, как следствие) межмолекулярных взаимодействий. Как известно, в любом веществе его частицы (молекулы, атомы) находятся в непрерывном движении, и степень (интенсивность) этого движения характеризует температура. С другой стороны, эти частицы взаимодействуют между собой благодаря наличию химических связей. При низких температурах энергия связей частиц больше энергии тепловых колебаний частицы, частицы не могут «удалиться» друг от друга на большие (конечно, по сравнению с размерами атомов, т.е. 10-8см) расстояния - вещество существует в твердом состоянии. Зачастую частицы образуют правильную геометрическую структуру, в таком случае, говорят о кристаллической структуре. У твёрдых тел в кристаллообразном состоянии атомы совершают только колебания около равновесных положений, или узлов кристаллической решётки; структура этих тел характеризуется высокой степенью упорядоченности — дальним и ближним порядком. Если дальний порядок отсутствует, то имеем аморфное состояние (например, стекло).
|
|
|
|
| Агрегатные состояния вещества |
При повышении температуры энергия тепловых колебаний частиц возрастает, энергия тепловых колебаний увеличивается и энергии связей уже недостаточно, чтобы удерживать частицы. Связи между частицами постоянно разрушаются и вновь образуются, частицы начинают двигаться не только около положений равновесия, но и перемещаться на достаточно большие расстояния. Однако они еще остаются в контакте, хотя правильная геометрическая структура частиц нарушается — вещество существует в жидком состоянии. Иными словами, молекулы (атомы) колеблются около положений равновесия и совершают перескоки из одного положения равновесия в другое. При этом в жидкостях наблюдается порядок только в расположении ближайших частиц (ближний порядок, в отличие от дальнего порядка в кристаллах), а также свойственные им подвижность и текучесть.
|
|
|
При дальнейшем повышении температуры тепловые колебания увеличиваются, в результате молекулы практически не взаимодействуют друг с другом и движутся фактически свободно, заполняя весь объём. Вещество переходит в газообразное состояние. В “идеальном” газе частицы свободно перемещаются во всех направлениях.
Если еще сильнее повысить температуру (до тысяч или даже десятков тысяч градусов, то удастся «разрушить» атомы и перевести вещество в четвертое состояние - плазму, которая представляет собой газ, состоящий из смеси нейтральных и ионизованных молекул и электронов. Таким образом, при переходах твердое тело ® жидкость ® газ ® плазма происходит «уничтожение» порядка на различных уровнях.
Указанные четыре основные состояния вещества - плазменное, газообразное, жидкое и твердое (перечисленные в порядке существования при понижении температуры), известны давно, однако на сегодня ученые выделяют еще два состояния – низкотемпературные конденсаты. Конденсат - новое состояние вещества при сверхнизких температурах - меньше 0.00000001 К (!!!), т.е. при температурах ниже температуры космического вакуума (в космосе температура около 3 К).
|
|
|
Покажем на конкретном примере твердого тела влияние атомной структуры на свойства материала. Для этого выберем простой одноатомный материал - углерод.
В твердом состоянии углерод может быть кристаллическим и аморфным и каждое его состояние имеет свое название.
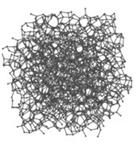
1. Сажа - аморфный углерод в виде порошка тонкого помола (к настоящему времени установлено, что по своей структуре в саже, коксе, стеклообразном углероде и им подобных материалах углерод в разной степени приближается к графиту. Говоря о свойствах сажи, можно отметить, что электропроводность сажи равна нулю, т.е. сажа - электрический изолятор.
|
| Структура аморфного графита |
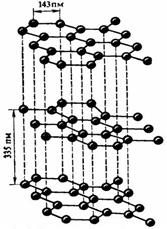
2. До начала 60-х годов считалось, что в природе существуют только две кристаллические формы чистого углерода, а именно трех- и двумерные полимеры, т.е. алмаз и графит. Структура графита характеризуется слоями; атомы в слоях сильно связаны друг с другом, в то время как межслоевые взаимодействия незначительны. Поэтому графит легко расщепляется по слоям, он - мягкий кристаллический материал. В отличие от сажи, графит - очень хороший проводник электричества.
|
|
|
|
| Кристаллическая структура графита |
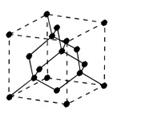
3. Алмаз обладает кубической кристаллической структурой, построенной все из тех же самых атомов углерода. В отличие от графита, алмаз - твердый кристаллический материал (возможно, самый твердый). Такие свойства связаны с его структурой, поскольку все атомы равноудалены друг от друга и крепко “связаны” друг с другом.
|
| Кристаллическая структура алмаза |
4. В 1985 г. было открыто большое семейство сферообразных углеродных молекул – фуллеренов. Фуллерены - новый вид углерода. Это замкнутые молекулы типа С60, С70, С74..., в которых все атомы углерода находятся на “сферической” поверхности. В структуре фуллерена С60 (диаметр молекулы составляет около 1 нм) атомы углерода расположены в вершинах правильных шестиугольников или пятиугольников (в конденсированном (кристаллическом) состоянии фуллерены называются фуллеритами). Фулллерены были найдены в некоторых природных минералах, например, в карельском шунгите. На основе фуллерена были синтезированы новые классы веществ: например, при взаимодействии с металлами получены фуллериды.
Интересные свойства этих материалов связаны с “захватом внутрь” шара различных атомов - Na, K. Полученные фуллериды обладают сверхпроводимостью (при температурах 19-55 K), а при использовании металлов платиновой группы дополнительно проявляются ферромагнитные свойства. Интересным свойством фуллеренов при низких температурах и давлении является способность поглощать водород. В связи с этим возможно использовать фуллерены в качестве основы для производства аккумуляторных батарей. В капсуле фуллерена могут помещаться лекарственные препараты, которые будут избирательно доставляться к поврежденному органу или ткани.
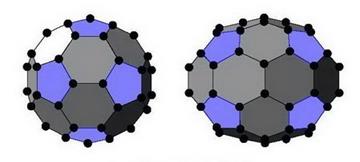
|
| Кристаллическая структура молекул С60 (слева) и С70 (справа). |
5. Графитовые нанотрубки - новый вид углерода, получены в 1991 г. Углеродная нанотрубка может быть представлена как свернутая в виде цилиндра графитовая плоскость. Трубки могут быть одностенными и многостенными, если получены из нескольких графитовых слоев. Диаметр трубки колеблется от одного до нескольких десятков нанометров, а длина может доходить до нескольких сантиметров; обычно трубки заканчиваются полусферической головкой. Углеродные нанотрубки обладают уникальными механическими (очень прочные), электрическими и термическими свойствами (электропроводность и теплопроводность приближались или превышали показатели металлов).
 
|
| Одностенные и многостенные углеродные нанотрубки |
6. Нобелевская премия в области физики 2010 года присуждена выходцам из России, работающим в Великобритании, Андре Гейму и Константину Новосёлову "за новаторские эксперименты по исследованию двумерного материала графена". В 2004 году они экспериментально доказали возможность получения особой формы углерода, представляющей собой лист толщиной в один атом, соединенных в двумерную кристаллическую решетку из правильных шестиугольников. Иными словами, графен - это один отдельный слой хорошо известного графита. Графен самый тонкий и самый прочный из известных материалов, с другой стороны он очень гибок, способен проявлять свойств как проводника (вспомним графит), так и полупроводника.
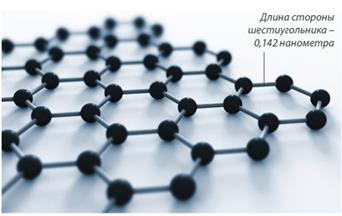
|
| Структура графена |
Вышеперечисленные примеры неорганических материалов дают веские доказательства того, что свойства соединений в значительной мере определяются атомной структурой материала. Еще больший успех в этом направлении выпал на долю органической химии, когда в результате органического синтеза было получено много новых материалов.
Новые подходы к синтезу новых неорганических материалов
В последние годы наблюдается интенсивное развитие различных областей науки и техники, связанных с применением неорганических материалов – это и машиностроение, и космическая и военная индустрия, и атомная отрасль. Постановка этих вопросов заставляет искать нетривиальные способы решения, например, выращивать некоторые кристаллы в космосе или использовать взрывные технологии.
Что же могут предложить ученые, чтобы расширить диапазон применяемых методик при создании (синтезе) новых материалов, учитывая роль химических процессов? Казалось бы, с уменьшением температуры должно уменьшатся число активных молекул и, следовательно, скорость реакции. Но неожиданно оказалось, что возможен синтез материалов при низких температурах жидкого азота – мы говорим о криохимии. В этом случае протекание реакций при низких температурах связано с изменением механизма процесса, поскольку образуются легко разлагающиеся (термически нестойкие) молекулярные комплексы, которые и участвуют в данном химическом процессе. Кроме того, понижение температуры по-разному влияет на механизм сопутствующих друг другу взаимодействий, что позволяет реализовать высокоселективный химический процесс (побочные химические процессы при низких температурах подавляются).
Идея криохимической технологии твердофазных материалов, зародившаяся свыше тридцати лет назад в Московском государственном университете и впервые реализованная академиком Ю.Д. Третьяковым, позволяет получать на основе криопорошков высококачественную керамику.
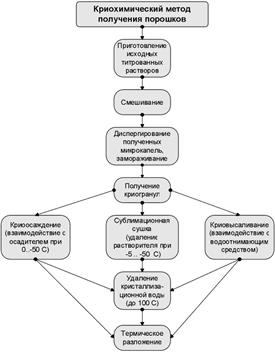 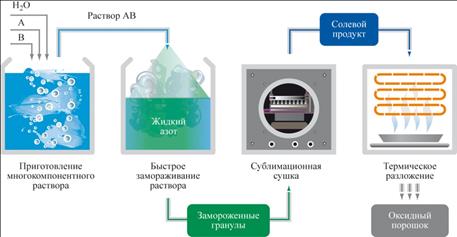
|
| Основные этапы криохимической технологии |
Другой пример нового направления в синтезе материалов лежит далеко от низких температур – в области высоких температур, при которых осуществляются реакции горения одного металла в другом или металла в азоте, углероде, кремнии. Это так называемый самораспространяющийся высокотемпературный синтез (СВС) тугоплавких материалов, открытый в 1967 году академиком Мержановым А.Г.

|
| Основные этапы процесса СВС |
В смеси порошков в одном месте осуществляется локальный разогрев («поджиг») и начинается реакция синтеза. Выделившееся в результате экзотеpмической реакции тепло нагревает соседние (более холодные) слои вещества, в которых возбуждается реакция и возникает самоподдерживающийся процесс. В таком процессе химическая реакция, сопровождающаяся ярким свечением, протекает в узкой зоне, которая самопроизвольно распространяется по материалу. Такой процесс является разновидностью горения и рассматривается на основе теории горения.
Не останавливаясь подробно, перечислим еще ряд новых, интересных и перспективных научных направлений, использующих различные нетрадиционные подходы к синтезу материалов:
· Механохимия – изучает превращения вещества при механических воздействиях (трение, ультразвуковое облучение, взрыв). Механохимические реакции связаны с переходом вещества в метастабильное химически активное состояние, а также интенсификацией массопереноса в результате поглощения механической энергии.
· Плазмохимия - изучает химические процессы в низкотемпературной плазме. Основная особенность таких процессов связана с образованием большого числа разнообразных реакционноспособных частиц (возбуждённых молекул, электронов, атомов, атомарных и молекулярных ионов, свободных радикалов, причем возникновение некоторых из таких частиц возможно только в плазме), которые обусловливают новые типы химических реакций.
· Лазерная химия - изучает химические процессы, стимулируемые лазерным излучением. Например, селективность процессов связана с высокой монохроматичностью лазерного излучения, что позволяет возбуждать молекулы только одного вида; большая интенсивность лазерного излучения дает возможность получать возбужденные реакционные частицы в высоких концентрациях.
· Радиационная химия - изучает воздействие ионизирующих излучений на химические процессы.
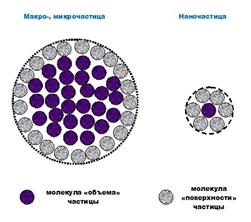
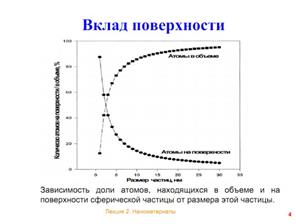
В настоящее время активно развиваются новые технологии производства материалов: наиболее модным, интересным и возможно, перспективным является подход, базирующийся на создании наноматериалов разнообразных типов. К наноматериалам относятся материалы, размер которых составляет 10-100 нм (1 нм=10-9 м), т.е. это порошки очень «тонкого помола». В этом случае нужно учитывать, что фактически не остается «внутренних» атомов, которые находятся в объеме частицы – большая часть атомов находится на поверхности частицы.
 а
а
|  б
б
|
| (а) Схематический вид частиц разного размера; (б) Доля атомов, находящихся в объеме и на поверхности сферической частицы в зависимости от размера частицы. |
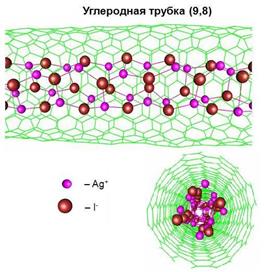
Оказалось, что такие материалы обладают свойствами, недостижимыми для обычных объектов: например, прочность нанокерамики возрастает в десятки раз по сравнению с прочностью керамики, полученной по стандартной технологии. На рисунке представлен фрагмент моделирования структуры нанокомпозита иодистого серебра, внедренного в одностенную углеродную нанотрубку; такие необычные материалы уже синтезированы в лабораториях.
а
 б
б
|
| Фрагмент структуры AgI-углеродная нанотрубка |
Очевидно, что задачи получения новых материалов очень сложны и объединяют различные стороны человеческой деятельности.
|
Говоря только о новых твердотельных материалах, можно поражаться, насколько широк их спектр – это материалы со сверхвысокими температурами плавления для реакторов атомных станций; новые оптоволоконные стекла для кабеля, по которому идет передача огромных объемов информации по Интернету; «умные» материалы с памятью формы или стекла с регулируемым «пропусканием света»; биоматериалы для костных протезов, которые не отторгаются человеческим организмом; материалы для молекулярных компьютеров и т.п. Из новых перспективных функциональных материалов остановимся чуть подробнее на двух интересных классах - сверхпроводниках и твердых электролитах.
Сверхпроводники
Из школьного курса известно, что металлы лучше других материалов проводят электрический ток, причем электросопротивление металлов уменьшается при понижении температуры. (Почему?) В 1911 года, когда сверхпроводимость была открыта знаменитым голландским физиком Х. Камерлинг-Оннес обнаружил, что при температуре 4.2 К электрическое сопротивление твердой ртути становится равным нулю. Вскоре было показано, что и в ряде других металлах при очень низких температурах (5-10 К), т.е. около температуры абсолютного нуля, сопротивление исчезает, становится практически равным нулю и появляется сверхпроводимость. По своей природе сверхпроводимость — это квантовый эффект: электроны в сверхпроводниках ведут себя как совокупность так называемых «куперовских пар», и двигаются через кристаллическую решетку металла, не замечая «самих атомов».

|
| Механизм сверхпроводимости |
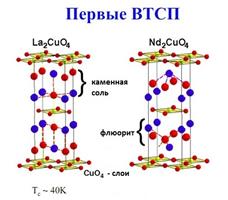
В последние 20 лет XX столетия сверхпроводимость было установлена в оксидной керамике, которая обычно ведет себя как диэлектрик или полупроводник. Были синтезированы керамические материалы, у которых сверхпроводимость наблюдается при существенно высоких температурах: в La2-xBaxCuO4 - при 40 К, в YBa2Cu3O7 - при 90 К, в Tl2Ba2Ca2Cu3O10 - при 125 К, в Hg2Ba2Ca2Cu3O10 - при 134 К (рис. 26) (Третьяков Ю.Д., 2000). Затем научной сенсацией 2008 г. стало открытие принципиально нового вида сверхпроводящих материалов типа Ba(Fe0.93Co0.07)2As2,(может, указать температуру?) в состав которых входило железо (ранее одновременное присутствие в образце железа и его сверхпроводимость считалось невозможным). Синтез различных высокотемпературных сверхпроводящих материалов означает, что возможно создание сверхпроводящих проводов, в которых потери при передаче электроэнергии будут ничтожно малы, возможно на несколько порядков повысить быстродействие ЭВМ, возможно создание новых типов электротранспорта.
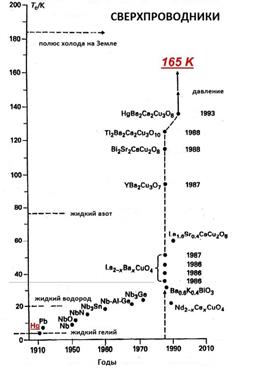
|  Ртутные ВТСП
Ртутные ВТСП
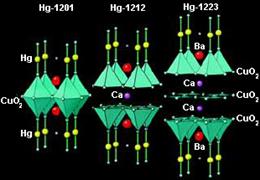
|
| История создания сверхпроводниковых материалов |
Твердые электролиты, или суперионные проводники
Из школьного курса физики известно, что существуют электрические проводники 1-го и 2-го рода: в проводниках 1-го рода ток переносится электронами, а в проводниках 2-го рода - ионами. При этом примерами проводников 2-го рода обычно служат растворы электролитов, поскольку в твердых телах большим ионам трудно двигаться в кристаллической решетке. Поэтому большинство батарей используют различного рода жидкие электролиты. Однако оказалось, что есть соединения, структура которых устроена таким образом, что в ней существует свободное пространство, по которому могут двигаться достаточно легко ионы небольшого размера (Li+, Na+, Ag+). При этом оказывается, что ионная проводимость таких материалов сравнима с ионной проводимостью жидких электролитов, из-за чего эти соединения получили название твердых электролитов (или суперионных проводников, что подчеркивает высокие значения ионной проводимости). В настоящее известно большое количество твердых электролитов, в которых проводимость обеспечивается самыми различными катионами - серебра, меди, лития, а также анионами – кислорода, фтора.
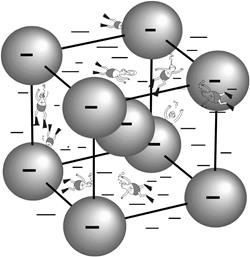
|
| Схематический вид структуры ионного проводника AgI (шары – анионы иода, пловцы – катионы серебра). |
Не следует считать, что суперионные фазы – некая экзотика: оказалось, что в состав мантии Земли входят NaMgF3 и MgSiO3, которые проявляют твердоэлектролитические свойства при высоких температурах. Даже хорошо известная вода преподносит сюрпризы: недавно было рассчитано экзотическое состояние воды: ни лёд, ни газ, ни жидкость, а - суперионик.
Материалы, обладающие суперионной проводимостью, находят применение в различного вида аккумуляторах и батареях, топливных элементах и газовых сенсорах.
Как отмечалось в самом начале этой главы, сегодня химия переходит на новый этап – этап эволюционного развития. Это означает, что ученые думают о том, можно ли решить проблему самопроизвольного (без участия человека) синтеза новых химических соединений. Академик А.Е.Арбузов писал: «Чем же химия будущего должна отличаться от химии настоящего? Подражание живой природе есть химия будущего! И в тот день, когда в лаборатории будет синтезирован первый фермент, т.е. биокатализатор, мы можем сказать, что наука получила в свои руки ключ, который она так долго и упорно ищет, - это ключ к химии живой природы». На этом пути необходимо возможно решение нескольких задач в области каталитической химии:
· развитие исследований в области металлокомплексного катализа с ориентацией на соответствующие объекты живой природы;
· моделирование биокатализаторов на основе ферментов с высокой активностью и селективностью;
· создание иммобилизованных систем (стабилизация выделенных из живого организма ферментов на твердой поверхности) для их использования в качестве гетерогенных катализаторов;
· применение принципов биокатализа в химии и химической технологии.
Например, по принципу ферментов будут созданы катализаторы, намного эффективнее имеющихся, или построены преобразователи (с большим КПД) солнечного света в химическую и электрическую энергию, как это делают живые организмы.
Эволюционная химия - это химия будущего, хотя и близкого. Но можно ли уже сегодня ставить вопрос о синтезе новых материалов с заранее заданными свойствами? Есть ли возможность смоделировать материал и выяснить, какими свойствами обладает данный материал? Ответ на этот вопрос сегодняшняя наука дает положительный.
Кратко остановимся на методе молекулярной динамики (МД). Рассмотрим, например, ионный кристалл, который состоит из ионов двух сортов. Между ионами А и В действуют силы (в основном электростатические), которые легко можно рассчитать. Рассмотрим ион А1 и вычислим суммарную силу F со стороны остальных ионов. Под действием этой силы согласно 2-му уравнению Ньютона ион с массой m1 приобретает ускорение a1=F1/m1. Вследствие ускорения ион А1 начнет перемещаться. Если это движение будет рассматриваться в течение очень короткого времени (за которое сила практически не изменится), то можно рассчитать, в какую точку перейдет ион А1. Затем точно так же можно определить, где окажется частица В1 и так далее.
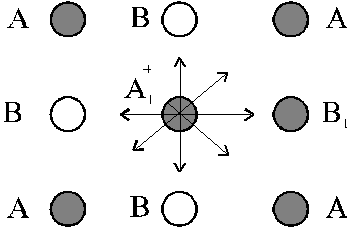
|
| Взаимодействия в двумерном кристалле. |
В 1 см3 вещества содержится примерно 1023 атомов, значит, нам надо решить 1023 уравнений движения для каждого атома. Это, конечно, нереально, однако оказывается, что достаточно решить задачу для 100-1000 частиц, и полученное решение будет адекватно описывать свойства реальной системы. В качестве примера решения такой задачи на рисунке ниже показаны траектории движения анионов кислорода с сложном купрате лантана-стронция La2-xSrxCuO4-d: на микроскопическом уровне диффузия кислорода осуществляется перескоками в ближайшие позиции или более сложным образом, через вакантные решеточные позиции.
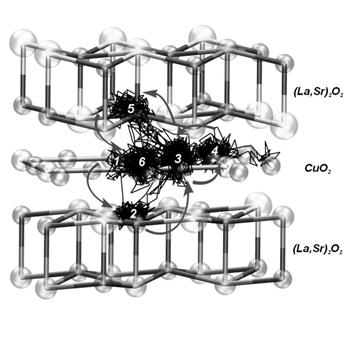
|
| Кислород О1 в слоях CuO2 осуществляет перескоки типа 3à4à3, а также переходит в вакантные места в ((La,Sr)2O2)- блоках (переходы 1à2, 3à5) и обратно (переходы 2à3, 5à6). |
Рассмотренный пример показывает возможность моделирования и предсказания физических свойств реальных материалов.
Наконец отметим, что современная химия помогает объяснить этап предбиологической эволюции и перейти от химической эволюции к биогенезу, подтвердить научное понимание происхождения жизни во Вселенной.
Спасибо, что ознакомились с еще одной интересной темой.

Что такое самоорганизация?
Почему из хаоса возникают сложные, упорядоченные системы.
Образование упорядоченных структур, происходящие не за счет действия внешних сил (факторов), а в результате внутренней перестройки системы, называется самоорганизацией. Самоорганизация - фундаментальное понятие, указывающее на развитие в направлении от менее сложных объектов к более сложным и упорядоченным формам организации вещества.
В каждом конкретном случае самоорганизация проявляется по-разному, это зависит от сложности и природы изучаемой системы.
|
Разномасштабные самоорганизующиеся системы независимо от того, к какому разделу науки они относятся, имеют единый алгоритм перехода от менее сложных и менее упорядоченных к более сложным и более упорядоченным состояниям.
Разработкой теории самоорганизации занимаются несколько научных дисциплин:
1. Термодинамика неравновесных (открытых) систем.
2. Синергетика.
3. Теория катастроф.
Как идет процесс превращения?
В каком направлении? Почему тепло переходит от горячего тела к холодному? Почему пирамида Хеопса разрушается, а не восстанавливается?
Обратимые и необратимые процессы.
В физике вводится понятие энтропии, как меры беспорядка в системе.
Произвольно идущие процессы протекают в направлении увеличения энтропии, т.е. беспорядка в системе (точнее говорить о вероятности направления протекания процесса).

|
Может ли воздух собраться «сам» в одной половине сосуда? Конечно, нет (точнее, Р= 5•10-22).
Неравновесные процессы и открытые системы.
Кристаллы – упорядоченные равновесные структуры
Рассматрим несколько примеров, чтобы понять, о чем идет речь.
1. Циркуляционные потоки в атмосфере и океанах Земли - под действием солнечного излучения: - самоорганизация на Земле.
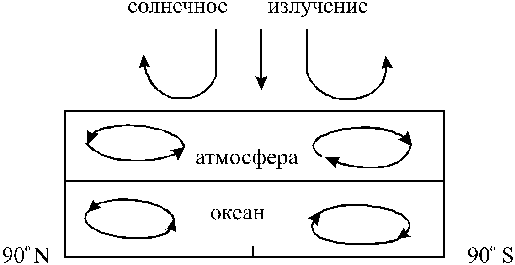 Образование упорядоченных вихрей в атмосфере и океанах Земли.
Образование упорядоченных вихрей в атмосфере и океанах Земли.
|
Общей циркуляцией атмосферы называют замкнутые течения воздушных масс в масштабах полушария или всего земного шара, приводящие к широтному и меридиональному переносу вещества и энергии в атмосфере.
Главной причиной возникновения воздушных течений в атмосфере служит неравномерное распределение тепла на поверхности Земли, что приводит к неодинаковому нагреванию почвы и воздуха в различных поясах земного шара. Таким образом, солнечная энергия является первопричиной всех движений в воздушной оболочке Земли.
Циркуляционные потоки в атмосфере и океанах Земли: это пример самоорганизация на Земле.
2. Ячейки Бенара - самоорганизация в физических явлениях.


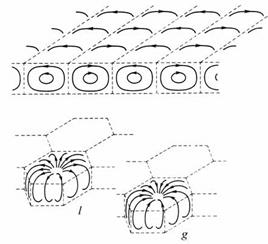
Ячейки Бенара или Рэлея-Бенара — возникновение упорядоченности в виде конвективных ячеек в форме цилиндрических валов или правильных шестигранных структур в слое вязкой жидкости с вертикальным градиентом температуры, т.е. равномерно подогреваемой снизу. В качестве жидкости используется, как правило, силиконовое масло.
3. Химическая реакция Белоусова-Жаботинского - самоорганизация в химии.
Реакция Белоусова — Жаботинского — химическая реакция, в которой возникают хаотические автоколебательные процессы. В настоящее время найдены многие реакции с таким свойством.
В 1951 Б. П. Белоусов обнаружил автоколебания в реакции окисления бромата калия КBrO3 малоновой кислотой HOOC-CH2-COOH в кислотной среде в присутствии катализатора — ионов церия Ce+3. Течение реакции меняется со временем и раствор периодически меняет цвет от бесцветного (Ce+3) к жёлтому (Ce+4) и обратно. Эффект ещё более заметен в присутствии индикатора pH ферроина. Наиболее эффектно выглядит колба, если вместо лимонной кислоты использовать малоновую, а вместо ионов церия ионы железа Fе2+. Тогда раствор в колбе может часами со строгой как часы периодичностью изменять цвет во всем видимом диапазоне от рубиново-красного до небесно-голубого. Сообщение Белоусова было встречено в научных кругах скептически, поскольку считалось, что автоколебания в химических системах невозможны.
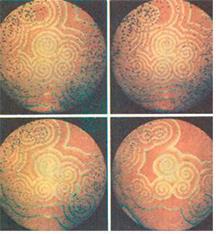
В 1961 механизм реакции Белоусова был объяснён аспирантом А. Жаботинским, но эта работа оставалась малоизвестной до 1968 года. В 1969 Жаботинский с коллегами обнаружили, что если реагирующую смесь разместить тонким плоским слоем, в нём возникают волны изменения концентрации, которые видны невооружённым глазом в присутствии индикаторов.
Таким образом, имеется автоколебательный процесс изменения концентрации четырехвалентного церия с одновременным варьированием цвета
На поверхности раствора появляются поверхностные волны (химические спиральные волны)


4. Динамика популяций хищников и их жертв - самоорганизация в биологии.
Перенесемся теперь из мира атомов в макромир и попробуем предсказать соотношение числа волков и зайцев в некотором гипотетическом заповеднике, где на огражденной территории живут только эти представители фауны, а флоры пусть будет много. Поскольку волки хищники, то могут в данном заповеднике питаться только зайцами, а жертвы - зайцы питаются только травкой.
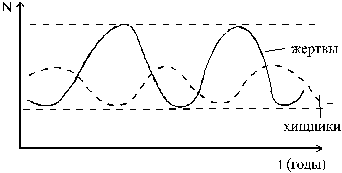
В конечном счете, нас интересует - будет ли такое экологическое сообщество устойчиво сосуществовать в заповеднике. Экспериментальные данные полученные в реальной многокомпонентной и открытой среде с множеством неучтенных взаимодействий, указывают на факт наличия устойчивых колебаний популяций свидетельствует о том, что модель работоспособна и оправдывает надежды по предсказанию.
Неравновесные процессы с возникновением в системах упорядоченных структур – диссипативных структур. Самоорганизация не связана с особым классом веществ, но она существует лишь в специальных системах, удовлетворяющих условиям:
а) открытые системы, т.е. открытые для притока энергии (вещества) извне;
б) макроскопические системы, т.е. системы описываются нелинейными уравнениями.
Следует также отметить, что диссипативные структуры являются устойчивыми образованиями, и их устойчивость определяется устойчивостью внешнего источника энергии.
В природе существуют и иные упорядоченные структуры, которые возникают в диссипативных системах. Диссипативная система является подсистемой больших неравновесных термодинамических систем.
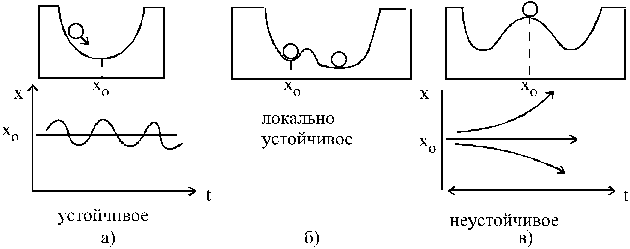
Устойчивость и неустойчивость. Критические состояния. Бифуркации. Асимметрия.
|
Неравновесная термодинамика связала пороговый характер с неустойчивостью, показав, что новая структура всегда является результатом раскрытия неустойчивости в результате флуктуаций. Можно сказать о "порядке через флуктуации". С математической точки зрения, неустойчивость и пороговый характер самоорганизации связаны с нелинейностью. Таким образом, пороговый характер самоорганизации связан с переходом из одного стационарного состояния в другое.
Потеря системой устойчивости называется катастрофой. Точнее, катастрофа - это скачкообразное изменение, возникающее при плавном изменении внешних условий. Математическая теория, анализирующая поведение нелинейных динамических систем при изменении их параметров, называется теорией катастроф.
Теория катастроф определяет область существования различных структур, границы их устойчивости. Для изучения же динамики систем необходимо знать, каким именно образом новые решения уравнений "ответвляются" от известного решения. Ответ на такие вопросы дает теория бифуркаций (разветвлений), то есть возникновения нового решения при критическом значении параметра. Момент перехода (катастрофический скачок) зависит от свойств системы и уровня флуктуаций.
Возникновение нового качества происходит на основании усиления малых случайных движений элементов – флуктуаций. Это в частности объясняет тот факт, что в момент бифуркации состояния системы возможно не одно, а множество вариантов структурного преобразования и дальнейшего развития объекта. Таким образом, сама природа ограничивает наши возможности точного прогнозирования развития, оставляя, тем не менее, возможности важных качественных заключений.
В сложных системах параметр (характеристика или свойство системы) X может изменяться под действием управляющего (или возмущающего) параметра l. Рассмотрим диаграмму (X,l). Оказывается, что при малых l существует одно решение, характеризующее термодинамически устойчивое состояние, а при больших l - существует два устойчивых состояния с разными значениями X. Переход к новому состоянию при lкр под действием флуктуации называется явлением бифуркации.
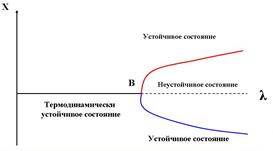
Механический аналого точки бифуркации.
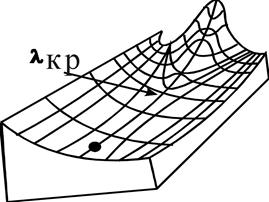
Если "бутылка" с собщением бросить в реку точно на середину, она пойдет через правый или левый рукав в зависимости от случайного действия около точки "волнореза".
Значение элементарной теории катастроф состоит в том, что она сводит огромное многообразие ситуаций, встречающихся на практике, к небольшому числу стандартных схем, которые можно детально исследовать раз и навсегда.
Сейчас теория катастроф широко применяется в механике конструкций, метеорологии, аэродинамике, оптике, теории кооперативных явлений, квантовой динамике. Но главное заключается в том, что эта теория подводит эффективную стандартную базу под описание качественных изменений в нелинейных уравнениях, моделирующих системы, далекие от равновесия. Она является основой анализа в теории бифуркаций, в теории переходов термодинамических систем в новые структурные состояния.
Дата добавления: 2016-01-05; просмотров: 28; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
