Реальные газы. Уравнение состояния реальных газов.
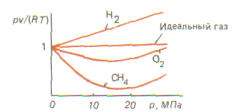
Реальные газы. Чем больше плотность газа (чем ниже температура и больше давление), тем сильнее отклоняются свойства реальных газов от свойств идеального. Примером реального газа является воздух, широко применяемый в технике в качестве рабочего тела (в компрессорах, двигателях внутреннего сгорания и т. д.). На рис. представлена зависимость отношения 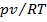 для некоторых газов от давления р при температуре T = 273,15 К. Отношение рv/(RТ) называется коэффициентом сжимаемости. Для идеального газа рv = RТ, откуда
для некоторых газов от давления р при температуре T = 273,15 К. Отношение рv/(RТ) называется коэффициентом сжимаемости. Для идеального газа рv = RТ, откуда 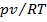 =1. Для реальных газов коэффициент сжимаемости является переменной величиной (зависит от давления, температуры).
=1. Для реальных газов коэффициент сжимаемости является переменной величиной (зависит от давления, температуры).
В реальных газах нельзя пренебречь собственным объемом молекул и силами межмолекулярного взаимодействия. Поэтому состояние реальных газов не может быть описано уравнением Клапейрона — Менделеева. Одним из уравнений, учитывающих свойства реальных газов, является уравнение Ван-дер-Ваальса  , в котором содержатся две поправки к уравнению идеального газа:
, в котором содержатся две поправки к уравнению идеального газа: 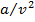 учитывает внутреннее давление, обусловленное силами взаимного притяжения молекул; b — объем молекул (несжимаемый объем). Значения а и bдля каждого газа различны.
учитывает внутреннее давление, обусловленное силами взаимного притяжения молекул; b — объем молекул (несжимаемый объем). Значения а и bдля каждого газа различны.
PV= m/ M × RT
Дата добавления: 2015-12-17; просмотров: 82; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
