Параметры термодинамической системы. Удельный объем.
Термодинамические параметры состоя ния. Состояние системы изменяется при ее взаимодействии с окружающей средой, например при теплообмене, изменении объема (сжатии, расширении), под действием внешнего давления (деформации), при воздействии электромагнитных полей и т. д. Очевидно, что в результате взаимодействия должны произойти изменения некоторых физических свойств.
Макроскопические величины, характеризующие состояние термодинамической системы, называются термодинамическимн параметрами состояния. Величины, определяемые отношением этих параметров к массе систем, называются удельными.
Основными термодинамическими параметрами состояния газообразных рабочих тел являются термодинамическая температура, абсолютное давление, удельный объем_, энтропия.
Удельный объем. Удельный объем однородной системы — величина, определяемая отношением объема системы к ее массе (обозначается v, единица удельного объема — м3/кг). Величина, обратная удельному объему, называется плотностью (обозначается р, единица плотности — кг/ма). Удельный объем и плотность зависят от температуры и давления. В практических расчетах при сравнении параметров эти величины приводятся к нормальным условиям. Под нормальными физическими условиями понимается состояние системы при р= 101 325 Па, Т = 273,15 К.
Энтpoпия.
Энтропия. Энтропия является одной из широко применяемых в термодинамике функций состояния. Как физическое понятие была введена в термодинамику немецким физиком Р. Клау-зиусом при обосновании второго закона термодинамики. Физический смысл энтропии раскрывается при анализе второго закона термодинамики методами статистической физики. Приняты обозначения: S (Дж/К) — энтропия системы; s (Дж/(кг-К) — удельная энтропия. Изменение энтропии определяется только начальным (1) и конечным (2) состояниями системы и не зависит от характера (пути) процесса, поэтому величина dS является полным дифференциалом:
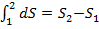 . Дифференциал энтропии при равновесном процессе – dS=dQ/T. где dQ — количество теплоты, сообщаемое системе при бесконечно малом изменении ее состояния при термодинамической температуре Т.
. Дифференциал энтропии при равновесном процессе – dS=dQ/T. где dQ — количество теплоты, сообщаемое системе при бесконечно малом изменении ее состояния при термодинамической температуре Т.
При анализе термодинамических процессов и циклов тепловых двигателей интерес представляет чаще всего изменение энтропии в этих процессах, т. е. разность значений энтропии системы в двух некоторых состояниях 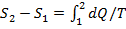 . Для изолированной системы, в которой протекают равновесные процессы, dQ=TdS = 0. И поскольку термодинамическая температура по физическому смыслу не может равняться нулю, то dS=0, S=const.
. Для изолированной системы, в которой протекают равновесные процессы, dQ=TdS = 0. И поскольку термодинамическая температура по физическому смыслу не может равняться нулю, то dS=0, S=const.
Энтропия изолированной системы не изменяется, если в ней протекают равновесные термодинамические процессы.
Понятие энтропии позволяет применять для анализа циклов тепловых двигателей диаграмму состояния Т—S.
Дата добавления: 2015-12-17; просмотров: 24; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
