Задачи для самостоятельного решения (выполнить письменно):
№1. При хранении хлороформа в результате окисления кислородом воздуха может образоваться примесь ядовитого газа фосгена, который обезвреживают добавлением небольшого количества этилового спирта:
COCl2 (г) + 2C2H5OH (ж) = C5H10O2 (ж) + 2HCl (г).Рассчитать изменение энтропии в результате реакции при стандартных условиях.
№2. Рассчитать изменение свободной энергии Гиббса в процессе усвоения в организме человека сахарозы, зная, что происходит процесс ее окисления. Сделать вывод о возможности самопроизвольного протекания реакции в стандартных условиях.
C12H22O11( K ) + 12O2( Г ) = 12CO2( Г ) + 11H2O( Ж )
№3. При отравлении угарным газом из гемоглобина (Нв) образуется карбоксигемоглобин
(Нв–СО). Определить, возможно ли самопроизвольное разрушение карбоксигемоглобина,
если D G (Нв) = - 1821,3 кДж/моль, D G (Нв-CO) = - 2901 кДж/моль.
№4. Возможно ли применение в медицине оксида азота (I) в качестве наркоза, если он
окисляется до ядовитых оксидов азота (II) и (III)? Ответ пояснить.
Занятие № 4 Тема: « Химическое равновесие. Закон действующих масс. Константа равновесия».
1. Актуальность темы:
Изучение физиологии различных организмов показывает, что регулирование многих биологических процессов основано на компенсирующем смещении того или иного равновесия в соответствии с принципом Ле-Шателье (французский физико-химик (1850-1936)). В частности, постоянство показателя кислотности внутренней среды организма при внешних воздействиях основано на смещении равновесий буферных систем. Применение принципа Ле-Шателье к биологическим объектам позволяет объяснить устойчивость организма к внешним воздействиям и прогнозировать многие изменения в организме, а также позволяет управлять большинством химических реакций, в том числе и такими, которые осуществляют в промышленных масштабах (фармацевтика) и находить условия, обеспечивающие максимальных выход продукта.
|
|
|
2. Вопросы для обсуждения :
| 1. | Необратимые процессы. |
| 2. | Условия наступления химического равновесия, его термодинамическая характеристика. |
| 3. | Динамическое химическое равновесие. |
| 4. | Значение константы химического равновесия (зависимость от природы реагентов и от температуры). Фазовые равновесия. |
| 5. | Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье. Его действие в живых организмах (сопряжённые процессы) и технологических процессах. |
| 6. | Константы химического равновесия (константа диссоциации кислот и оснований, константа растворимости (произведение растворимости), константа нестойкости для некоторых комплексных ионов в водных растворах. |
| 7. | Связь константы химического равновесия с изменением свободной энергии Гиббса реакции (ΔG0). |
Ответить на тестовые задания (выполнить письменно):
|
|
|
| 1. | Теория химического равновесия широко используется в фармацевтическом производстве. Для какого из процессов повышение температуры увеличивает выход продуктов реакции? | |
| А | эндотермического | |
| Б | экзотермического | |
| В | изохорного | |
| Г | изобарного | |
| 2. | Теория химического равновесия позволяет прогнозировать пути максимального выхода лекарственных препаратов. Какой из факторов не влияет на смещение химического равновесия? | |
| А | добавление катализатора | |
| Б | изменение температуры | |
| В | изменение давления | |
| Г | изменение концентрации | |
| 3. | «Отношение произведения молярных концентраций продуктов реакции к произведению молярных концентраций исходных веществ в момент равновесия – постоянная величина при постоянной температуре», является законом: | |
| А | Вант-Гоффа | |
| Б | действующих масс | |
| В | Ле-Шателье | |
| Г | Гиббса-Гельмгольца | |
| 4. | В каких реакциях изменение давления не приводит к смещению равновесия: | |
| А | 2NO(г) + O2(г) ↔ 2NO2(г) | |
| Б | I2(г) + H2(г) ↔ 2HI(г) | |
| В | MgCO3(т) ↔ MgO(т) + CO2(г) | |
| Г | Сl2(г) + 2NO(г) ↔ 2NOCl(г) | |
| 5. | Для указанной реакции выбрать выражение константы равновесия: 2NO(г) + O2(г) = 2NO2(г) | |
| А | 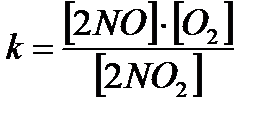
| |
| Б | 
| |
| В | 
| |
| Г | 
| |
| 6. | В технологии фармацевтических препаратов важную роль играют: давление, температура, концентрация. Понижение температуры какого из процессов ускоряет его? | |
| А | эндотермического | |
| Б | экзотермического | |
| В | изохорного | |
| Г | изобарного | |
| 7. | Теория химического равновесия позволяет прогнозировать пути максимального выхода синтезируемых веществ. Определите, для какой реакции увеличится выход продуктов при одновременном увеличении температуры и давления: | |
| А | 2NO + O2 = 2NO2 | |
| Б | 2SO3(г) = 2SO2(г) + O2 | |
| В | Н2 + I2 = 2HI | |
| Г | N2O4(г) = 2NO2 | |
| 8. | Какие кинетические условия химического равновесия? | |
| А | Uпрямой = Uобратной | |
| Б | Uпрямой > Uобратной | |
| В | Uпрямой < Uобратной | |
| Г | 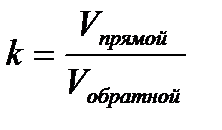
| |
| 9. | Какой из факторов не влияет на смещение химического равновесия в обратимой реакции, которая происходит в газовой фазе с увеличением числа моль продуктов реакции? | |
| А | добавление катализатора | |
| Б | изменение давления | |
| В | изменение концентрации продуктов реакции | |
| Г | изменение температуры | |
| 10. | Если равновесие смещено влево, это значит, что… | |
| А | скорость прямой реакции меньше скорости обратной реакции | |
| Б | константа скорости прямой реакции меньше константы скорости обратной реакции | |
| В | Кравн >1 | |
| Г | Кравн =1 | |
| 11. | От какого из факторов зависит константа равновесия? | |
| А | Концентрации | |
| Б | Температуры | |
| В | Катализатора | |
| Г | Природы растворителя | |
| 12. | Теория химического равновесия позволяет прогнозировать пути повышения выхода продуктов при синтезе химических соединений, и лекарственных препаратов. Для какой из перечисленных реакций повышения давления увеличит выход продуктов реакции? | |
| А | Ві2S3(т) + 9O2(г) = 2Bi2О3(т) + 6SO2(г) | |
| Б | CoO(т) + H2(г) = Co(т) + H2O(г) | |
| В | Fe(т) + CO2(г) = FeO(т) + CO(г) | |
| Г | C(т) + CO2(г) = 2CO(г) | |
| 13. | Какое утверждение справедливо: | |
| А | в состоянии химического равновесия концентрации исходных веществ и продуктов реакции со временем не изменяются | |
| Б | при равновесии масса исходных веществ всегда равна массе продуктов | |
| В | при равновесии никакие химические реакции в системе не протекают | |
| Г | в состояния всегда равны концентрации исходных веществ и продуктов. | |
| 14. | Если константа скорости одной реакции (k’), больше константы скорости второй реакции (k”), то какое соотношение между энергиями активации этих реакций: | |
| А | Е’а>Е”а | |
| Б | Е’а<Е”а | |
| В | нельзя определить | |
| Г | Е’а=Е”а | |
| 15. | Куда сместится равновесие в системе 3Fe(т) + 4H2O(г) = 4H2(г) + Fe2O3(т), Δ H = 25,1 кДж/моль при увеличении концентрации водорода? | |
| А | вправо | |
| Б | влево | |
| В | не изменится | |
| Г | реакция не будет протекать | |
|
|
|
|
|
|
4. Обучающие задачи с эталонами ответов:
№1. Димер оксида азота N2O4 в жидком состоянии используется, как один из видов топлива. В газовой фазе N2O4 превращается в диоксид азота (газ): N2O4(г) ↔ 2NO2(г)
Бесцветный Бурый
Как нужно изменить давление для увеличения выхода диоксида азота?
Решение:
Давление оказывает влияние на смещение химического равновесия в равновесных реакциях с участием газообразных веществ. При увеличении давления равновесие смещается в сторону той реакции, которая сопровождается образованием меньшего количества молей газообразного вещества, а при понижении давления – в сторону образования большего количества молей газообразного вещества.
№ 2. Какие вещества преобладают в равновесной смеси, если равновесие установилось при следующих равновесных концентрациях: 2NO(г) + Cl2(г) ↔ 2NOCl(г)
[NOCl2]=12 моль/л, [NO]=24 моль/л, [Cl2]=4 моль/л?
Решение:
Рассчитать константу химического равновесия по формуле:

В равновесной смеси преобладают продукты реакции, равновесие сдвинуто вправо.
№3. Химическое равновесие установилось в реакции4NH3(г) + 7O2(г) ↔ 4NO2(г) + 6H2O(г)
при следующих равновесных концентрациях [NH3]=1 моль/л, [NO2]=3 моль/л, [O2]=1,5 моль/л, [H2O]=0,5 моль/л.
Определить: какие вещества преобладают в равновесной смеси, и какова константа химического равновесия в данной реакции?
Решение:
Рассчитать константу химического равновесия по формуле:

В равновесной смеси преобладают исходные вещества.
№4. Константа равновесия реакции взаимодействия хлороводорода с кислородом:
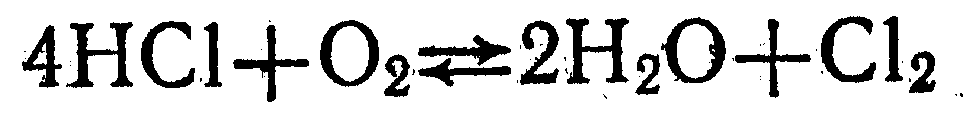 при 660 К равна 8,0×10-4. Определить стандартное изменение энергии Гиббса для этой реакции при указанной температуре.
при 660 К равна 8,0×10-4. Определить стандартное изменение энергии Гиббса для этой реакции при указанной температуре.
Решение:
Стандартное изменение энергии Гиббса находим по формуле
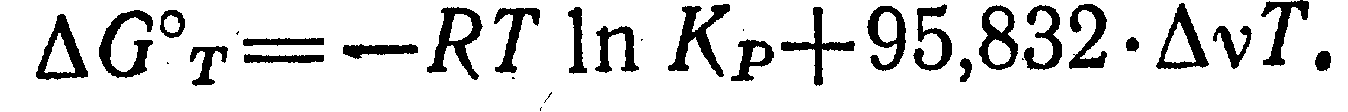
Du - изменение числа молей газообразных веществ в результате реакции.
Для данной реакции

Дата добавления: 2023-01-08; просмотров: 27; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
