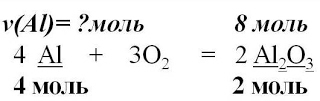Информационное обеспечение практических работ
Решение расчётных задач по химическим уравнениям
Внимательно изучите алгоритмы и запишите в тетрадь, решите самостоятельно предложенные задачи
I. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2=2Al2O3).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2=2Na2O).
Алгоритм №1
Вычисление количества вещества по известному количеству вещества, участвующего в реакции.
Пример. Вычислите количество вещества кислорода, выделившегося в результате разложения воды количеством вещества 6 моль.
II. Используя алгоритм, решите самостоятельно следующие задачи: 1. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2=SO2). 2. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2=2LiCl). Внимательно изучите алгоритм и запишите в тетрадь Алгоритм №2 Вычисление массы вещества по известному количеству другого вещества, участвующего в реакции. Пример: Вычислите массу алюминия, необходимого для получения оксида алюминия количеством вещества 8 моль.
III. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2S). 2. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + H2 = Cu + H2O). Внимательно изучите алгоритм и запишите в тетрадь Алгоритм №3 Вычисление количества вещества по известной массе другого вещества, участвующего в реакции. Пример. Вычислите количество вещества оксида меди (I), если в реакцию с кислородом вступает медь массой 19,2г.
Внимательно изучите алгоритм и запишите в тетрадь
IV. Используя алгоритм, решите самостоятельно следующие задачи: 1. Вычислите массу кислорода, необходимую для реакции с железом массой 112 г (3Fe + 4O2=Fe3O4). Алгоритм №4 Вычисление массы вещества по известной массе другого вещества, участвующего в реакции Пример. Вычислите массу кислорода, необходимую для сгорания фосфора, массой 0,31г.
|
«Решение задач по химическим уравнениям»
|
|
|
Теоретическая часть:
Величины и формулы для расчета:
n- количество вещества (моль) m- масса (г) M-молярная масса (численно равна молекулярной массе) (г/моль) V-объем (л)
Vm- молярный объем Vm=22,4 л/моль n= 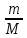 ; m= n·M
; m= n·M
n =  ; V= n·Vm
; V= n·Vm
Типовые примеры задач
Задание 1. Какое количество вещества и масса оксида фосфора (V) получится при сгорании фосфора массой 6,2 г.
Алгоритм решения
| Дано: m (P) = 6.2 г | Решение:
Решение.
1.Запишем уравнение реакции; подчеркнем что знаем, и что необходимо найти:
4P + 5O2 = 2P2О5
2.Найдемм количество известного вещества:
n (P) = 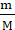 = =  = 0,2 моль
3.Запишем количества под формулами, делаем вывод о том, что количество вещества P2О5 в 2 раза меньше, чем количество вещества P и находим его количество:
4P + 5O2 = 2P2О5
0,2 моль 0,1 моль
4.Рассчитываем массу P2О5:
m (P2О5 ) =n •М = 0,1 моль • 142 г/моль = 14,2 г
5.Запишем ответ = 0,2 моль
3.Запишем количества под формулами, делаем вывод о том, что количество вещества P2О5 в 2 раза меньше, чем количество вещества P и находим его количество:
4P + 5O2 = 2P2О5
0,2 моль 0,1 моль
4.Рассчитываем массу P2О5:
m (P2О5 ) =n •М = 0,1 моль • 142 г/моль = 14,2 г
5.Запишем ответ
|
| Найти: n(P2О5 ) - ? m (P2О5 ) - ? | n (P2О5) = 0,1 моль m (P2О5) = 14,2 г |
Задание 2. Какое количество вещества и объем водорода (н. у.) выделится при взаимодействии 1,08 г алюминия с достаточным объемом соляной кислоты?
Алгоритм решения
| Дано: m (Al) = 10,8 г | Решение.
1.Запишем уравнение реакции; подчеркиваем что знаем, и что необходимо найти:
2Al + 6HCl = 2AlCl3 + 3H2
2.Найдем количество известного вещества:
n(Al) = 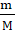 = =  =0,04 моль
3.Запишем количества под формулами, делаем вывод о том, что количество вещества H2 в 1.5 раза больше, чем количество вещества Al, и находим его количество:
2Al + 6HCl = 2AlCl3 + 3H2
0,04 моль 0,06 моль
4.Рассчитаем объем H2:
V (H2 ) = n•Vm = 0,06 моль • 22,4 л/моль = 1,344 л
5.Запишем ответ =0,04 моль
3.Запишем количества под формулами, делаем вывод о том, что количество вещества H2 в 1.5 раза больше, чем количество вещества Al, и находим его количество:
2Al + 6HCl = 2AlCl3 + 3H2
0,04 моль 0,06 моль
4.Рассчитаем объем H2:
V (H2 ) = n•Vm = 0,06 моль • 22,4 л/моль = 1,344 л
5.Запишем ответ
|
| Найти: n (H2 ) - ? V (H2 ) - ? | n (H2 ) = 0,06 моль V (H2 ) = 1,344 л |
Литература
Информационное обеспечение практических работ
1.Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник / О.С. Габриелян, И.Г. Остроумов. - М.: Академия, 2019. - 256 с.
2. Габриелян О.С. и др. Химия. Практикум: учеб. пособие для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО. - М., 2018.
2.Справочная литература: Периодическая система химических элементов им. Д.И. Менделеева (приложение 1);
www.school-collection.edu.ru (Единая коллекции цифровых образовательных ресурсов).
Дата добавления: 2022-06-11; просмотров: 11; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!