Элементарная работа, совершаемая газом
Молекулярная физика
Молекулярно-кинетической теорией называют учение о строении и свойствах вещ  ества на основе представления о существовании атомов и молекул как наименьших частиц химического вещества. В основе молекулярно-кинетической теории лежат три основных положения:
ества на основе представления о существовании атомов и молекул как наименьших частиц химического вещества. В основе молекулярно-кинетической теории лежат три основных положения:
1. вещество состоит из частиц - молекул и атомов, разделенных промежутками,
2. эти частицы хаотически движутся,
3. частицы взаимодействуют друг с другом.
Атом – наименьшая химически неделимая частица элемента (атом железа, гелия, кислорода).
Молекула – наименьшая частица вещества, сохраняющая его химические свойства. Молекула состоит из одного и более атомов (вода – Н2О – 1 атом кислорода и 2 атома водорода).
Ион – атом или молекула, у которых один или несколько электронов лишние (или электронов не хватает).
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль).
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12C. Молекула углерода состоит из одного атома. Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро: NАa= 6,022·1023 моль–1.
количество вещества определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NА, или как отношение массы к молярной массе:
|
|
|

m — масса;
μ — молярная масса вещества;
N — число молекул;
NA = 6,02·1023 моль-1 — число Авогадро
Масса одной молекулы:

ИДЕАЛЬНЫЙ ГАЗ В МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
Идеальный газ - это упрощенная модель газа, в которой:
1. молекулы газа считаются материальными точками,
2. молекулы не взаимодействуют между собой,
3. молекулы, соударяясь с преградами, испытывают упругие взаимодействия.
Основное уравнение молекулярно-кинетической теории идеального газа :
 ,
,
где 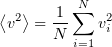 - среднее значение квадрата скорости молекул
- среднее значение квадрата скорости молекул
m — масса одной молекулы;
n = N/V — концентрация молекул;
N — число молекул;
Средняя квадратичная скорость молекул:

k = 1,38·10-23 Дж/К — постоянная Больцмана;
R = k Na= 8,31 Дж/( моль· К) — универсальная газовая постоянная;
Средняя кинетическая энергия молекулы одноатомного газа:

Давление идеального газа:

УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА (и его вывод )

Подставим это выражение в основное уравнение молекулярно-кинетической теории:

Величину R называют универсальной газовой постоянной, а уравнение, записанное в виде

называют уравнением состояния идеального газа или уравнением Менделеева-Клапейрона. Нормальные условия - давление газа равно атмосферному ( р = 101,325 кПа) при температуре таяния льда ( Т = 273,15 К ).
|
|
|
Основными процессами в термодинамике являются:
§ изохорный, протекающий при постоянном объеме;
§ изобарный, протекающий при постоянном давлении;
§ изотермический, происходящий при постоянной температуре;
§ адиабатный, при котором теплообмен с окружающей средой отсутствует;
§ политропный, удовлетворяющий уравнению 
§ Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса. 
Изохорный процесс
При изохорном процессе выполняется условие v = const
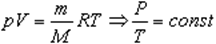

Закон Шарля
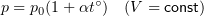
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const.
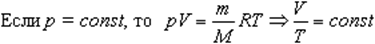

Закон Гей-Люссака
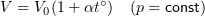
V0 — объем газа при 0 °С.
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const
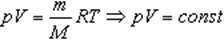

Закон Бойля-Мариотта

Давление насыщенного пара p зависит только от его химического состава и температуры и не зависит от величины свободного от жидкости объема сосуда, в кото- ром находится пар. Это объясняется тем, что при сжатии насыщенного пара концентрация молекул пара увеличивается, равновесие между процессами испарения и конденсации нарушается, и часть пара превращается в жидкость. При расширении насыщенного пара, наоборот, часть жидкости превращается в пар.
|
|
|
Давление идеального газа при постоянной концентрации молекул возрастает прямо пропорционально абсо- лютной температуре. Так как в насыщенном паре при возрастании температуры концентрация молекул увеличивается, давление насыщенного пара с повышением температуры воз- растает быстрее, чем давление идеального газа с постоянной концентрацией молекул.
Зависимость температуры кипения от давления. Температурой кипения называется температура жидкости, при которой давление ее насыщенного пара равно внешнему давлению. При понижении внешнего давления температура кипения жидкости понижается, при повышении давления – повышается. В частности, при температуре 100 °C давление насыщенного водяного пара равно нормальному атмосферному давлению и кипение воды происходит при 100 °C. Если давление над водой
|
|
|
уменьшить до половины нормального атмосферного давления, вода закипит при 80 °C.
При давлении, в 2 раза превышающем нормальное атмосферное давление, температура кипения воды равна 120 °C.
Удельная теплота парообразования. Если внешнее давление не изменяется, в процессе кипения температура жидкости остается постоянной. Теплота, которая из- вне подводится к жидкости, расходуется на парообразование. Количество теплоты r, необходимое для превращения в пар единицы массы жидкости, нагретой до темпера- туры кипения, называется удельной теплотой парообразования. Из закона сохранения энергии следует, что при обратном процессе – конденсации пара в жидкость – выделятся то же количество теплоты.
Влажность. Относительная влажность.
Содержание водяного пара в воздухе можно характеризовать
несколькими величинами. Абсолютной влажностью воздуха (или просто влажностью воздуха) называют плотность водяных паров, содержащихся в воздухе при данных
условиях. Обычно влажность выражают в г/м3. Поскольку в атмосферном воздухе ин- тенсивность испарения воды зависит от того, насколько близко давление паров воды к давлению насыщенных паров при данной температуре, важно также знать относительную влажность. Относительной влажностью воздуха f называется отношение парциального давления водяного пара p, содержащегося в воздухе при данной температуре, к давлению p насыщенного водяного пара при той же температуре, выраженное в
процентах:
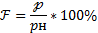
Так как давление насыщенного пара тем меньше, чем ниже температура, то при охлаждении воздуха находящийся в нем водяной пар при некоторой температуре становит- ся насыщенным. Температурапри которой находящийся в воздухе водяной пар становится насыщенным, называется точкой росы. При температуре воздуха, равной точке росы или более низкой, испарение воды прекращается.
Уравнение теплового баланса.
Если внутри теплоизолированной системы не совершается механической работы, то для нее справедливо уравнение теплового баланса:

При изменении температуры тела массой m количество переданной ему теплоты 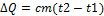 .
.
При превращении жидкости, находящейся при температуре кипения, в пар количество теплоты, переданной жидкости, 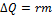
где r – удельная теплота парообразования. При конденсации пара выделяется такое же
количество теплоты.
Плавление кристаллического тела, нагретого до температуры плавления, требует передачи ему количества теплоты
 где
где  – удельная теплота плавления. При кристаллизации выделяется то же количест- во теплоты.
– удельная теплота плавления. При кристаллизации выделяется то же количест- во теплоты.
Термодинамика
Термодинамика – это наука о наиболее общих тепловых свойствах макроскопических тел. Термодинамический подход не требует каких-либо конкретных предположений о строении вещества, поэтому выводы термодинамики имеют универсальный характер. Законы термодинамики справедливы для всех тел независимо от их внутреннего строения.
Внутренняя энергия системы. Все макроскопические тела наряду с механической энергией обладают также энергией, зависящей от внутреннего состояния тел. Эту энергию называют внутренней. С точки зрения молекулярно-кинетической теории внутренняя энергия макроскопического тела равна сумме кинетических энергий хаотического движения всех молекул (или атомов) и потенциальных энергий взаимодействия молекул друг с другом (но не с молекулами других тел).
Внутренняя энергия идеального газа равна кинетической энергии хаотического движения молекул, поскольку потенциальная энергия взаимодействия молекул рав- на нулю. Наиболее просто рассчитывается внутренняя энергия одноатомных газов, состоящих из отдельных атомов, а не молекул. Одноатомными являются инертные газы – гелий, неон, аргон и др. С точки зрения механики одноатомный газ представляет собой систему частиц, которые совершают только поступательное движение. Молекулы двух- (и более) атомных газов могут совершать и другие виды движения – вращательное и колебательное, – с которыми тоже связана определенная энергия.
Поскольку средняя кинетическая энергия молекулы одноатомного газа равна  внутренняя энергия одного моля такого газа
внутренняя энергия одного моля такого газа 
Для 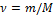 молей идеального одноатомного газа внутренняя энергия
молей идеального одноатомного газа внутренняя энергия 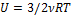
Элементарная работа, совершаемая газом
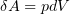

Теплоемкостью тела называется физическая величина, равная количеству теплоты ÆQ, которое необходимо сообщить телу для нагревания его на один градус: 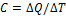
Удельной теплоемкостью c называется теплоемкость единицы массы однородного вещества : 
Молярной теплоемкостью Cm называется теплоемкость одного моля вещества: Cm=cM, где M – молярная масса вещества.
Понятие об адиабатическом процессе.
Адиабатическим процессом называется термодинамический процесс, который осуществляется в системе без теплообмена ее с внешними телами. При адиабатическом процессе  Q = 0; теплоемкость вещества в таком процессе равна нулю.
Q = 0; теплоемкость вещества в таком процессе равна нулю.
Первый закон термодинамики – это закон сохранения энергии, обобщенный на тепловые явления. Согласно этому закону, количество теплоты, полученное системой, расходуется на изменение ее внутренней энергии и на совершение системой работы против внешних сил:

Равновесный процесс – это идеализированный процесс, при проведении кото- рого в каждый момент не нарушается равновесие термодинамической системы. Он может быть представлен как непрерывная последовательность равновесных состояний. Это означает, что процесс должен быть медленным по сравнению с процессами установления термодинамического равновесия в системе. Строго говоря, только бесконечно медленные процессы являются равновесными.
Все реальные термодинамические процессы протекают с конечной скоростью и поэтому являются неравновесными. Они сопровождаются трением, диффузией и теплообменом с внешней средой при конечной разности температур системы и внешней среды. Следовательно, все реальные процессы необратимы.
Второй закон термодинамики.
Многочисленные наблюдения позволили установить, что тепловым процессам присуща определенная направленность, которая не вытекает из первого закона термодинамики. Например, в результате теплообмена между по-разному нагретыми телами всегда происходит выравнивание их температур, хотя с точки зрения первого закона термодинамики одинаково возможен как переход тепло- ты от более нагретого тела к менее нагретому, так и обратный переход. Первый закон термодинамики формально допускает создание вечного двигателя второго рода. Так называется двигатель, в котором рабочее тело, совершая круговой процесс, получает энергию в форме теплоты от одного внешнего тела и целиком передает ее в форме ра- боты другому внешнему телу.
Невозможность создания вечного двигателя второго рода является утверждением, вытекающим из обобщения многочисленных опытов. Оно называется вторым законом термодинамики и имеет несколько эквивалентных формулировок. Приведем одну из них:
Невозможен периодический процесс, единственным результатом которого является превращение всей теплоты, полученной от нагревателя, в эквивалентную ей работу.
Второй закон термодинамики указывает на необратимость процесса превращения работы в теплоту. В формулировке этого закона особое значение имеют слова «единственным результатом». Запреты, которые накладываются вторым законом термодинамики, снимаются, если процессы, о которых идет речь, не являются единственными. Например, передача тепла от менее нагретого тела более нагретому возможна, если при этом происходит как минимум еще один процесс (в холодильной установке).
КПД теплового двигателя и его максимальное значение
Тепловым двигателем называется устройство, которое превращает внутреннюю энергию топлива в механическую энергию. Энергия, которая выделяется при сгорании топлива, передается путем теплообмена рабочему телу (обычно газу). При расширении рабочего тела совершается работа против внешних сил и приводится в движение соответствующий механизм.
Коэффициентом полезного действия (КПД) произвольного цикла называется отношение работы A,
совершенной рабочим телом в прямом цикле, к количеству теплоты Q1 от нагревателя:

КПД обратимого цикла Карно не зависит от природы рабочего тела и определяется
только температурами нагревателя T1 и холодильника T2:

Закон Дальтона: 
Задачи ( продвинутый уровень )
1. Давление в автомобильной шине объемом V = 0,3 м 3 равно P =1,5×10 5 Па. Шина накачивается насосом с емкостью хода поршня DV =0,003м 3 до давления P =2×10 5 Па. Сколько ходов поршня N потребуется, если процесс накачки происходит достаточно медленно, так что система сохраняет температуру окружающей среды? Атмосферное давление принять равным P = 10 5 Па 

2. Плотность смеси водорода и азота при температуре t = 47 0 C
и давлении P=2×10 5 Па равна r=0,3кг/м 3. Найти концентрацию молекул водорода в смеси. Молярная масса водорода и азота 


3.



4. 




5. 
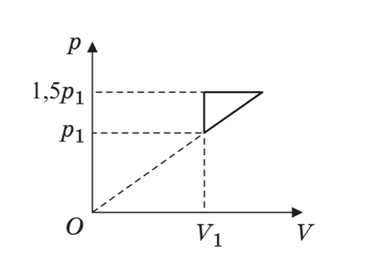

6. 

7. 

8. 

9. 

10. 
 11.
11. 

12. 

Дата добавления: 2022-01-22; просмотров: 16; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
