Экзотермические и эндотермические реакции
Классификация химических реакций по различным признакам
Химическая реакция
Классификация химических реакций по различным признакам
· По числу и составу исходных и полученных веществ химические реакции
· В зависимости от агрегатного состояния
· По признаку изменения степени окисления
· По признаку выделения теплоты. Закон Гесса
· По признаку обратимости
· По наличию или отсутствию катализатора
Химическая реакция - процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Химические реакции записывают с помощью схем или уравнений, которые содержат формулы исходных веществ и продуктов реакций. Уравнения реакций отличаются от схем наличием коэффициентов, с помощью которых уравнивают число атомов каждого элемента в исходных веществах (левая часть уравнения) и продуктах (правая часть уравнения). Коэффициенты позволяют отразить закон сохранения массы.
Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ; выделению или поглощению энергии; изменению степени окисления химических элементов.
I . По числу и составу исходных и полученных веществ химические реакции бывают:
1. Соединения — из двух или нескольких веществ образуется одно сложное вещество:
Fe + S = FeS
(при нагревании порошков железа и серы образуется сульфид железа)
2. Разложения — из одного сложного вещества образуется два или несколько веществ:
2H2O = 2H2 + O2
(вода разлагается на водород и кислород при пропускании электрического тока)
|
|
|
3. Замещения — атомы простого вещества замещают один из элементов в сложном веществе:
Fe + CuCl2 = Cu↓ + FeCl2
(железо вытесняет медь из раствора хлорида меди (II))
4. Обмена — 2 сложных вещества обмениваются составными частями:
HCl + NaOH = NaCl + H2O
(реакция нейтрализации — соляная кислота реагирует с гидроксидом натрия с образованием хлорида натрия и воды)
II . В зависимости от агрегатного состояния, в котором находятся реагирующие вещества (жидкое, твёрдое, газообразное), различают гомогенные и гетерогенные реакции. Агрегатное состояние вещества обычно обозначается буквами русского алфавита нижним индексом в скобках: (г) — газ, (ж) — жидкость, (т) —твёрдое.
Гомогенные реакции - реакции, протекающие в одной фазе.
Например, гомогенными являются реакции между двумя растворами или между двумя газами.
Гетерогенные реакции - реакции, протекающие на границе раздела фаз
Граница раздела фаз присутствует в системе, образованной, например, жидкостью и твёрдым телом (металл и кислота), твёрдым телом и газом, двумя несмешивающимися жидкостями (масло и вода).
|
|
|
III . По признаку изменения степени окисления реакции делятся на реакции, протекающие без изменения степени окисления и реакции, протекающие с изменением степени окисления, или окислительно-восстановительные.
Так, реакция разложения гидроксида меди (II) на оксид меди (II) и воду протекает без изменения степени окисления, а реакция взаимодействия нитрата серебра (I) с медью является окислительно-восстановительной, т.к. медь изменяет степень окисления с 0 до +2, а серебро понижает свою степень окисления с +1 до 0.
Напомним, что степень окисления в веществах, состоящих из двух элементов, численно равна валентности, знак ставится перед цифрой.
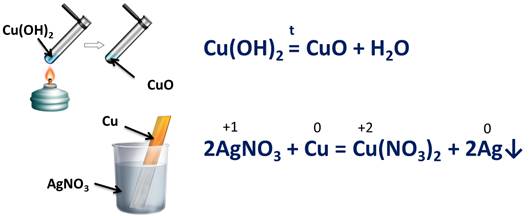
Окислитель - элемент, принимающий электроны.
Восстановитель - элемент, отдающий электроны.
Окисление всегда сопровождается восстановлением и наоборот.
IV . По признаку выделения теплоты реакции делятся на экзотермические и эндотермические.
Если реакции протекают с выделением теплоты, то такие реакции называются экзотермическими (в переводе с греческого экзо обозначает «наружу»), если реакции протекает с поглощением теплоты, то их называют эндотермическими (эндо означат «внутрь»).
Экзотермические и эндотермические реакции
|
|
|
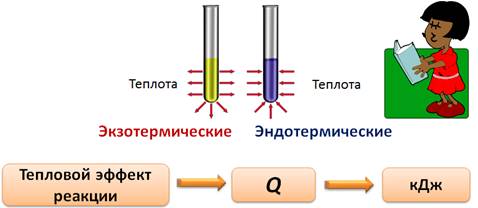
Количество теплоты, которое выделяется или поглощается в результате реакции, называют тепловым эффектом реакции. Тепловой эффект реакции обозначают латинской буквой Q(«ку») и выражают в килоджоулях (кДж). Для экзотермических реакций Q > 0, для эндотермических реакций, наоборот, Q < 0. К экзотермическим реакциям относятся реакции горения серы, магния, фосфора, а реакция разложения ртути является эндотермической.

S + O2 = SO2 + Q
4P + 5O2 = 2P2O5 + Q
2Mg + O2 = 2MgO + Q
2HgO = 2Hg + O2 – Q
Основу химической термодинамики составляет приложение первого и второго законов термодинамики к химическим процессам.
Применение первого закона термодинамики к химическим процессам позволяет решать задачи по определению тепловых эффектов реакций и их зависимости от параметров, при которых реакции протекают.
Изучение химических равновесий на основе второго закона термодинамики позволяет выявить условия, при которых может протекать требуемый химический процесс, и пределы, до которых он может быть доведен, т.е. равновесный состав продуктов реакции.
Закон Гесса открыт русским химиком Г. И. Гессом в 1840 г.
Закон Гесса - математическое следствие первого начала термодинамики, может быть сформулирован так: тепловой эффект реакции, состоящей из нескольких промежуточных стадий, не зависит от этих промежуточных стадий или их последовательности, а полностью определяется начальным и конечным состояниями системы.
|
|
|
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком - либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы).
Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы.
Закон Гесса может быть выражен также следующим образом:
- если система посредством ряда химических превращений совершает круговой процесс при неизменных температуре и объеме или неизменных температуре и давлении, то алгебраическая сумма тепловых эффектов реакций должна быть равна нулю.
Уравнение первого закона термодинамики для процесса, сопровождающегося химическими превращениями, имеет следующий вид: dQ = dU + pdV + dL ,
где pdV – дифференциал работы расширения; dL – дифференциал других возможных видов работы, совершающейся в процессе химической реакции (например, электрической работы, магнитной работы). Как известно, выбор знаков для теплоты и работы является условным.
С помощью закона Гесса можно решать многие практически важные задачи, в частности определять значения тепловых эффектов реакций, трудно измеряемых экспериментально, на основе известных тепловых эффектов некоторых других реакций.
Дата добавления: 2021-12-10; просмотров: 61; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
