Эквивалент. Количество вещества эквивалентов
Из закона постоянства состава следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях. Поэтому в химии введено понятие эквивалента (слово «эквивалентный» в переводе означает «равноценный»).
Эквивалентом называют условные частицы вещества в целое число раз меньшие, чем соответствующие им формульные единицы.
В формульной единице вещества может содержаться 1, 2, 3, ..., в общем случае zB, эквивалентов вещества. Число zB называют эквивалентным числом или числом эквивалентности. Эквивалентное число зависит от природы реагирующих веществ, типа и степени осуществления химической реакции. Поэтому различают эквивалентные числа элемента в составе соединения, отдельных групп, ионов и молекул. В обменных реакциях эквивалентное число вещества определяют по стехиометрии реакции.
В окислительно-восстановительных реакциях значения эквивалентного числа окислителя и восстановителя определяют по числу электронов, которые принимает 1 формульная единица окислителя или принимает 1 формульная единица восстановителя.
Если известно количество вещества, то количество вещества эквивалентов всегда в число эквивалентности раз больше (или равно) количества вещества:

В практических расчетах наиболее часто пользуются молярной массой эквивалентов.
Молярной массой эквивалентов вещества В называется отношение массы вещества В к его количеству вещества эквивалентов:

Многие элементы образуют несколько соединений друг с другом. Из этого следует, что эквивалент элемента и его молярная масса эквивалентов могут иметь различные значения, смотря по тому, из состава какого соединения они были вычислены. Но во всех таких случаях различные эквиваленты (или молярные массы эквивалентов) одного и того же элемента относятся друг к другу, как небольшие целые числа. Например, молярные массы эквивалентов углерода, вычисленные исходя из состава диоксида и оксида углерода, равны соответственно 3 г/моль и б г/моль; отношение этих величин равно 1 : 2. В подавляющем большинстве соединений молярная масса эквивалентов водорода равна 1, а кислорода - 8 г/моль.
Наряду с понятием молярной массы эквивалентов вещества иногда удобно пользоваться понятием объема эквивалентов газообразного вещества В. Данный объем рассчитывается как молярный объем данного газа, деленный на число эквивалентности вещества:

Понятие об эквивалентах, молярных массах эквивалентов и объемах эквивалентов газообразного вещества распространяется также на сложные вещества. Эквивалентом сложного вещества является такое его количество, которое взаимодействует без остатка с одним эквивалентом любого другого вещества. Такой расчет возможен благодаря закону эквивалентов.
Определение молекулярных масс соединений
Молекулярные массы газообразных или легколетучих веществ можно определить с помощью закона Авогадро (напоминаем его формулировку: равные объемы газов при одинаковой температуре и одинаковом давлении содержат равное число молекул), из которого следует, что массы равных объемов двух газов относятся друг к другу, как их молекулярные или численно равные им молярные массы:

Отношение т, : т2 называется относительной плотностью первого газа по второму и обозначается символом О:

Из него следует: 
т.е. молекулярная масса газа равна его плотности но отношению к второму газу, умноженной на молекулярную массу второго газа.
Плотность газов обычно определяют по отношению к водороду или воздуху. Молекулярная масса водорода равна 2, а средняя молекулярная масса воздуха 29, поэтому уравнения для расчета молекулярной массы имеют вид: 

Пример 1.27. Плотность некоторого газа по воздуху равна 1,517. Определите молекулярную массу газа.
Решение.
Молярную массу газообразного вещества (а следовательно, и его относительную молекулярную массу) можно определить по молярному объему.
Пример 1.28. Определите молярную и молекулярную массу некоторого газа, если при н.у. 0,18 г этого газа занимают объем 0,126 л.
Решение. 1. При н.у. один моль любого газа занимает объем 22,4 л. Следовательно, вычислив массу 22,4 л данного газа, мы узнаем его молярную и молекулярную массу. Рассуждаем так:

2. Составляем и решаем пропорцию:
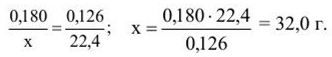
Следовательно, молярная масса неизвестного газа равна 32,0 г/моль, а молекулярная масса 32 (а.е.м.).
Молярную и молекулярную массу газа или легколетучего соединения можно вычислить по уравнению Клайперона - Менделеева, если свойства этого газа не очень сильно отличаются от свойств идеального газа.
Пример 1.29. Вычислите молярную массу ацетона, если масса 0,5 л его паров при 87 ПС и давлении 96 кПа равна 0,93 г.
Решение. Из уравнения Клайперона - Менделеева выражаем и вычисляем М, подставляя массу паров в граммах (0,93 г), давление в паскалях (96000 Па), объем в м’ (0,5-10"3 м3) и температуру в абсолютных градусах (360 К):

Для твердых и жидких веществ - неэлектролитов, растворяющихся без диссоциации молекул на ионы, молекулярная масса определяется по свойствам их растворов: по понижению температуры замерзания раствора (криоскопический метод), по повышению температуры кипения (эбуллиоскопический метод), но понижению давления пара над раствором (тоноскопический метод) и но осмотическому давлению (осмотический метод). Эти методы рассматриваются при изучении растворов в университетском курсе химии.
Примеры решения задач
ПРИМЕР 1
| Задание | Вычислите, какой объём кислорода (н.у.) выделится при разложении 237 г перманганата калия? |
| Решение | Запишем уравнение разложения перманганата калия: 2KMnO4 = K2MnO4 + MnO2 + O2. Вычислим количество вещества перманганата калия по формуле: n = m / M; n(KMnO4)= m (KMnO4)/ M(KMnO4). Для этого необходимо указать молярную массу перманганата калия(значение относительной атомной массы, взятое из Периодической таблицы Д.И. Менделеева, округлим до целого числа). Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(KMnO4) = Ar(K) + Ar(Mn) + 4×Ar(O) = 39 + 55 + 4×16 = 94 + 64 = 158 г/моль. Тогда, количество вещества перманганата калия будет равно: n(KMnO4)= 237/ 158 = 1,5 моль. Согласно уравнению реакции n(O2) :n(KMnO4) = 1 : 2, значит: n(O2) = 1/2 × n(KMnO4) = ½ × 1,5 = 0,75 моль. Найдем молярную массу молекулярного кислорода (допущение, указанное при расчете молярной массы кислорода действительно и в данном случае): M(O2) = 2×Ar(O) = 2×16 = 32 г/моль. Определим объем выделившегося кислорода: V = n × Vm; V (O2) = n (O2) × Vm; V (O2) = 0,75× 22,4 = 16,8л. |
| Ответ | Объем кислорода равен 16,8 л. |
| Задание | Вычислите, какая масса оксида серебра (I) разложилась, если в ходе реакции образовалось металлическое серебро и выделился кислород объемом 5,6 л кислорода (н.у.)? |
| Решение | Запишем уравнение реакции разложения оксида серебра (I): 2Ag2O = 4Ag + O2. Вычислим количество вещества кислорода по формуле: n = V / Vm; n (O2) = V (O2) / Vm; n (O2) = 5,6 / 22,4 = 0,25 моль. Согласно уравнению реакции n(O2) :n(Ag2O) = 1 : 2, значит: n(Ag2O) = 2 × n(O2) = 2 × 0,25 = 0,5 моль. Найдем молярную массу оксида серебра (I)(значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(Ag2O) = 2×Ar(Ag) + Ar(O) = 2×108 + 16 = 216 + 16 = 232 г/моль. Определим массу оксида серебра (I): m = n × M; m(Ag2O) = n (Ag2O) × M (Ag2O); m(Ag2O) = 0,5 × 232 = 116 г. |
| Ответ | Масса оксида серебра (I) равна 116 г |
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что такое молярная масса вещества и в каких единицах она измеряется?
2. Какой газ называется идеальным?
3. Запишите и объясните уравнение Клапейрона-Менделеева. В каких случаях его можно использовать для практических вычислений
4. Что такое плотность газа и как ее можно определить экспериментально?
5. В чем заключается метод откачки для определения молярной массы газа?
6. Поясните физический смысл числа Авогадро.
7. Что такое термодинамические параметры?
8. Почему молярную массу газа нельзя определить непосредственно, используя уравнение Клапейрона-Менделеева?
9. Как теоретически рассчитать молярную массу смеси газов?
10. Назовите основные источники погрешностей данного метода измерения.
11. При каких условиях реальные газы можно считать идеальными? Почему?
12. Что такое внутренние и внешние термодинамические параметры?
13. Выведите расчетную формулу для определения молярной массы, которая используется в данной работе.
14. Сухой воздух содержит 23 % кислорода и 77 % азота (если пренебречь остальными составными частями воздуха). Определите молярную массу воздуха.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Лабораторный практикум по физике / под ред. А. С. Ахматова. М.: Высшая школа, 1980. 257 с.
2. Савельев И. В. Курс физики: в 3 т. / И. В. Савельев. СПб.: Мифрил: Глав. ред. физ.-мат. лит., 1996. Т. 1. 304 с. 3. Трофимова Т. И. Курс физики / Т. И. Трофимова. М.: Высш. шк., I999. 542 с.
Дата добавления: 2021-12-10; просмотров: 29; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
