Примеры решения типовых задач
Пояснительная записка
Дисциплина Химия предназначена для подготовки конкурентоспособного специалиста на рынке труда, обладающего знаниями, позволяющими использовать свойства органических веществ для оптимизации технологического процесса, закономерно определять и применять методы химического анализа для осуществления контроля качества сырья. Входные знания, умения и компетенции, необходимые для изучения данного курса, формируются в процессе изучения цикла.
При изучении данной дисциплины студенты должны овладеть теоретическими знаниями и практическими умениями в соответствии с государственными требованиями к минимуму содержания и уровню подготовки выпускников по специальности 43.02.15 «Поварское и кондитерское дело».
В результате изучения предмета студенты должны знать: законы термодинамики, термохимии, химическую кинетику и катализ, свойства растворов, поверхностные явления; важнейшие химические вещества, их коллоидное состояние и изменение при кулинарной обработке;
уметь: применять физико-химические методы анализа при контроле качества продукции, выявлять связь между физическими и химическими процессами, между строением и свойствами органических веществ, входящих в состав продуктов питания.
Для реализации программы применяются наглядные пособия: таблицы, плакаты проводятся лабораторные и практические работы. Содержание программ доводится в виде лекций с проблемным изложением. На реализацию программ отводится 120 часов. Из них на самостоятельную работу 106 часов, 14 часов на аудиторную.
|
|
|
Контрольная работа выполняется по содержанию всех тем программы. Теоретический материал студенты изучают самостоятельно, а также в период лабораторно-экзаменационной сессии на обзорных и установочных занятиях под руководством преподавателя.
Программа и методические указания для выполнения контрольной работы по учебной дисциплине ЕН.02 Химия разработаны в соответствии с требованиями Федерального государственного образовательного стандарта по специальности 43.02.15 Поварское и кондитерское дело
Целью изучения дисциплины является:
1.Формирование теоретических знаний и практических умений на основе законов химии
2.Освоение методов и принципов химического анализа.
3.Применение результатов экспериментальных данных техники безопасности.
В результате изучения дисциплины студент должен
Уметь:
-применять основные законы химии для решения задач в области
-профессиональной деятельности;
-использовать свойства органических веществ, дисперсных и
-коллоидных систем для оптимизации технологического процесса;
|
|
|
-описывать уравнениями химических реакций процессы, лежащие
-в основе производства продовольственных продуктов;
-проводить расчеты по химическим формулам и уравнениям
реакции;
-использовать лабораторную посуду и оборудование;
-выбирать метод и ход химического анализа, подбирать реактивы
и аппаратуру;
-проводить качественные реакции на неорганические вещества и
ионы, отдельные классы органических соединений;
-выполнять количественные расчеты состава вещества по результатам измерений;
-соблюдать правила техники безопасности при работе в химической лаборатории.
Знать:
-основные понятия и законы химии;
-теоретические основы органической, физической, коллоидной химии;
-понятие химической кинетики и катализа;
-классификацию химических реакций и закономерности их протекания;
-обратимые и необратимые химические реакции, химическое
равновесие, смещение химического равновесия под действием различных
факторов;
-окислительно-восстановительные реакции, реакции ионного обмена;
-гидролиз солей, диссоциацию электролитов в водных растворах,
-понятие о сильных и слабых электролитах; тепловой эффект химических реакций, термохимические уравнения;
|
|
|
-характеристики различных классов органических веществ, входящих в состав сырья и готовой пищевой продукции; свойства растворов и коллоидных систем высокомолекулярных соединений;
-дисперсные и коллоидные системы пищевых продуктов; роль и характеристики поверхностных явлений в природных и технологических процессах;
-основы аналитической химии;
-основные методы классического количественного и физико- химического анализа;
-назначение и правила использования лабораторного оборудования и аппаратуры;
-методы и технику выполнения химических анализов;
-приемы безопасной работы в химической лаборатории.
Учебная дисциплина ЕН.02 Химия является составной частью математического и общего естественнонаучного цикла основной профессиональной образовательной программы по специальности 43.02.15 Поварское и кондитерское дело, устанавливающей базовое знание для освоения дисциплины.
Основная форма изучения предмета – самостоятельная работа студентов над рекомендуемой литературой в соответствии с методическими указаниями.
В процессе изучения дисциплины студенты-заочники должны выполнить одну домашнюю контрольную работу по заданному варианту. Оформленная и подписанная студентом контрольная работа предоставляется в образовательное учреждение не позднее срока, указанного в учебном графике. Рецензируется преподавателем.
|
|
|
Содержание дисциплины
Физическая химия
Агрегатные состояния вещества
Агрегатное состояние – состояние вещества, характеризующееся определёнными качественными свойствами: способностью или неспособностью сохранять объём и форму, наличиемили отсутствием дальнего и ближнего порядка и другими. Изменение агрегатного состояния сопровождается скачкообразнымизменением свободной энергии, энтропии, плотности и другихосновных физических свойств. Агрегатное состояние – результатфазового перехода.
В современной физике выделяют следующие агрегатные состояния: твёрдое тело, жидкость, газ, плазма.
Газы. Большинство газов – ковалентные соединения илипростые вещества. Наиболее характерным свойством газов является их сжимаемость и пособность расширяться. Газы не имеютсобственной формы и собственного объема, они расширяются дотех пор, пока не заполнят равномерно весь сосуд, куда их поместили. Газы способны смешиваться друг с другом в любых отношениях. Газы – беспорядочно движущиеся в пространстве и слабо взаимодействующие молекулы.
Жидкости. В жидком состоянии могут находиться металлические, ионные и ковалентные соединения (пример: ртуть, разбавленная соляная кислота, бензол). Подобно газам жидкости не имеют определенной формы. Сжимаемость жидкостей очень мала.Жидкое состояние характеризуется большой энергией взаимодействия молекул и значительно меньшим свободным пробегом.
Твердые вещества. В твердом состоянии, как и в жидкоммогут находиться металлические, ионные или ковалентные соединения. Они образованы частицами, которыми совершают колебательные движения около положений равновесия в узлах кристаллической решетки. Твердые тела отличаются от жидкостей игазов наличием собственной формы и определенного объема.
Плазма – полностью или частично ионизированный газ.Плазма состоит из положительных ионов и несвязанных электронов. Она существует, например, в верхних слоях атмосферы Земли. Свыше 99% вещества во всей Вселенной существует в видеплазмы.
Понятие агрегатного состояния достаточно условно: существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью; высокоэластичные состояниянекоторых полимеров, представляющие нечто среднее междустеклообразным и жидким состоянием, жидкие кристаллы и другие. Также существуют плавные переходы между некоторыми агрегатными состояниям. С другой стороны, стоит отметить наличие нескольких различных состояний твёрдых тел, напримерграфит, алмаз и уголь, относящиеся к одному агрегатному состоянию. Для описания различных состояний в физике чаще используется более широкое понятие фазы.
Газовые законы – это математические соотношения между температурой, давлением и объемом газов
Температура (Т). В научных исследованиях используютсядве шкалы измерения температур. Абсолютная шкала температур, которую предложил У. Кельвин в 1848 г., использует в качестве единицы измерения кельвин (К). В любой абсолютной шкалеизмерения существуют только положительные значения, а нуль втакой шкале означает полное отсутствие измеряемой величины.В абсолютной шкале температур точка 0 К называется абсолютным нулем. Температурная шкала Цельсия не является абсолютной шкалой, т. к. в ней допустимы отрицательные значения температуры. В международной системе единиц СИ единицей температуры является кельвин. Эта единица используется во всехвычислениях с участием температуры. Перевод температуры изшкалы Цельсия в абсолютную шкалу требует добавления к первой численной величине 273,15.
Давление (p). В системе СИ единицей давления являетсяпаскаль (Па), который определяется как давление, создаваемое силой в один ньютон, действующей перпендикулярно к поверхности площадью в 1 м2:
1Па = 1н/м2,
1атм = 101325Па.
В качестве единицы измерения давления часто используютсяатмосфера (атм), миллиметры ртутного столба (мм рт. ст., или ммHg).
Давление, равное 1 атм, создает земная атмосфера на уровнеморя при температуре 0º С, поддерживая столбик ртути высотой760 мм.При измерении низких давлений часто пользуются единицей,которая называется «торр» (по имени итальянского математика ифизика Э. Торричелли). В 1643 г. Торричелли установил, что атмосферное давление определяет высоту, до которой жидкостьподнимается в трубке, перевернутой над тарелкой с той же жидкостью. Это привело к созданию барометра.
Объем (V). В системе СИ единицей объема является кубический метр.
Стандартные (нормальные) температура и давление_ Известно, что объем газа зависит от его температуры и давления. Поэтому, сравнивая объемы газов, необходимо уравнивать их температуру и давление. Принято указывать объем газа и другие физические свойства при определенных условиях – стандартных температуре и давлении.
Стандартной температурой считается 273 К (0ºС), а стандартным давлением до 1984 г. считалось значение 101325 Па(т. е. 1 атм, или 760 мм рт. ст.). Однако в настоящее время принято считать стандартным давлением 100 кПа.
Термодинамики и термохимия
Энергетическая сторона реакций изучается в разделах химии, называемых термохимией и химической термодинамикой.
Термодинамика на основе энергетических критериев – термодинамических потенциалов дает ответ на вопрос: осуществим ли принципиально тот или иной химический процесс в данных условиях или нет. Изменение термодинамических потенциалов, характеризующее данный процесс, является его движущей силой. Наиболее часто в качестве движущей силы используется изменение энергии Гиббса, или изобарно-изотермического потенциала  , характеризующего переход процесса из начального в конечное состояние (реагентов, или исходных веществ, в продукты реакции) при постоянстве температуры и давления в системе:
, характеризующего переход процесса из начального в конечное состояние (реагентов, или исходных веществ, в продукты реакции) при постоянстве температуры и давления в системе:
 (1)
(1)
Если  , то процесс принципиально осуществим, если
, то процесс принципиально осуществим, если 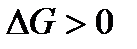 , то процесс невозможен. Чем меньше
, то процесс невозможен. Чем меньше  , тем сильнее стремление к протеканию процесса и тем дальше он от состояния равновесия, при котором
, тем сильнее стремление к протеканию процесса и тем дальше он от состояния равновесия, при котором 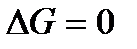 .
.
Изменение энергии Гиббса является результатом вклада двух факторов: энтропийного и энтальпийного.
Энтропийный фактор, характеризующий изменение энтропии системы при переходе из начального в конечное состояние
 (2)
(2)
отражает стремление системы перейти от более упорядоченного состояния к менее упорядоченному, т.е., от менее вероятного к более вероятному. Значение энтропии тем выше и тем вероятнее характеризуемое ею состояние, чем большим числом микросостояний может быть представлена система. Для неупорядоченной хаотичной системы таких микросостояний огромное множество, поскольку неупорядоченность предполагает огромное количество комбинаций взаимного расположения частиц. Поэтому такая система более вероятна и характеризуется большим положительным значением энтропии. Если же система упорядочена, высокоструктурирована, то находящиеся во взаимном расположении частицы обычно жестко связаны между собой силами химического или межмолекулярного взаимодействия, не имеют достаточно степеней свободы для движения друг относительно друга с образованием новых комбинаций взаимного расположения. Поэтому число микросостояний такой системы невелико, и последняя характеризуется низким значением энтропии. Исходя из изложенного, самопроизвольность процесса определяет положительное значение изменения энтропии:  и
и  .
.
Энтальпийный фактор, характеризующий тенденцию перехода системы из более высокого энергетического состояния к менее высокому, выражается изменением энтальпии системы при переходе из одного состояния к другому:
 (3)
(3)
Суммарный вклад обоих факторов отражается в выражении изменения изобарно-изотермического потенциала:
 (4)
(4)
Поскольку самопроизвольность процесса определяется неравенством  , можно видеть, что этому способствуют положительное изменение энтропии процесса
, можно видеть, что этому способствуют положительное изменение энтропии процесса  (переход системы из более упорядоченного к менее упорядоченному состоянию) и отрицательное изменение энтальпии процесса
(переход системы из более упорядоченного к менее упорядоченному состоянию) и отрицательное изменение энтальпии процесса 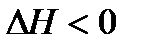 (переход системы из более высокого энергетического состояния к менее высокому).
(переход системы из более высокого энергетического состояния к менее высокому).
В общем случае значение 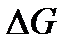 определяется совместным вкладом обоих факторов. В этом плане можно выделить 4 случая.
определяется совместным вкладом обоих факторов. В этом плане можно выделить 4 случая.
1)  ,
,  . В этом случае процесс осуществим при любой температуре.
. В этом случае процесс осуществим при любой температуре.
2)  ,
, 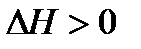 . В этом случае процесс термодинамически запрещен (
. В этом случае процесс термодинамически запрещен (  ) во всем диапазоне условий (самопроизвольно будет протекать обратный процесс).
) во всем диапазоне условий (самопроизвольно будет протекать обратный процесс).
3)  ,
, 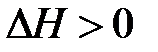 . В этом случае самопроизвольность процесса определяется балансом двух факторов. Самопроизвольному процессу соответствует условие
. В этом случае самопроизвольность процесса определяется балансом двух факторов. Самопроизвольному процессу соответствует условие  , которому отвечает диапазон температур
, которому отвечает диапазон температур  . Можно видеть, что такая ситуация реализуется в области высоких температур, нижний предел которых определяется значением
. Можно видеть, что такая ситуация реализуется в области высоких температур, нижний предел которых определяется значением 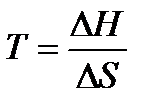 .
.
4)  ,
,  . Как и в предыдущем случае, самопроизвольность процесса определяется балансом энтропийного и энтальпийного факторов. В частности, в соответствии с требованием
. Как и в предыдущем случае, самопроизвольность процесса определяется балансом энтропийного и энтальпийного факторов. В частности, в соответствии с требованием 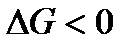 самопроизвольный характер процесса определяется неравенством
самопроизвольный характер процесса определяется неравенством 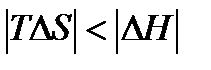 , которому отвечает диапазон температур
, которому отвечает диапазон температур  . Такая ситуация реализуется в области низких температур, верхний предел которых определяется значением
. Такая ситуация реализуется в области низких температур, верхний предел которых определяется значением  .
.
Из положений (1), (2), (3)) следует, что значения  ,
,  и
и  определяются конечным и начальным состоянием системы. Это открывает возможность их определения на основе данных, характеризующих начальное и конечное состояния систем. Для химической реакции
определяются конечным и начальным состоянием системы. Это открывает возможность их определения на основе данных, характеризующих начальное и конечное состояния систем. Для химической реакции
 (5)
(5)
изменение энтропии в стандартных условиях (298К, 101,3кПа) определяется равенством:
 (6)
(6)
где 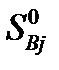 и
и 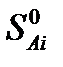 – энтропии j-го и i-го реагента соответственно в стандартных условиях.
– энтропии j-го и i-го реагента соответственно в стандартных условиях.
Значения энтропий различных простых и сложных веществ табулированы в соответствующих справочниках.
Энтальпия процесса (изменение Н) для реакции (5) определяется выражением:
(7)
где 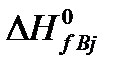 и
и  – теплоты образования j-го продукта и i-го реагента из простых веществ в стандартных условиях.
– теплоты образования j-го продукта и i-го реагента из простых веществ в стандартных условиях.
Изменение изобарно-изотермического потенциала для реакции (5) определяется выражением:
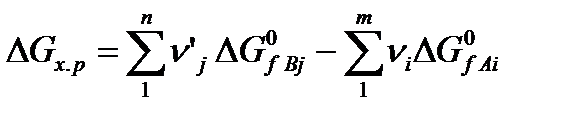 (8)
(8)
где 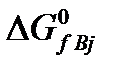 и
и  – изменения изобарно-изотермических потенциалов при образовании продуктов реакции и реагентов из простых веществ в стандартных условиях.
– изменения изобарно-изотермических потенциалов при образовании продуктов реакции и реагентов из простых веществ в стандартных условиях.
Очевидно, что движущая сила процесса (  ) может быть рассчитана по формуле (8), если есть прямые данные по
) может быть рассчитана по формуле (8), если есть прямые данные по  . Если же такие данные отсутствуют, то сначала рассчитываются
. Если же такие данные отсутствуют, то сначала рассчитываются  и
и 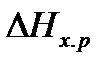 , а затем по уравнению (4) определяют
, а затем по уравнению (4) определяют  .
.
Значения  и
и  различных сложных веществ приведены в соответствующих справочниках.
различных сложных веществ приведены в соответствующих справочниках.  и
и 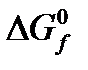 простых веществ равны нулю.
простых веществ равны нулю.
Раздел термодинамики, изучающий тепловые эффекты химических реакций и способы их расчета, называется термохимией.
Теплота химической реакции влияет на энергетическое состояние системы и может иметь важное значение при выборе условий протекания той или иной реакции. Как будет показано ниже, при постоянстве температуры и давления теплота реакции равна энтальпии процесса  и, таким образом, отражает вклад энергетического фактора в изменение изобарно-изотермического потенциала.
и, таким образом, отражает вклад энергетического фактора в изменение изобарно-изотермического потенциала.
В соответствии с законом сохранения энергии (первый закон термодинамики) теплота, полученная системой, идет на изменение ее внутренней энергии  и на совершение работы А:
и на совершение работы А:
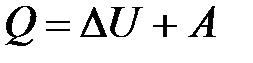 (9)
(9)
Как G и H, внутренняя энергия является функцией состояния системы, и поэтому ее изменение определяется конечным и начальным состоянием:
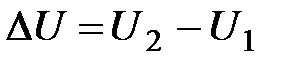 (10)
(10)
Теплота и работа не являются функциями состояния, так как они являются формами передачи энергии и связаны с процессом, а не с состоянием системы.
В химических реакциях А – работа против внешнего давления, т.е. в первом приближении 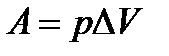 , где
, где 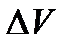 – изменение объема системы
– изменение объема системы  .
.
Так как большинство химических реакций протекает при постоянном давлении, то для изобарно-изотермического процесса (  ,
,  ), теплота реакции будет равна
), теплота реакции будет равна

или

и  (11)
(11)
Сумма  называется энтальпией процесса (Н). Из выражения (11) следует, что теплота процесса в условиях постоянства температуры и давления приобретает свойства функции состояния, т.е. не зависит от пути, по которому протекает процесс, и равна изменению энтальпии системы
называется энтальпией процесса (Н). Из выражения (11) следует, что теплота процесса в условиях постоянства температуры и давления приобретает свойства функции состояния, т.е. не зависит от пути, по которому протекает процесс, и равна изменению энтальпии системы 
Таким образом, энтальпия является функцией состояния, поскольку ее изменение определяется только начальным и конечным состоянием системы. Нетрудно видеть, что теплота реакции в изохорно-изотермическом процессе (V = const,  ), при котором
), при котором  , равна изменению внутренней энергии системы:
, равна изменению внутренней энергии системы:
 (12)
(12)
Теплоты химических процессов, протекающих при 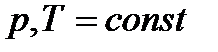 и
и  , называются тепловыми эффектами.
, называются тепловыми эффектами.
Расчеты тепловых эффектов основаны на следствии из закона Гесса: тепловой эффект химической реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ с учетом стехиометрических коэффициентов перед формулами этих веществ в уравнении реакции.
Количественно расчет тепловых эффектов химических реакций представляется формулой (7). Особенностями расчетов по этому уравнению являются:
– в уравнении (7) значение  соответствует тому агрегатному состоянию, в котором реагент или продукт реакции входит в стехиометрическое уравнение (5);
соответствует тому агрегатному состоянию, в котором реагент или продукт реакции входит в стехиометрическое уравнение (5);
– коэффициенты уравнения (7) могут быть дробными, если требуется определить тепловой эффект на моль одного из продуктов реакции или реагентов.
В соответствии с законом Гесса тепловой эффект сложного процесса равен сумме тепловых эффектов его стадий. Так, образование оксида углерода (IV) из графита и кислорода можно рассматривать как результат непосредственного взаимодействия простых веществ
 ,
,  (13)
(13)
или как результат процесса, протекающего через промежуточную стадию образования и сгорания оксида углерода (II)
 ,
, 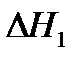 (14)
(14)
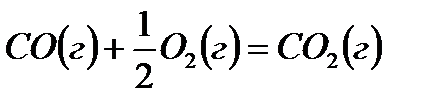 ,
,  (15)
(15)
Суммируя уравнения (14) и (15), имеем
 ,
,  (16)
(16)
Сопоставляя уравнение (13) и (16), имеем  .
.
Примеры решения типовых задач
Пример 1. Вычисление тепловых эффектов химических реакций по значениям теплот образования реагентов и продуктов реакции.
Задача. Рассчитайте тепловой эффект реакции  , если значения теплот образования реагентов и продуктов составляют:
, если значения теплот образования реагентов и продуктов составляют:



Решение. В соответствии со следствием из закона Гесса


Ответ: 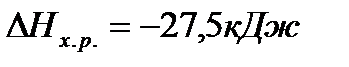 .
.
Пример 2. Вычисление изменения внутренней энергии.
Задача. Определите изменение внутренней энергии при испарении 46,8г бензола при 20оС. Теплота испарения бензола при этой температуре составляет 30,92 кДж/моль. Пары бензола подчиняются законам идеальных газов.
Решение. Изменение внутренней энергии и тепловой эффект процесса связаны между собой соотношением
 .
.
В соответствии с уравнением Менделеева-Клапейрона:  , тогда
, тогда
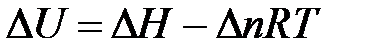 ,
,
где  – изменение числа моль газообразных веществ в результате процесса.
– изменение числа моль газообразных веществ в результате процесса.
Для процесса испарения бензола
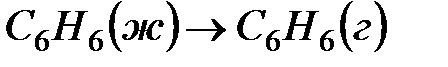
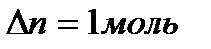 , теплота испарения бензола равна 30,92кДж/моль, то есть,
, теплота испарения бензола равна 30,92кДж/моль, то есть, 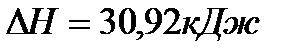 . Тогда изменение внутренней энергии при испарении 1 моль бензола
. Тогда изменение внутренней энергии при испарении 1 моль бензола 
Число моль бензола составляет 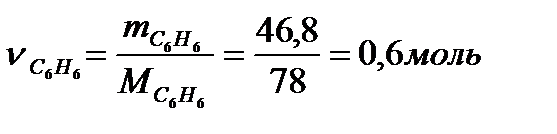
Тогда изменение внутренней энергии при испарении 48,6г бензола составляет 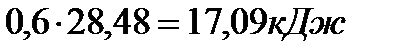 .
.
Пример 3. Определение теплового эффекта реакции на основе тепловых эффектов отдельных стадий процесса.
Задача. Даны три уравнения химических реакций:
(1) 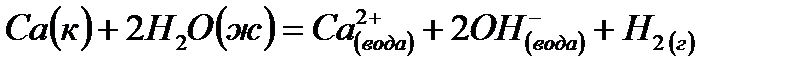 ,
, 
(2)  ,
, 
(3)  ,
,  .
.
Определите тепловой эффект реакции  .
.
Решение. Любая сложная химическая реакция может быть представлена как алгебраическая сумма ее отдельных стадий. Нетрудно заметить, что реакция  представляет собой результат комбинаций трех стадий (1) – (2) + (3). Тогда
представляет собой результат комбинаций трех стадий (1) – (2) + (3). Тогда 
Пример 4. Расчет тепловых эффектов на основе энергий химических связей. Оценка энергий химических связей на основе теплового эффекта химической реакции с учетом энергии других разрывающихся и образующихся в химической реакции связей.
Задача. Рассчитайте энергию химической связи в молекуле HBr, если известны тепловой эффект реакции 
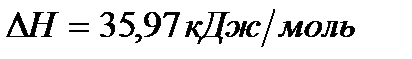 ,
,
и энергии диссоциации молекул Н2 и Br2 .
Решение. Предположим, что процесс протекает через стадии диссоциации реагентов и образование молекулы HBr. Этот процесс можно представить совокупностью следующих стадий:
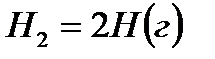 ,
, 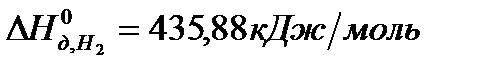
 ,
, 
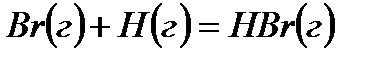 ,
, 
---------------------------------------------------------
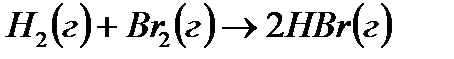 ,
, 
В соответствии с законом Гесса

откуда:


Таким образом, энергия связи HBr 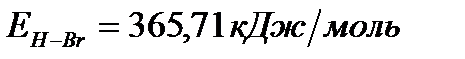 .
.
Пример 5. Определение знака изменения энтропии на основе структуры исходного и конечного состояний системы.
Задача. Как изменяется энтропия процесса таяния льда?
Решение. Изменение энтропии этого процесса характеризует величина 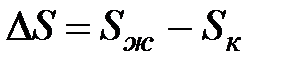
Кристаллическое состояние характеризуется высокой упорядоченностью, обусловленной структурой кристаллической решетки, в которой атомы жестко связаны между собой и имеют ограниченное число степеней свободы. Такая структура может быть представлена малым числом микросостояний. В жидком состоянии молекулы имеют большую свободу движений относительно друг друга, что обусловливает образование значительно большего числа комбинаций взаимного расположения молекул (микросостояний). Поэтому такое состояние имеет большие значения S, чем кристаллическое состояние, т.е.  . Это приводит к положительному изменению энтропии.
. Это приводит к положительному изменению энтропии.
Пример 6. Определение знака изменения энтропии процесса на основе строения реагентов и продуктов реакции.
Задача. Как изменится энтропия процесса гидрирования фенола

Решение. Как и в предыдущем примере процесса определяется разностью энтропий конечного и исходного состояний
 (1)
(1)
Из двух структур C6H11OH и C6H5OH первая является более высокоорганизованной, поскольку заключает в себе большее количество химических связей и большее число структурных единиц (атомов). Поэтому 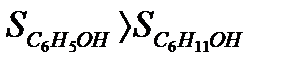 . Кроме того, второй реагент является газом, молекулы которого автономны и имеют бесчисленное множество микросостояний, поэтому
. Кроме того, второй реагент является газом, молекулы которого автономны и имеют бесчисленное множество микросостояний, поэтому  . Все это обусловливает в соответствии с (1) уменьшение энтропии при реализации процесса.
. Все это обусловливает в соответствии с (1) уменьшение энтропии при реализации процесса.
Пример 7. Выявление возможности протекания химической реакции по величине изменения энергии Гиббса.
Задача. В каком направлении будет протекать реакция 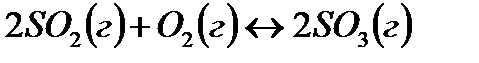 в стандартных условиях?
в стандартных условиях?
Решение. Изменение энергии Гиббса в данной реакции характеризуется равенством
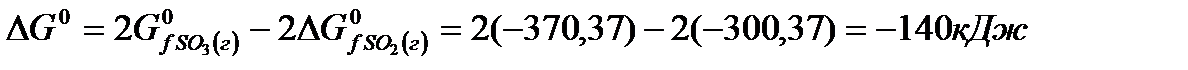
Поскольку  , то в стандартных условиях данная реакция может протекать в сторону образования
, то в стандартных условиях данная реакция может протекать в сторону образования  .
.
Пример 8. Вычисление изменение энергии Гиббса в химической реакции по значениям теплот образования и энтропий реагирующих веществ и продуктов реакции.
Задача. Вычислите изменение энергии Гиббса для химической реакции 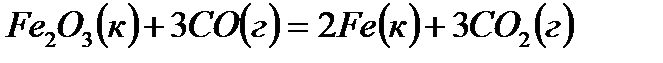 . Возможно ли протекание этой реакции в стандартных условиях?
. Возможно ли протекание этой реакции в стандартных условиях?
Решение. Воспользуемся для решения поставленных задач значениями теплот образования и энтропий реагентов и продуктов реакции:


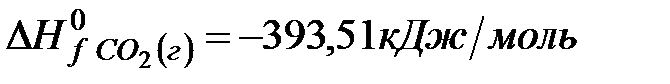
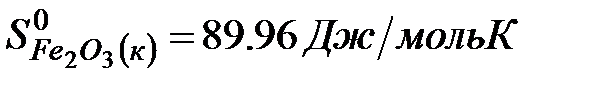

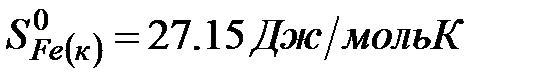

Изменение энергии Гиббса в химической реакции при температуре Т можно рассчитать по уравнению
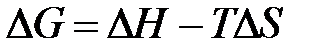 .
.
рассчитываем на основе следствия из закона Гесса (см. ур-е 7): 
 .
.
Изменение энтропии в соответствии с уравнением (6) выражается равенством: 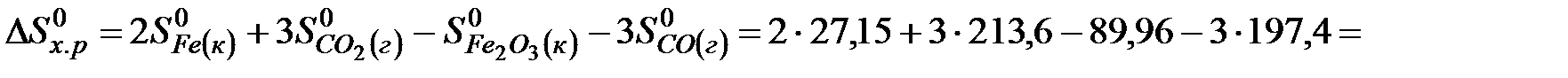
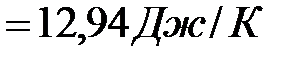 .
.
Изменение энергии Гиббса в химической реакции равно

Из результатов расчета (  ) следует, что в стандартных условиях реакция осуществима.
) следует, что в стандартных условиях реакция осуществима.
Химическая кинетика и катализ. химическое равновесие
Кинетика – раздел химической науки, изучающий скорости химических реакций и факторы, влияющие на скорость реакций.
Термодинамика на основе значений  Gили других критериев дает ответ на вопрос принципиальной осуществимости того или иного процесса. Но она не может ответить на вопрос, насколько быстро может быть осуществлен переход в термодинамически выгодном направлении. Если этот переход характеризуется бесконечно большим временем, то такой процесс невыгодно осуществлять в данных условиях и необходимо использовать факторы, которые бы его интенсифицировали. Например, реакция окисления водорода
Gили других критериев дает ответ на вопрос принципиальной осуществимости того или иного процесса. Но она не может ответить на вопрос, насколько быстро может быть осуществлен переход в термодинамически выгодном направлении. Если этот переход характеризуется бесконечно большим временем, то такой процесс невыгодно осуществлять в данных условиях и необходимо использовать факторы, которые бы его интенсифицировали. Например, реакция окисления водорода 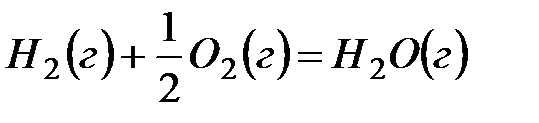
без каких-либо внешних воздействий не протекает в стандартных условиях, несмотря на его термодинамическую выгодность (  ). Внесение в такую систему катализатора, платиновой черни, приводит к мгновенному взаимодействию – взрыву. Этот результат можно проиллюстрировать нижеследующей энергетической диаграммой (рис.1).
). Внесение в такую систему катализатора, платиновой черни, приводит к мгновенному взаимодействию – взрыву. Этот результат можно проиллюстрировать нижеследующей энергетической диаграммой (рис.1).
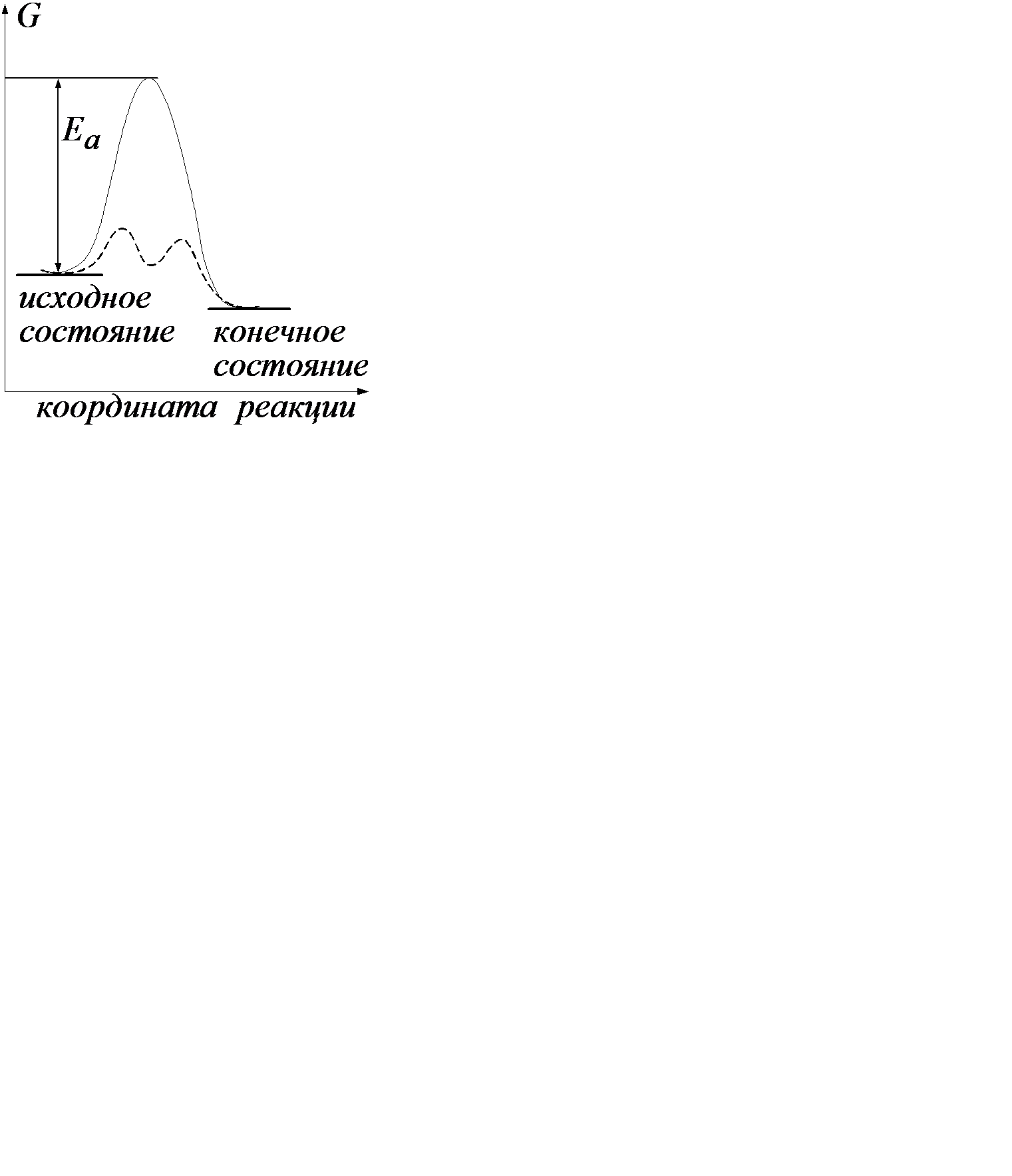
Рис.1 Энергетическая диаграмма реакции.
Можно видеть, что 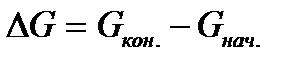 имеет отрицательное значение, обусловливающее осуществимость этого процесса. В то же время энергетический барьер ЕА, который должна преодолеть реакция, достаточно высок. Такой барьер трудно преодолеть, что и выражается в бесконечно низкой скорости реакции. Если использовать в этом процессе катализатор, то с его помощью реакция начинает протекать по новому энергетическому руслу (пунктирная линия). Можно видеть, что барьеры, которые должна преодолевать система, проходя через это русло, существенно ниже, и ее собственного энергетического запаса хватает, чтобы с лихвой их преодолеть. Это находит свое выражение в резком ускорении реакции.
имеет отрицательное значение, обусловливающее осуществимость этого процесса. В то же время энергетический барьер ЕА, который должна преодолеть реакция, достаточно высок. Такой барьер трудно преодолеть, что и выражается в бесконечно низкой скорости реакции. Если использовать в этом процессе катализатор, то с его помощью реакция начинает протекать по новому энергетическому руслу (пунктирная линия). Можно видеть, что барьеры, которые должна преодолевать система, проходя через это русло, существенно ниже, и ее собственного энергетического запаса хватает, чтобы с лихвой их преодолеть. Это находит свое выражение в резком ускорении реакции.
Уравнение скорости необратимой химической реакции

может быть выражено в следующей форме:
 (1)
(1)
где :
k– константа скорости, определяемая как величина скорости при единичных концентрациях реагентов [А]= 1 моль/л, [В]= 1 моль/л и т.д.;
 – частные порядки реакции по соответствующим реагентам А, В и др., определяющие степень влияния этих реагентов на скорость реакции;
– частные порядки реакции по соответствующим реагентам А, В и др., определяющие степень влияния этих реагентов на скорость реакции;
Сумма частных порядков реакции  +… называется общим порядком реакции.
+… называется общим порядком реакции.
Уравнение (1) в концентрированном виде включает в себя действие различных факторов. К таким факторам относятся:
· концентрация реагентов;
· давление;
· температура;
· катализатор.
Концентрация реагентов является фактором ускорения химических реакций, поскольку, как правило, порядки реакции имеют положительное значение. Физически это легко объяснимо: с ростом концентрации возрастает количество молекул реагентов в единице объема, а следовательно, вероятность их столкновений, приводящих к химическому взаимодействию.
Давление выступает в качестве фактора ускорения процесса, когда реагент является газом. Так, если мы имеем дело с реакцией газообразных реагентов, то к каждому из них применимы газовые законы  .
.
Из последнего выражения следует, что
 (2)
(2)
Поскольку  по определению концентрация реагента А, а рА по закону Дальтона линейно зависит от общего давления
по определению концентрация реагента А, а рА по закону Дальтона линейно зависит от общего давления 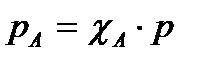 , то выражение (2) приобретает вид:
, то выражение (2) приобретает вид:
 ,
,
где:  – мольная доля компонента А в газовой смеси. Значение
– мольная доля компонента А в газовой смеси. Значение  можно считать постоянной величиной и тогда
можно считать постоянной величиной и тогда
 ,
,
где  .
.
Таким образом, увеличение давления приводит к росту концентрации газообразных реагентов и в этой связи выступает как фактор скорости процесса.
Если реакционная система представляет собой систему газ – жидкость, то увеличение парциального давления газообразного реагента в соответствии с законом Генри приводит к увеличению его растворимости в жидкой реакционной массе, где, как правило, протекает реакция. Таким образом, и в этом случае давление выступает в качестве фактора увеличения концентрации реагента и, соответственно, фактора скорости процесса.
Влияние температуры на скорость реакции связано с ее влиянием на константу скорости. Основное уравнение, иллюстрирующее это влияние – уравнение Аррениуса:
 (3)
(3)
где:
А – предэкспоненциальный множитель;
ЕА – энергия активации, имеющая смысл минимального избытка энергии, которым должна обладать реагирующая частица по сравнению с их средней энергией, чтобы прореагировать.
Ускоряющее действие температуры физически обосновывается увеличением с ростом температуры доли частиц, обладающих минимальным избытком энергии ЕА, гарантирующим им преодоление энергетического барьера.
Другое, менее строгое выражение для температурного влияния на скорость химической реакции – уравнение Вант-Гоффа:
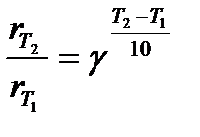 (4)
(4)
где:
 – скорости реакции при температуре Т2и Т1 соответственно;
– скорости реакции при температуре Т2и Т1 соответственно;
 – коэффициент Вант-Гоффа, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10оС.
– коэффициент Вант-Гоффа, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10оС.
Действие катализатора как фактора ускорения процесса рассматривалось выше. Смысл ускоряющего действия катализатора – понижение энергетического барьера реакции (ЕА).
Реакции, в которых по мере накопления продуктов реакции последние вступают во взаимодействие между собой с образованием исходных реагентов, называются обратимыми.
По мере протекания этих реакций система приближается к состоянию равновесия, в котором скорости прямой и обратной реакций равны. Если на систему в состоянии равновесия не действуют какие-либо внешние факторы, то это состояние остается неизменным бесконечно долгое время и характеризуется постоянством состава реакционной массы.
Для обратимой химической реакции

состояние равновесия определяется равенством скоростей прямой и обратной реакций

Из последнего выражения следует, что
 (5)
(5)
Поскольку является константой, то правая часть уравнения (5) также будет постоянной величиной, отражающей неизменность состава реакционной массы в состоянии равновесия. Величина  =К называется константой равновесия, характеризующей состояние системы в условиях равновесия.
=К называется константой равновесия, характеризующей состояние системы в условиях равновесия.
В стандартных условиях для обратимой реакции имеет место соотношение
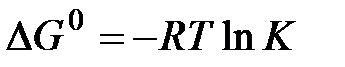 (6)
(6)
Руководствуясь этим соотношением и рисунком 1, можно показать, что катализатор, ускоряя прямую и обратную реакции, лишь ускоряет достижение равновесия, не влияя на его положение. Действительно, и в каталитической и в некаталитической реакции 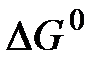 не меняется, а следовательно не меняется иКи, соответственно, состав системы в состоянии равновесия.
не меняется, а следовательно не меняется иКи, соответственно, состав системы в состоянии равновесия.
Принцип смещения равновесия (принцип Ле–Шателье) определяет направление смещения равновесия под действием различных факторов:
Если на систему, находящуюся в состоянии равновесия, оказывается внешнее воздействие, то равновесие смещается в сторону процесса, ослабляющего это воздействие.
Примеры решения типовых задач.
Пример 1. Влияние концентрации реагента на скорость химической реакции.
Задача. Определите скорость реакции  по реагентам А и В, если при увеличении концентрации вещества А в 4 раза скорость реакции возрастает в 2 раза, а концентрации В в 4 раза – в 4 раза.
по реагентам А и В, если при увеличении концентрации вещества А в 4 раза скорость реакции возрастает в 2 раза, а концентрации В в 4 раза – в 4 раза.
Решение. Скорость реакции можно выразить уравнением
 (7)
(7)
В условии варьирования концентрацииА концентрация В постоянна. Тогда уравнение (7) приобретает вид
 (8)
(8)
где 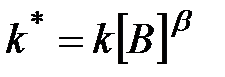 .
.
При увеличении [А] в 4 раза его новая концентрация составит 4[А]. Тогда скорость реакции для этих разных концентраций в соответствии с уравнение (8) выразится уравнениями:
 (9)
(9)
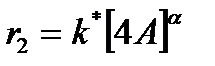 (10)
(10)
Поделив почленно левые и правые части уравнений скорости (9) и (10), имеем
 .
.
Так как 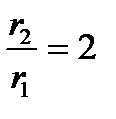 , то
, то  , откуда
, откуда  .
.
Порядок по[В] определяется в условиях постоянства концентрации [А]. Тогда
 , где
, где 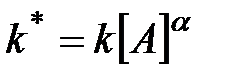 .
.
При увеличении концентрации [В] в 4 раза имеем соотношение скоростей реакции
 .
.
Так как  , то
, то  , откуда имеем
, откуда имеем  .
.
Окончательный вид кинетического уравнения:  .
.
Пример 2. Выявление роли давления как фактора скорости реакции.
Задача. Во сколько раз увеличится скорость элементарной реакции  при увеличении давления в системе в 3 раза?
при увеличении давления в системе в 3 раза?
Решение. Скорость этой реакции можно выразить уравнением
 . (11)
. (11)
В соответствии с уравнением Менделеева-Клапейрона
 . (12)
. (12)
Аналогично
 (13)
(13)
Подставляя (12) и (13) в уравнение (11), имеем
 (14)
(14)
где 
При увеличении давления в 3 раза скорость реакции в соответствии с уравнением (14) составит
 (15)
(15)
Сравнивая (14) и (15), видим, что скорость реакции при увеличении давления в 3 раза увеличивается в 27 раз.
Пример 3. Влияние температуры на скорость реакции.
Задача. Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30оС до 70оС, если температурный коэффициент реакции равен 2?
Решение. В соответствии с уравнением Вант-Гоффа
 .
.
При повышении температуры на 40о скорость реакции увеличится в 16 раз.
Пример 4. Определение времени протекания реакции в зависимости от температуры.
Задача. При 393К реакция завершается за 10 минут. Сколько времени будет продолжаться реакция при 363К, если температурный коэффициент этой реакции равен3?
Решение. В соответствии с уравнением Вант-Гоффа

Поскольку между скоростью реакции и временем ее протекания существует обратно пропорциональная зависимость, то
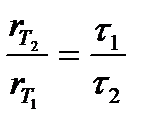
Подставляя в левую часть уравнения Вант-Гоффа вместо 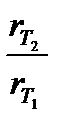
 имеем
имеем
 , откуда
, откуда
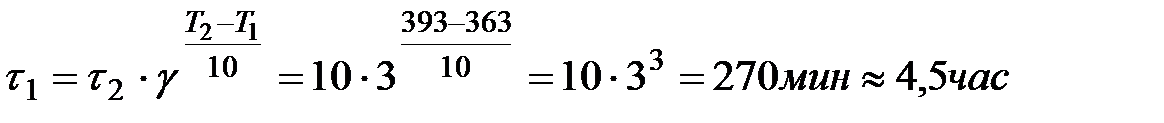 .
.
При температуре 363К реакция закончится за 4,5 часа.
Пример 5. Влияние температуры на константу скорости.
Задача. Во сколько раз увеличится скорость реакции при повышении температуры от 30о до 60о, если ее энергия активации составляет 80 кДж/моль?
Решение. Скорость реакции можно представить кинетическим уравнением
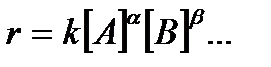
При сопоставлении скоростей реакции при разных температурах имеем
 .
.
В соответствии с уравнением Аррениуса
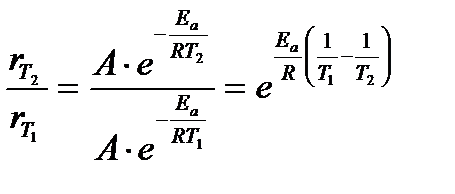 .
.
Подставляя значения  в последнее выражение, имеем
в последнее выражение, имеем

Пример 6. Вычисление равновесных концентраций реагирующих веществ.
Задача. Реакция протекает по уравнению  . Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ Аи В соответственно равны: 4 и 6 моль/л, константа равновесия К = 1.
. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ Аи В соответственно равны: 4 и 6 моль/л, константа равновесия К = 1.
Решение. К моменту равновесия концентрации веществ А и В понизятся, а концентрация вещества С увеличится. На каждый моль вещества А и В образуется 2 моль вещества С. Поэтому если понижение концентрации вещества А и В обозначить через х моль, то увеличение концентрации вещества С будет 2х моль.
Тогда равновесные концентрации реагирующих веществ:

В соответствии с выражением для константы равновесия
 имеем
имеем  , откуда
, откуда  .
.
Решение этого уравнения дает значение х=1,62.
Отсюда равновесные концентрации реагирующих веществ равны:

Пример 7. Влияние изменения концентрации реагирующих веществ на смещение равновесия.
Задача. В результате протекания химической реакции 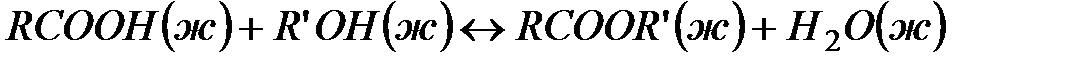 установилось равновесие, которому соответствуют концентрации реагентов
установилось равновесие, которому соответствуют концентрации реагентов  ,
,  ,
, 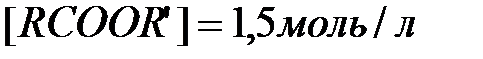 ,
,  . Как изменится концентрации компонентов при резком снижении концентрации эфира до 0,5 моль/л?
. Как изменится концентрации компонентов при резком снижении концентрации эфира до 0,5 моль/л?
Решение. Резкое снижение концентрации продукта реакции приводит к нарушению равновесия. В соответствии с принципом Ле-Шателье система стремится восполнить возникший дефицит концентрации эфира путем протекания процесса слева направо до нового состояния равновесия. Обозначим количество дополнительно образующегося эфира в результате вновь установившегося равновесия через х. Тогда новый состав равновесной смеси в соответствии со стехиометрией реакции будет выглядеть следующим образом:
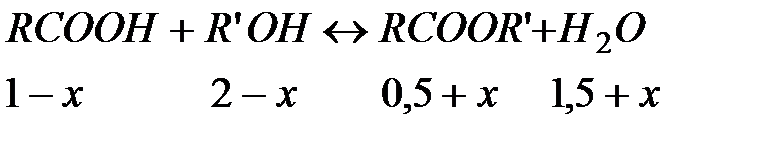
Константа равновесия в соответствии с результатами ранее установившегося равновесия
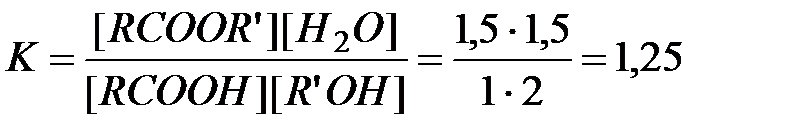 .
.
Новое состояние равновесия характеризуется той же константой
 , откуда
, откуда
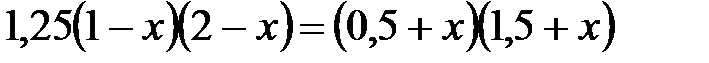
 .
.
Это уравнение имеет два решения
 ;
;  .
.
Первое, как не имеющее физического смысла, отбрасываем и принимаем  . Новому состоянию равновесия соответствуют следующие концентрации компонентов
. Новому состоянию равновесия соответствуют следующие концентрации компонентов
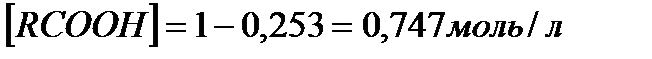

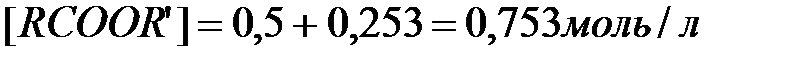
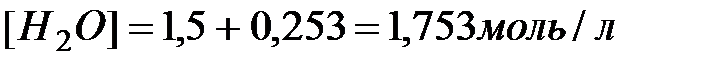 .
.
Пример 8. Влияние изменения температуры, давления и концентрации на смещение химического равновесия .
Задача. Реакция синтеза метанола протекает по уравнению  ,
,  .
.
Как надо изменить температуру, давление и концентрацию, чтобы сместить равновесие в сторону образования метанола.
Решение. А) Поскольку реакция экзотермическая, то на повышение температуры (нагревание) система в соответствии с принципом Ле-Шателье реагирует развитием процесса, который ослабляет это воздействие. Это процесс поглощения тепла, т.е. реакция, обратная синтезу метанола. Таким образом, при повышении температуры равновесие смещается в сторону исходных реагентов. Соответственно, чтобы сместить равновесие в сторону образования метанола, температуру необходимо понижать.
Б) На увеличение объема система в соответствии с принципом Ле-Шателье стремится ослабить это воздействие, принимая меньший объем. Поскольку уменьшение объема соответствует протеканию реакции в сторону образования метанола, то с повышением давления равновесие смещается в правую сторону. Поэтому для смещения равновесия в сторону образования метанола давление необходимо повышать.
В) Применение избытка одного из реагентов является фактором смещения равновесия в сторону образования метанола. Благодаря избытку реагента создается его сверхравновесная концентрация, и реакция протекает в направлении, обеспечивающем снижение этой концентрации, т.е. в сторону образования метанола.
Вопросы для самостоятельной работы по разделу Физическая химия:
1. Агрегатные состояния вещества. Газообразное состояние вещества.
2. Идеальный газ. Газовые законы. Реальные газы.
3. Жидкое состояние вещества.
4. Твердое состояние вещества. Типы кристаллических решеток.
5. Сущность тепловых процессов в общественном питании.
6. Кинетика процессов сушки и выпечки продуктов в общественном питании
7. Температура кристаллизации и кипения.
8. Электрофизические методы обработки пищевых продуктов
КОЛЛОИДНАЯ ХИМИЯ
Коллоидная химия – это наука о коллоидах и поверхностях. Она изучает системы : грубодисперсные (частицы > 1мкм) и высокодисперсные (от1мкм до 1 нм).Дисперсные системы гетерогенны и состоят из 2 и более фаз :дисперсной фазы и дисперсной среды. Например: Т /Ж - золи, суспензии, Ж/Ж - эмульсии, Г/Ж - газовые эмульсии, пены….
Адсорбция. Поверхностные явления
К поверхностным явлениям относят те эффекты и особенности поведения веществ, которыенаблюдаются на поверхности раздела фаз. Причиной поверхностных явлений служит особое состояние молекул в слоях жидкостей и твердых тел, непосредственно прилегающих к поверхностям раздела. Эти слои резко отличаются по многим характеристикам (плотности, вязкости, электрической проводимости…). Изучение взаимодействий в поверхностных слоях необходимо для развития многих областей науки и практики, начиная от выяснения механизмов атмосферных явлений и кончая технологией моющих, клеящих, косметических средств. В производстве лекарств большую роль играют такие поверхностные явления как адсорбция, смачивание, адгезия, когезия.
Адгезия (прилипание) - это молекулярное притяжение между поверхностями двух соприкосающихся разнородных твердых или жидких фаз.
Когезия – сцепление однородных молекул, атомов или ионов, которое включает все виды межмолекулярного и межатомного притяжения внутри одной фазы. Твердые и жидкие состояния обладают большой когезией, газы – малой.
Процессы поглощения газов или растворенных веществ твердыми материалами или жидкостями могут протекать по разным механизмам и носят общее название сорбции. Вещества- поглотители, называются сорбентами, поглощаемые газы или растворенные вещества - сорбатами.
Адсорбцией называется самопроизвольное концентрирование на твердой или жидкой поверхности раздела фаз вещества с меньшим поверхностным натяжением. Адсорбируемое вещество называют адсорбат. Адсорбирующее - адсорбент. Адсорбция является чисто поверхностным процессом, который заключается во взаимодействии молекул или ионов адсорбата с поверхностью адсорбента за счет сил Ван –дер –Ваальса, водородных связей, электростатических сил. Скорость такогопроцесса велика, и адсорбция происходит мгновенно, если поверхность адсорбента легко доступна для молекул адсорбата. В пористых адсорбентах адсорбция протекает медленнее и с тем меньшей скоростью, чем тоньше поры адсорбента.Избыток или недостаток растворенного вещества в поверхностном слое, отнесенный к единице поверхности, обозначают через Г, называют гиббсовой адсорбцией. Если Г > 0, то адсорбция положительна, это характерно для ПАВ. Если Г< 0 ,то адсорбция отрицательна, это характерно для ПИВ (поверхностно инактивных веществ).
Положительной адсорбцией называют адсорбцию, сопровождающуюся накоплением растворенных веществ в поверхностном слое.
Отрицательной – адсорбцию, сопровождающуюся вытеснением растворенного вещества из поверхностного слоя внутрь среды. Практическое значение имеет только положительная адсорбция.
Не пористые адсорбенты обладают наружной поверхностью, а пористые – внутренней.
Типы промышленных адсорбентов:
-углеродные (активированный уголь, углеродные волокна, графит, ткань…)
-минеральные (силикогель, глины).
Дисперсные и коллоидные системы
Классификация дисперсных систем:
1. По размеру частиц: - грубодисперсные (взвеси, суспензии, эмульсии, порошки)
-коллоидно-дисперсные (золи)
- молекулярные и ионные растворы
2. По агрегатному состоянию: Ж/Г – туман, аэрозоли..
Т/Г - дым, пыль.
Г/Ж – пены, газовые эмульсии.
Ж/Ж - молоко.
Т/Ж – суспензии.
Г/Т – твердые пены, хлеб, пемза.
Ж/Т – жемчуг, гели.
Т/Т – цветные стекла, минералы, сплавы.
Г/Г – не существует, т. к. является гомогенной молекулярной, в ней нет границы раздела.
Золи –высокодисперсные коллоидные растворы, относящиеся к системе Т/Ж.
Гидрозоли – это золи у которых дисперсная среда –вода.
Органозоли – коллоидный раствор у которого дисперсная среда - органическая жидкость.
Аэрозоли –золи с газообразной средой.
Лиозоли – золи с жидкой средой.
3. По наличию или отсутствию взаимодействия между частицами дисперсных фаз:
свободно-дисперсные - аэрозоли, лиозоли, эмульсии
связано-дисперсные - гели, студни, пены
4. По степени взаимодействия фазы и среды: лиофильные (сильно выражено взаимодействие), иофобные (слабо выражено взаимодействие)
Свойства коллоидных систем:
- броуновское движение. С увеличением размера частиц прекращается поступательное броуновское движение, затем исчезает вращательное и остается колебательное.
-диффузия - самопроизвольный процесс выравнивания концентрации частиц по всему объему раствора или газа под влиянием теплового движения.
-осмотическое давление
-седиментация – процесс оседания частиц дисперсной фазы в жидкой или газообразной среде под действием сил тяжести. Обратная седиментация – всплывание частиц.
-вязкость – внутреннее трение между слоями данного вещества, движущимися относительно друг друга. Она зависит от температуры: с повышением температуры вязкость уменьшается
- текучесть – свойство противоположное вязкости.
- оптические свойства: а) рассеивание света. В коллоидных растворах светорассеивание проявляется в виде опалесценции – матового свечения, чаще всего голубоватых оттенков, при боковом освещении золя на темном фоне. В прямом свете он может иметь красновато-желтую окраску.
б)поглощение света. Каждая среда в зависимости от своих свойств избирательно поглощает определенную часть падающего света Светопоглощение в коллоидных растворах осложняется зависимостью поглощения от дисперсности. Чем меньше размер частиц золя, тем сильнее поглощаются более короткие волны. Белые золи света не поглощают.
Грубодисперсные системы: размер частиц 1м. Частицы можно наблюдать в световой микроскоп, поэтому их называют микрогетерогенными. К ним относятся с газообразной средой – аэрозоли, порошки, а с жидкой средой – суспензии, эмульсии, пены.
Аэрозоли – система с газообразной средой и твердой или жидкой дисперсной фазой. Они образуются при взрывах, дроблении, распылении веществ, а также при конденсации пересыщенных паров воды и органических жидкостей. По агрегатному состоянию аэрозоли бывают:туманы (Ж/Г), дымы (Т/Г), пыли (Т/Г), смог (смешанного типа).
Эмульсии –Ж/Ж, жидкости не смешиваются или ограниченно смешиваются. Эмульсии бывают:
- прямые - масло /вода, бензол /вода
- обратные - вода /масло
Эмульсии бывают: разбавленные, концентрированные, высококонцентрированные. Эмульсии быстро расслаиваются. Стабилизирующие эмульсию вещества называются эмульгаторы.
Пены – дисперсные системы Г/Ж (менее устойчива) и Г/Т (более устойчива). Устойчивость пен ниже, чем эмульсий. Стабильность пен определяется по времени « жизни» свободной пленки или пузырька, а также по времени разрушения столба пены. Образование пены происходит при продувании газа через жидкость. Сущность процесса пенообразования состоит в том, что пузырьки газа, окруженные адсорбционным слоем из молекул ПАВ, поднимаются к поверхности жидкости и встречают на ней пленку. Если пленка крепка, то пузырьки накапливаются на поверхности. Пенообразование используется в процессах флотации, при тушении пожаров, в процессах очистки поверхностей от загрязнений, в пищевой, космической и фармацевтической промышленности. Пенные аэрозоли используют как кровоостанавливающее средство, препараты против ожогов. Широко применяются твердые пены: пенопласт, пеностекло, природная твердая пен.
Высокомолекулярные вещества и их растворы
Растворы высокомолекулярных веществ (ВМВ) - гомогенные термодинамически устойчивые обратимые системы, которые образуются самопроизвольно и по своей природе являются истинными молекулярными растворами.
Сходство с коллоидными растворами:
-макромолекулы состоят из многих тысяч атомов
-оптические свойства
- малая скорость диффузии
-низкое осмотическое давление.
ВМВ бывают: природные - белки, полисахариды, пектин. Имеют постоянную молярную массу;
- синтетические - пластмассы, синтетические волокна..Имеют среднее значение молярной массы.
Строение бывает: линейное – натуральный каучук;
разветвленное – крахмал;
пространственное – смолы;
сшитые – резина, эбонит.
Свойства растворов ВМВ:
1.Набухание- увеличение объема и массы полимера за счет поглощения им какого-то количества растворителя. Количественной мерой набухания является степень набухания L, которая может иметь объемное и массовое выражение L=V-V0/V0; L=m-m0/m0. Набухание может быть ограниченным (набухание желатина в воде, резины в бензоле) и неограниченным (набухание желатина в горячей воде, каучука в бензине)
2.Высаливание – процесс выделения ВМВ из раствора под влиянием электролитов или нерастворителей.
3.Коацервация – выделение новообразовавшейся фазы в виде мельчайших капель. Используется для покрытия лекарственных препаратов оболочками, с целью защиты от окружающей среды.
4.Осмотическое давление может быть измерено с достаточной точностью по уравнению Вант-Гоффа П= cRТ/ М
5. Вязкость возрастает пропорционально ассиметрии их молекулы. При одинаковой химической структуре молекул вязкость увеличивается с увеличением молекулярной массы.
Студни и гели. Понятие гель и гелеобразование относят к переходу лиофобных дисперсных систем (золей, суспензий) в вязкодисперсное состояние. Гели являются гетерогенными двухфазными системами. Переход растворов полимеров к нетекучей эластичной форме обозначают понятием студнеобразование или студень. Они могут быть гомо- и гетерогенными. Гели могут иметь коагуляционную и конденсационно-кристаллизационную структуры. Между частицами дисперсной фазы сохраняются прослойки дисперсной среды, благодаря чему проявляется не которая пластичность. Чем тоньше прослойка среды, тем больше механическая прочность структуры, но и больше ее хрупкость. Гели способны к ползучести – медленному течению без заметного разрушения пространственной структуры, и к синерезису – постепенному уплотнению структуры геля, сопровождающегося выделением дисперсной среды из капель сетки. Лиофобные хрупкие гели сохраняют свой каркас при высушивании. Высушенные гели –ксерогели – способны вновь впитывать жидкую среду. Сухие хрупкие гели ввиду пористости имеют сильно развитую поверхность и являются хорошими адсорбентами (силикогель, алюмогель.)
Гомогенные полимерные студни образуются либо при застудневании растворов линейных и разветвленных ВМВ, либо в результате набухания ВМВ. Примеры студней: желатин, агар-агар, волокна, кожа.
Вопросы для самостоятельной работы по разделу Коллоидная химия:
1. Адсорбция на границе твердое тело-газ, твердое тело-раствор
2. Практическое значение адсорбции.
3. Осмос. Осмотическое давление в дисперсных системах.
4. Коагуляция. Седиментация. Пептизация.
3. Физическая химия
1.1. Предмет и задачи физической и коллоидной химии. Агрегатные состояния вещества.
Основные понятия. Агрегатные состояния вещества, их общая характеристика. Газообразное состояние. Идеальный газ. Газовые законы.
Молекулярно-кинетическая теория газов. Реальные газы. Уравнение Ван-дер-Ваальса. Жидкое состояние вещества. Поверхностное натяжение. Твѐрдое состояние вещества. Типы кристаллических решѐток. Образование и разрушение кристаллов.
1.2.Основные понятия и законы термодинамики. Термохимия.
Понятие о химической термодинамике. Термодинамические факторы, определяющие направление процессов. Теплоты образования, разложения, сгорания и растворения химических соединений. Закон Гесса. Первое начало термодинамики. Второе начало термодинамики. Теплопередача. Термохимия: экзо- и эндотермические реакции.
1.3.Химическая кинетика и катализ. Химическое равновесие.
Скорость химической реакции. Влияние природы реагирующих веществ, площади поверхности, температуры и концентрации на скорость реакции. Катализ и катализаторы. Гомогенный и гетерогенный катализ. Ферментативный катализ. Химическое равновесие. Закон действующих масс. Обратимые и необратимые реакции. Константа равновесия, ее физический смысл. Принцип Ле-Шателье. Влияние температуры, давления и концентрации на смещение химического равновесия.
1.4.Свойства растворов.
Общая характеристика растворов. Концентрация растворов. Сущность процесса растворения. Растворимость газов в жидкостях. Взаимная растворимость жидкостей. Растворимость твѐрдых веществ в жидкостях. Диффузия и осмос в растворах.
1.5.Адсорбция и поверхностные явления.
Сорбционные процессы и их виды. Поверхностная активность. Адсорбция на границе твѐрдое тело–газ, твѐрдое тело–раствор. Адсорбция на границе жидкость – газ. Ориентация молекул в поверхностном слое и структура биологических мембран. Практическое значение адсорбции. Понятие о хроматографии, ее использование для определения витаминов, органических кислот.
2. Kоллоидная химия
2.1. Дисперсные и коллоидные системы.
Дисперсные системы: поверхностные слои, пленки, нити, мелкие частицы. Классификация по степени дисперсности: грубодисперсные системы; коллоидные растворы (золи);истинные растворы; растворы полимеров. Классификация дисперсных систем по агрегатному состоянию: свободно-дисперсные; связнодисперсные. Коллоидные растворы: понятие, виды. Золи: общая характеристика. Осмос. Осмотическое давление в дисперсных системах. Коагуляция. Седиментация. Пептизация. Грубодисперсные системы. Эмульсии и пены.
2.2. Высокомолекулярные вещества и их растворы
Общие сведения о высокомолекулярных соединениях. Свойства растворов ВМС. Набухание и растворение полимеров. Высаливание и коацервация. Гели. Студни. Свойства студней.
3. Аналитическая химия
3.1. Теоретические основы аналитической химии.
Структура современной аналитической химии. Методы анализа. Аналитические свойства и реакции веществ.
Способы выражения состава и концентрации раствора. Ионное произведение воды. Произведение растворимости. Электролитическая диссоциация. Сильные и слабые электролиты. Степень диссоциации, ее зависимость от температуры и концентрации раствора. Свойства растворов электролитов. Электрическая проводимость растворов электролитов. Диссоциация воды. Ионное произведение воды. Нейтральная, кислая, щелочная среда. Водородный показатель. Зависимость между концентрацией ионов водорода и pH среды. Индикаторы.
3.2. Основные типы используемых химических реакций.
Гидролиз солей. Константы кислотности и основности. Вычисление рН в водных растворах кислот и оснований. Реакции окисления-восстановления. Составление окислительно-восстановительных реакций методом электронного баланса. Буферные растворы. Окислительно-восстановительные потенциалы. Константы кислотности и основности. 3.3.Качественный анализ.
Характеристика методов качественного анализа. Аналитическая классификация катионов и анионов. Первая аналитическая группа катионов. Вторая аналитическая группа катионов. Третья аналитическая группа катионов. Четвёртая аналитическая группа катионов. Анионы. Аналитические операции и реакции, требования к ним. Аналитические реактивы. Техника выполнения анализа.
3.4. Количественный анализ.
Методы количественного анализа. Гравиметрический метод анализа.Титриметрический анализ. Методы титрования. Комплекснометрическое титрование. Кислотно-основное титрование. Осадительное титрование. Окислительно-восстановительное титрование. Титры, их приготовление и стандартизация. Основные типы индикаторов. Перманганатометрия. Йодометрия. Биологические методы анализа. Хроматография. Физико-химические методы анализа.
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ И ЕДИНИЦЫ ИХ ИЗМЕРЕНИЯ
Количество вещества ( n ) – это физическая величина, которая характеризует число структурных единиц (атомов, молекул, ионов, электронов, протонов, эквивалентов и др.) в определенной порции вещества.
Единица измерения количества вещества – моль.
Моль – количество вещества, содержащее столько же структурных единиц (молекул, атомов, ионов, электронов, эквивалентов и др.), сколько содержится атомов в 12 г изотопа углерода 12С, то есть 6,02·1023.
Это число (6,02·1023) называется числом Авогадро. Измеряется в моль-1.
Необходимо указывать, к каким структурным единицам относится понятие моль, например, «моль молекул водорода», «моль атомов водорода», «моль ионов водорода», «моль эквивалентов» и др.
Молярная масса – масса 1 моль вещества. Единица измерения г/моль.
Например, М(Н2О) = 18 г/моль, М(NaOH) = 40 г/моль, М(HNO3) = 63 г/моль.
| обозначения физических величин, примеры их записи и расчета |
 
|
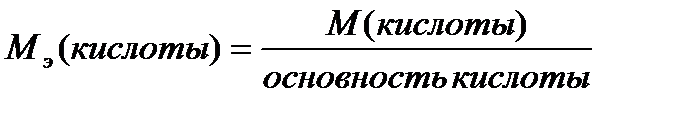 
|
 
|
 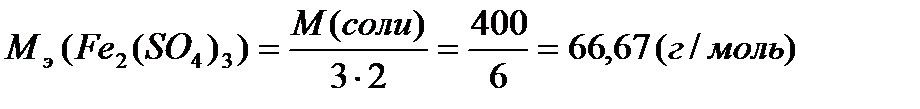
|
3.АНАЛИТИЧЕСКАЯ ХИМИЯ
Дата добавления: 2021-12-10; просмотров: 95; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
