Задачи для самостоятельного решения. 1. Константа скорости омыления этилового эфира уксусной кислооты едким натром при 10°С 2,38
1. Константа скорости омыления этилового эфира уксусной кислооты едким натром при 10°С 2,38. определить время (мин), необходимое для омыления 90 % эфира, если смешать при 10°С 1 л 0,05 н раствора эфира с :
1) 1 л 0,05 н 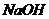 ;
;
2) 1 л 0,1 н 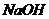 .
.
Решение.
1) Реакция омыления эфира щелочью является реакцией второго порядка. В первом случае, когда концентрации эфира и щелочи равны, выражение для константы скорости:
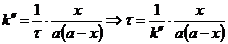
Общий объем смеси 2 л, поэтому концентрация вещества 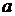 вследствие разбавления уменьшится вдвое:
вследствие разбавления уменьшится вдвое:
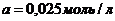 ;
;
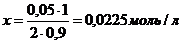
(учитываем разбавление в 2 раза и омыление на 90 %)
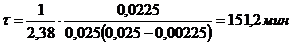 .
.
2) Во втором случае концентрации эфира и щелочи неодинаковы, поэтому выражение для константы скорости иное:
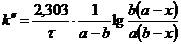 .
.
Если 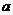 - начальная концентрация эфира,
- начальная концентрация эфира,
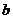 - начальная концентрация щелочи, то
- начальная концентрация щелочи, то
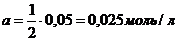 ;
;
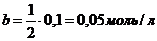 ;
;
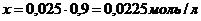 ;
;
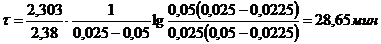 .
.
2. Константа скорости двумолекулярной реакции омыления этилового эфира уксусной кислоты едким натром при 10°С равна 2,38 ( 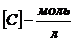 ,
, 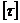 - мин). Какое время потребуется на омыление 80 % эфира, если смешать при 10°С 1 л 0,04 н раствора уксусноэтилового эфира с 1 л 0,04 н
- мин). Какое время потребуется на омыление 80 % эфира, если смешать при 10°С 1 л 0,04 н раствора уксусноэтилового эфира с 1 л 0,04 н 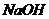 ? Как изменится время реакции, если исходные растворы будут разбавлены в 10 раз?
? Как изменится время реакции, если исходные растворы будут разбавлены в 10 раз?
(Ответ: 84,05 мин; увеличится в 10 раз)
3. Реакция омыления уксусноэтилового эфира щелочью протекает как реакция второго порядка по уравнению:
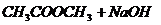 ž
ž 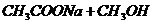 .
.
При 25°С получены следующие данные:
|
|
|
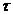 , мин , мин
| 3 | 7 | 10 | 15 | 25 |
| С, моль/л | 0,00740 | 0,00550 | 0,00464 | 0,00363 | 0,00254 |
Исходные концентрации эфира и щелочи одинаковы: 0,01 моль/л. найти среднее значение константы скорости реакции при 25°С и время, за которое произойдет омыление 50 % эфира ( 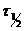 ).
).
4. При 20°С 0,01 М раствор уксусноэтилового эфира омыляется 0,02 М 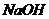 в течение 23 мин на 10 %. Как изменится это время, если уменьшить концентрации реагирующих веществ в 5 раз?
в течение 23 мин на 10 %. Как изменится это время, если уменьшить концентрации реагирующих веществ в 5 раз?
5. При омылении 0,01 М раствора метилацетата 0,01 М раствором 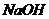 при 25°С получили:
при 25°С получили:
 , сек , сек
| 180 | 300 | 420 | 600 |
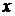 , моль , моль
| 2,60 | 3,66 | 4,50 | 5,36.10-3 |
 - количество прореагировавшего
- количество прореагировавшего 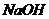 .
.
Рассчитать 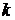 и показать графически, что эта реакция имеет второй порядок.
и показать графически, что эта реакция имеет второй порядок.
(Ответ: 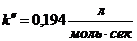 ).
).
6. Константа скорости омыления уксусноэтилового эфира едким натром при 9,4°С равна 2,37, а при 14,4°С – 3,204. вычислить по уравнению Аррениуса, при какой температуре константа скорости будет равна 15?
Контролирующие задания.
1. Даны константы скорости инверсии сахарозы при различных температурах (приложение, табл. 1).
Вычислить:
1. энергию активации (графический метод);
2. константу скорости при 40°С.
2. Дана константа скорости омыления этилацетата щелочью при 25°С с концентрацией 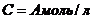 (приложение, табл. 2).
(приложение, табл. 2).
|
|
|
Вычислить:
1. Время (сек), необходимое для омыления 80 % эфира, если смешать:
1. равные объемы растворов щелочи и эфира с концентрацией 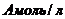 ;
;
2. равные объемы растворов щелочи и с концентрацией 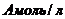 и эфира с концентрацией 2
и эфира с концентрацией 2 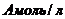 .
.
2. Как изменится время реакции (случай 1а), если исходные растворы разбавить в 10 раз?
3. Даны константы скорости омыления эфира щелочью при 2х разных температурах (приложение, табл. 3).
Вычислить: энергию активации по уравнению Аррениуса.
Приложения.
Таблица 1. Константы скорости инверсии сахарозы в 0,1 н 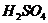 .
.
| Состав раствора |
| |||
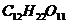 , г/л , г/л
|  , моль/л , моль/л
| 20°С | 30°С | 50°С |
| 100 | 51,95 | 4,43 | 18,3 | 229 |
| 200 | 48,45 | 4,79 | 19,77 | 255 |
| 500 | 38,09 | 5,95 | 24,5 | - |
Таблица 2. Константы скорости омыления этилацетата при 25°С.
| Щелочь |
| ||
| 0,0500 моль/л | 0,0250 моль/л | 0,0125 моль/л | |
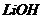
| 6,39 | - | - |
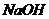
| 6,36 | 6,32 | 6,21 |
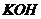
| 6,65 | 6,46 | - |
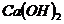
| - | 6,06 | 6,31 |
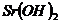
| - | 6,08 | - |
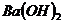
| 6,23 | 6,29 | 6,35 |
Таблица 3. Константы скорости щелочного омыления сложных эфиров.
|
|
|
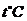
| 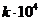 м3моль-1сек-1
м3моль-1сек-1
| 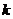 л.моль-1мин-1
л.моль-1мин-1
| 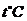
| 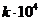 м3моль-1сек-1
м3моль-1сек-1
| 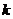 л.моль-1мин-1
л.моль-1мин-1
| |
| этиловый эфир уксусной кислоты | бутиловый эфир уксусной кислоты | |||||
| 0 | 0,195 | 1,17 | 10 | 0,353 | 1,94 | |
| 20 | 0,847 | 5,08 | 20 | 0,655 | 3,93 | |
| 25 | 1,093 | 5,56 | втор-бутиловый эфир уксусной кислоты | |||
| этиловый эфир пропионовой кислоты | 10 | 0,293 | 1,76 | |||
| 0 | 0,19 | 1,14 | 20 | 0,59 | 3,54 | |
| 25 | 0,957 | 5,94 | трет-бутиловый эфир уксусной кислоты | |||
| пропиловый эфир уксусной кислоты | 10 | 0,00615 | 0,0369 | |||
| 10 | 0,358 | 2,15 | 20 | 0,0135 | 0,0810 | |
| 20 | 0,705 | 4,23 | ||||
Литература
1. Дулицкая Р. А., Фельдман Р. И. Практикум по физической и коллоидной химии. М.: Высшая школа, 1978, - 296 с.
2. Гамеева О. С. Сборник задач и упражнений по физической и коллоидной химии. М.: Высшая школа, 1980, - 191 с.
3. Хмельницкий Р. А. Физическая и коллоидная химия. М.: Высшая школа, 1988, - 400 с.
4. Справочник физико-химических величин. Под редакцией К. П. Мищенко и А. А. Равделя. Л.: Химия, 1972. – 200 с.
СОДЕРЖАНИЕ
1. Изучение скорости инверсии тростникового сахара.
|
|
|
1.1 Теоретические основы.. 3
1.2 Описание поляриметра. 4
1.3 Физические основы действия прибора. 5
1.4 Экспериментальная часть. 7
Опыт 1. Определение константы скорости. 7
Опыт 2. Определение зависимости скорости реакции инверсии сахарозы от температуры и расчет энергии активации. 9
1.5 Задачи для самостоятельного решения. 10
2. Фотометрическое изучение кинетики разложения комплексного иона триоксалата марганца 14
3. Кондуктометрический метод изучения кинетики взаимодействия этилацетата с гидроксильными ионами. 16
3.1 Теоретические основы. 16
3.2 Экспериментальная часть. 19
3.3 Задачи для самостоятельного решения. 21
4. Контролирующие задания. 24
Приложения. 25
Литература. 27
Подписано к печати
Формат 1/16, __ п.л.
Тираж 100 экз.
Отпечатано в КГАТУ г. Симферополь
(исполнитель Т.Якубовская)
| 28 | 1 |
| 2 | 27 |
| 26 | 3 |
| 4 | 25 |
| 24 | 5 |
| 6 | 23 |
| 22 | 7 |
| 8 | 21 |
| 20 | 9 |
| 10 | 19 |
| 18 | 11 |
| 12 | 17 |
| 16 | 13 |
| 14 | 15 |
Дата добавления: 2018-02-18; просмотров: 7556; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

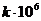 , сек-1
, сек-1