Буферлі ерітінділердін рН-ын есептеу
Дәріс Аналитикалық химия
Кіріспе
Аналитикалық химия химиялық жүйелердің құрамы мен құрылымын анықтау тәсілдерін зерттейтін ғылым; ол бейорганикалық, физикалық, органикалық химиялармен қатар химия ғылымының тарауы болып есептеледі. Талдаудың химиялық әдістері – аналитикалық химия пәнінің бір бөлімі болып табылады. Аналитикалық химия көптеген ғылымдармен, мысалы: физика, биология, медицина, металлургия, геологиямен тығыз байланыста. Және ол осы ғылымдардың дамуына мүмкіндік туғыза отыра, физикалық, математикалық, биологиялық әдістерді қолдану арқылы өзінің де мүмкіншілігін арттырады.
Химиялық анализ қойылатын мақсаттарына байланысты сапалық талдау және сандық талдау болып екі тарауға бөлінеді.
Сапалық талдаудың мақсаты – заттардың сапалық құрамын анықтау, яғни, қандай элементарлық бөлшектерден тұратындығын табу (атомдық, молекулалық, иондық , изотоптық құрамын). Сонымен қатар, белгілі қосылыстармен ұқсастыру ( идентификациялау). Органикалық қосылыстардың құрамында жеке элементтерді ғана анықтау жеткіліксіз, функционалды топтарды да анықтау қажет.
Сандық талдаудың негізгі мақсаты – зертелетін заттың құрамындағы компоненттердің массалық үлесің немесе олардың бір-біріне қатынасын анықтау.
|
|
|
Аналитикалық реакциялар мен реагенттер
Химиялық талдауды жүзеге асыру үшін зерттелінетін химиялық қосылыстың немесе оны құрайтын бөлшектердің ерекше көзге түсетін химиялық немесе физикалық қасиеттері болуы тиіс . Осындай қасиеттерді байқауға әкелетін реакциялар – аналитикалық реакциялар деп аталады. Химиялық өзгерістерге себеп болатын химиялық реактивтер – реагенттер деп аталады. Реагенттің әсерінен байқалатын өзгерістер –аналитикалық сигнал деп аталады: тұнбаның түзілуі немесе еріп кетуы, газ бөлінуі, түрлі түсті қосылыстар түзілуі ж.т.б. Аналитикалық сигналдың байқалуы заттың сапалық сипаттамасы болып табылады, ал сигналдың интенсивтілігі – оның мөлшері туралы мәлімет береді. Аналитикалық сигналды көзбен шолып және түрлі физикалық аспаптармен де байқауға болады.
крахмал иодпен ғана көк түсті қосылыс түзеді.
Тазалығына байланысты химиялық реагенттерді келесі түрлерге бөледі:
|
|
|
- техникалық таза бөгде қоспаларының үлесі > 2%;
- таза -«- 2%
- аналитикалық таза -«- 1%
- химиялық таза -«- < 1%
- жоғары эталондық таза -«- 0,01-0,00001%
- аса таза -«- < 0,00001%
Аналитикалық реагенттердің ( және реакциялардың) сезгіштігі анықталатын заттың ең аз мөлшерімен сипатталады (анықтау шегі). Белгілі аналитикалық реакциямен «ашылатын» мөлшер неғұрлым аз болса, реакцияның сезгіштігі соғұрлым жоғары болады. Реакцияның сезгіштігі өзара байланысты төрт шамамен сипатталады:
- шекті сұйылту Vlim – анықталатын заттын 1 грамы бар ерітіндінің аналитикалық сигнал бере алатын шегіне жете сұйытылған көлемі (мл/г);
- шекті концентрация Clim - белгілі реакциямен анықталатын заттың ең төмен концентрациясы (г/мл);
- шекті көлем Vmin – шегіне жете сұйытылған ерітіндінің анықтауға мүмкіндік беретін ең кіші көлемі (мл);
|
|
|
- анықталатын минимум mmin - белгілі реагент көмегімен шегіне жете сұйытылған ерітіндінің ең кіші көлемінде (Vmin) анықталатын заттың ең аз мөлшері (мкг).
Бұл шамалар бір-бірімен келесі байланыста:
mmin = Clim.Vmin . 10-6 =
Осыдан, неғұрлым анықталатын минимум төмен, ал шекті сұйылту жоғары болса, аналитикалық реакцияның сезгіштігі соғұрлым жоғары болады.
2 дәріс
Талдау әдістері
Талдау әдістері химиялық , физикалық , физика-химиялық және биологиялық деп бөлінеді.
Химиялық әдістер - химиялық реакцияларға негізделіп жүргізіледі, ал аналитикалық сигналды көзбен шолып байқайды. Химиялық реакциялардың орындалу тәсілдеріне байланысты а) құрғақ түрінде анализдеу және б) ерітінді түрінде анализдеу деп ажыратады.
Физикалық әдістерде – анализ химиялық реакцияларсыз жүреді, бұл әдіс заттардың физикалық қасиеттеріне негізделеді. Мысалы, спектралды, рентгеноструктуралық, масс-спектрометрия әдістері.
Физика-химиялық әдістерде – анализ химиялық немесе электрохимиялық реакциялардың көмегімен жүреді, ал олардың нәтижесінде жүйенің физикалық қасиеттері өзгереді. Осы өзгерістерді түрлі аспаптармен өлшейді. Физика-химиялық әдістерге потенциометрия, фотометрия, амперометрия, полярография т.б. әдістер жатады.
|
|
|
Биологиялық әдістер – микроорганизмдердің өмір сүру уақытына негізделеді. Биологиялық әдістер дәрі-дірмектің , түрлі препараттардың биологиялық активтілігін анықтау үшін қолданылады.
Химиялық әдістерге тоқтайық. . Құрғақ түрінде анализдеу тек алғаш мәлімет алу ұшін қолданылады. Бұл әдістің пирохимиялық түрінде зерттелетін заттың кристалдарын немесе ерітіндісіне малынған платина немесе нихром сымын жалында қыздырғанда, қосылыстардың ыдырауы, балқуы, айдалуы, булануы нәтижесінде жалын түсі өзгереді. Мысалы, натрий жалынның түссіз бөлігін сары түске бояйды, барий тұздары – жасыл түске, калий тқздары – күлгін түске бояйды. Құрғақ талдаудың екінші түрі – ұнтақтау әдісі. Зерттелетін затты анықтаушы реагентпен көліге салып ұнтақтайды. Реакция нәтижесінде түсті қосылыс түзіледі, түсіне байланысты қорытынды жасалады.
Ерітінді түрінде анализдеу сантиграмм-әдісімен кіші пробиркаларда жүргізіледі де аналитикалық сигнал байқалады. Тамшылық әдіспен талдауды фарфор шыныда немесе сүзгіш қағазда орындайды. Зерттелетін ерітіндінің бір тамшысын сүзгіш қағазына тамызып, оның үстіне анықтаушы реагент қосады да өзгерісті көзбен шолып байқайды. Микрокристаллоскопиялық әдісінде реакция нәтижесінде түзілген химиялық қосылыстың өзіне тән пішіні мен түсіне қарап қорытынды жасайды. Ол үшін шыны пластинкаға талданатын ерітіндінің 1-2 тамшысының қасына 1-2 тамшы реагент тамызып, шыны таяқшамен екеуін абайлап қосады және жалында ұстап буландыру аркылы концентрлейді. Содан соң тамшылардың түйіскен жерінде түзілген кристаллдарды микроскоппен қарастырады.
Анализге алынған заттың мөлшеріне байланысты да аналитикалық әдістерді келесі түрлерге бөлуге болады:
грамм-әдіс макроанализ 1-10 г;
сантиграмм-әдіс жартылай микроанализ 0,05-0,5 г;
миллиграмм-әдіс микроанализ 10-6-10-3 г;
микрограмм-әдіс ультрамикроанализ 10-9-10-6 г;
нанограмм-әдіс субмикроанализ 10-12-10-9 г.
Әдістің түріне байланысты әртүрлі химиялық ыдыс және аспаптар қолданылады.
Талдаудың жүйелік және бөлшектеу әдістері
Зерттелетін ерітіндіде бір емес бірнеше катион бірден болуы мүмкін.Оның үстіне көпшілігі бір-біріне ұқсас реакцияларға түсіп, анықтауға кедергі келтіреді. Сондықтан, иондарды белгілі бір жүйемен топтарға біріктіріп, кедергі келтіретін иондарды бөліп тастап, содан соң анықтауға кіріседі.
Иондарды осылай топтар бойынша жіктеп анықтауды жүйелік анықтау дейді.
Талдауды бөлшектеу әдісімен жүргізу үшін ерекше немесе таңдалмалы әсер ететін реагенттерді қолдану керек. Бөлшектеп анықтау әдісін А.Тананаев ашқан. Бұл әдіс жүйелік әдіспен салыстырғанда жылдамдығымен, басқа иондарды бөліп жатпай, әсіресе иондар саны көп емес ерітінділерде, бірден анықтауға мумкіндік беретінімен сипатталады.
Катиондардың аналитикалық топтары және элементтердің периодтық жүйесі
Катиондардың аналитикалық топтарға бөлінуін, әр бір топ катиондарының қасиеттерін, олардың топ реагентімен әрекеттесулерін, сол катиондарды түзетін элементтердің периодтық жүйеде алатын орнымен түсіндіруге болады. Элементтердің, олардың иондарының химиялық қасиеттері көптеген факторларға тәуелд: атомдардың және иондардың электрондық құрылыстарына, иондану потенциалына, тотығу-тотықсыздану потенциалына, заттың негізділігіне, иондардың полярлануларына, комплекс түзу қабілетіне... Катиондар қасиетіне иондардың зарядтары да әсер етеді (қосылыстардың қышқылдық қасиетіне, гидролиздену дәрежесіне, ерігіштігіне). Ионның заряды неғұрлым жоғары болса, қосылыстарының қышқылдығы соғұрлым жоғары болады, ал ерігіштігі томен. Иондардың аналитикалық сипаттамаларының ішінде маңыздылары иондану потенциал мен ионның полярлануы.
Иондану потенциалы деп ионның электр зарядының ион радиусына қатынасын айтады ( pi= z / ri ), ол зарядтың тығыздығын көрсетеді.
Катиондарды аналитикалық топтарға жіктеудің үш түрі белгілі: сульфидтік (күкірттісутектік), аммиакты-фосфатты және қышқылдық-негіздік талдау жүйелері.
Сапалық талдаудың классикалық сульфидтік жүйесінде сульфидтердің, хлоридтердің және карбонаттардың ерігіштіктері негізге алынған. Соған қарай барлық катиондар бес аналитикалық топқа бөлінеді. ( СӨЖ ). Сульфидтік талдау жүйесі универсалды жүйе, бірақ кейбір кемшіліктері бар: жұмыс барысында күкіртті сутектің колданылуы арнайы бөлме және ерекше жағдайларда жұмыс істеуді талап етеді, ойткені күкіртті сутек өте улы зат; катиондарды толық талдау үшін 25-30 сағат кетеді.
Катиондарды талдаудың аммиакты-фосфатты жүйесі фосфаттардың ерігіштігіне негізделген. Катиондар бес топқа жіктелінеді. Анықталатын катиондар санын сульфидтік жүйесімен ашылатын катиондар санымен салыстыратын болсақ, шамалары бірдей, бірақ анықтау әдісі күрделірек.
Катиондардың қышқылдық-негіздік талдау жүйесін педагогикалық оқу орындарына енгізген Д.Бесков және А.Слизовская. Бұл жүйе бойынша катиондар тұз және күкірт қышқылдарына, сілті мен аммиак ерітінділеріне қатынасты алты топқа жіктелінеді:
1-кесте
Қышкылдық-негіздік жүйе бойынша катиондарды жіктеу
| Топ | Катиондар | Топтық реагент | Түзілетін қосылыстардың ерігіштігі |
| I II III IV V VI | Na+, K+, NH4+ Ag+,Pb2+,Hg22+ Ca2+, Sr2+, Ba2+ Zn2+, Al3+, Cr3+, Sn2+ Sn(IV), As(III,V) Mg2+, Mn2+, Fe2+, Fe3+, Bi3+, Sb3+, Sb(V) Co2+, Ni2+, Cu2+, Cd2+, Hg2+ | Жоқ 2 M HCl 1 M H2SO4 4 M NaOH (арт.) 4 M NaOH (25% NH3) 25% NH3 (арт.) | Хлоридтері,сульфаттары, гидроксидтері суда ериді Хлоридтері суда ерімейді Сульфаттары суда ерімейді Гидроксидтері амфотерлі, сілтінің артық мөлшерінде ериді Гидроксидтері сілтінің (аммиактың) артық мөлшерінде ерімейді Гидроксидтері NH3-тің артық мөлшерінде ериді |
Қышқылды-негіздік жүйенің басқа жүйелерге қарағанда артықшылығы:
- топтарға жіктеуде элементтердің негізгі қасиеттеріне қатынасы қолданылған- сілтілер мен қышқылдарға, гидроксидтерінің амфотерлігі, комплексті қосылыстар түзу қабілеті;
- аналитикалық топтардағы көптеген катиондарының периодтық жүйедегі орындарына сәйкес болуы;
- лабораториялық сабақтарға жұмсалатын уакыттың күкіртті сутектік жүйемен салыстырғанда 30-40% азаюы.
3 дәріс
Иондардың қасиеттері
Гомогенді тепе-теңдік. Массалар әрекеттесу заңы
Химияда заттардың жиынтығы жүйе деп аталады. Жүйе гомогенді және гетерогенді болуы мумкін.
Гомогенді жүйе – құрамы және қасиеттері жағынан бөлінбейтін біртекті болады (бір фазадан тұрады). Мысалы, ерітінділер, газдар қоспасы т.б.
Гетерогенді жүйе- екі немесе көп фазадан тұрады. Мысалы, бір бірімен араласпайтын сұйықтар, тұнбасы бар ерітінділер, түтін т.б.
Химиялық реакциялардың көбісі ерітінділерде өтеді. Реакциялардың жүруін басқаратын заңдылықтар аналитикалық химияның теориялық негіздерінің құрама бөлігі болып табылады.
Әрекеттесу нәтижесінде бастапқы заттар толық өнімге айналып, бір ғана бағытта жүретін реакцияларды қайтымсыз реакциялар деп атайды. Мысалы,
K2CO3 + 2HCl → 2KCl + CO2 + H2O.
Бірақ көптеген жағдайларда химиялық реакциялар қайтымды болады, яғни реакция екі, қарама- қарсы бағытта жүреді. Солдан оңға қарай жазылған реакцияларды (→)тура реакциялар дейді, ал оңнан солға қарай жүретін реакцияларды(←) кері реакциялар деп атайды. Қайтымдылық белгісі ↔. Мысалы:
ZnCl2 + H2 S ↔ ZnS + 2HCl.
Химиялық реакциялар жылдамдығы жоғары және баяу жүретін реакциялар болып бөлінеді. Тепе-теңдігі 10 секундтан кем уақытта орнайтын реакцияларды жылдам жүретін реакцияларға жатқызады. Химиялық реакциялардың жылдамдығына реакцияға қатысатын заттардың табиғаты, температура, қысым, катализатор т.б. әсер етеді.
Химиялық реакциялардың жылдамдығы әрекеттесетін заттардың концентрацияларына байланысты екенін 1867 ж. Н.Гульдберг пен П.Вааге өздері ұсынған әрекеттесуші массалар заңында көрсеткен. Бұл заң бойынша химиялық реакцияның жылдамдығы реакцияға қатысатын заттардың концентрацияларының көбейтіндісіне тәуелді. Химиялық реакцияны жалпы түрде жазатын болсақ
А +В ↔ С + D
онда тура бағытта жүретін реакцияның жылдамдығы Vt = kt[A].[B], ал кері реакцияның жылдамдығы Vк = kк[С].[D]
мұнда kt және kк – пропорционалдық коэффициенттері, жылдамдық константалары деп аталады;
[A], [B], [C] және [D] - аталған заттардың тепе-теңдік концентрациялары.
Реакцияның бастапқы кезінде А мен В заттарының концентрациялары С мен Д заттарының мөлшеріне қарағанда көп. Сондықтан, тура бағытта жүретін реакцияның жылдамдығы басым болады. Бірте-бірте А мен В заттарының мөлшерлері азая бастайды, ал реакция өнімдерінің концентрациялары артады. Сол кезде кері бағытта жүретін реакцияның жылдамдығы өседі де соңында екі қарама-қарсы реакциялардың жылдамдықтары теңеседі:
Vt = Vk яғни kt [A] [B] = kк [С] [D].
Тепе-теңдік орнағанда реакциялардың тура және кері бағыттарда жүруі тоқтап қалмайды, бірақ барлық заттардың концентрациялары өзгермейді, демек динамикалық тепе-теңдік пайда болады – заттардың қанша молекулалары реакцияға қатысса, соншасы кері реакцияда түзіледі. Математикалық түрлендіру нәтижесінде жоғарыдағы теңдеуді келесі түрде жазуға болады:
 .
.
Мұнда К – реакцияның концентрациялық тепе-теңдік константасы. Жалпы түрде қайтымды реакциялар үшін
aА + bВ ↔ cС + dD,
 .
.
Химиялық тепе-теңдікте тұрақты температура мен қысымда реакцияның нәтижесінде пайда болған заттардың концентрацияларының (стехиометриялық коэффициенттерине сәйкес дәрежеде) көбейтіндісінің реакцияға қатысқан заттардың концентрацияларының көбейтіндісіне қатынасы тұрақты шама болып табылады.
Тепе-теңдік константа тура реакцияның жылдамдығының кері реакцияның жылдамдығына қатынасын көрсетеді, оның сандық мәнінен химиялық реакцияның бағытын анықтауға болады. Егер К>1 – тура бағытта жүретін реакцияның жылдамдығы басым болғаны, К<1 – кері реакцияның жылдамдығы басым, тепе-теңдік солға ығысады.
Тепе-теңдікті қажетті жаққа ығыстыру үшін заттың біреуін артық мөлшерде қосу керек, немесе реакция нәтижесінде пайда болған бір затты тұнбаға, газға, аз диссоцияланатын қосылысқа ауыстыру.
Массалар әрекеттесу заңы тәжірибеде реакцияласатын заттардың өте төмен концентрацияларында ғана әділетті. Концентрация өскен сайын заңнан ауытқылар артады. Массалар әрекеттесу заңына толық бағынатын жүйелерді идеалды деп атайды, оларға шегіне жете сұйытылған ерітінділерді жатқызуға болады. Реалды ерітінділерде иондардың концентрациялары шындық химиялық активтіктерине сәйкес келмейді. Реалды жүйелерде бөлшектер арасында электростатикалық әсерлесулер орын алады (ион-ионды, ион-дипольді, диполь-дипольді әсерлесулер). Сол себептен химиялық реакцияға түсу қабілеттігі төмендейді. Осындай иондардың эффектілі концентрациясын ескеру үшін активті концентрация яғни ативтік деген ұғым еңгізілген:
a = f .С
мұнда С– жалпы концентрация;
а - активтік;
f - активтік коэффициент, иондардың бір-бірімен әсерлесуін сипаттайды.
Реалды жүйелер үшін f<1, ал а<С Идеалды жүйелерде (шекті сұйытылған ерітінділерде) бөлшектердің ара қашықтығы өте үлкен болғандықтан, электростатикалық әсерлесулер байқалмайды, сондықтан f→1, ал а → С.
Тепе-теңдік константасы теңдігіне концентрациялардың орнына активтіктерін қойсақ, идеалды да, реалды да жүйелерде тұрақтылығын сақтайтын термодинамикалық константаға келуге болады:
 .
.
Бұл теңдеу термодинамикалық және концентрациялық тепе-теңдік константалар арасындағы байланысты көрсетеді. Активтік коэффициенттерді (f) тажірибеден және есептеу жолымен анықтауға болады. Құрамында тек аниондар немесе катиондар бар ерітінді дайындауға болмайтындықтан, тәжрибеден анықталатын активтік коэффициент мәні орташа иондық активтік коэффициент f+- болып табылады:
 AB электролит үшін.
AB электролит үшін.
Индивидуалды иондардың активтік коэффициенттерін эмпирикалық теңдеулер көмегімен табуға болады.Иондардың өзара әсерлесуіне иондардың концентрацияларымен қатар олардың зарядтары үлес қосады , осындай әсерді сипаттайтын, Льюис ұсынған, шама I – иондық күш деп аталады:

мұнда Ci мен Zi - белгілі ионның концентрациясы мен заряды.
Ерітіндінің иондық күші мен активтік коэффициенті арасындағы жалпы математикалық байланысты 1923 жылы Дебай мен Хюккель тапқан:

Мұнда А және В – температура мен диэлектрикалық өткізгіштікке тәуелді константалар,
а – иондардың ең кіші ара-қашықтығы.
Ерітіндінің иондық күшінің мәніне байланысты бұл тәуелділік әртүрлі белгіленеді:
2-кесте
Ерітінділердің иондық күшіне байланысты жеке иондардың активтік коэффициенттерін есептеуге қолданылатын теңдеулер
| I, моль/дм3 | Автор | Теңдеу |
| ≤ 0,01 | Дебай мен Хюккель | 
|
| < 0,1 | Дебай мен Хюккель | 
|
| ≤ 0,1 | Киланд |  (бейорганикалық иондар үшін)
(бейорганикалық иондар үшін)
 (органикалық иондар үшін)
(органикалық иондар үшін)
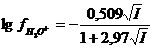
|
| > 0,1 | Дэвис | 
|
4 дәріс
Бренстед-Лоуридің протолиттік теориясы
Қышқылдар мен негіздердің тепе-теңдіктерін толық түсіндіріп сипаттайтын жалпы теория жоқ.. Қазіргі кезде қышқылдық-негіздік қасиеттер әр-түрлі теориялық концепциялар көзқарасынан түсіндіріледі. Осы теориялық концепциялардың өздеріне тән кемшіліктері мен артықшылықтары бар.
Ең бірінші қышкылдар мен негіздердің қасиеттерін түсіндірген классикалық электролиттік диссоциациялану теориясы. Оны 1887 жылы Сванте Аррениус ұсынған. Бұл ұғым бойынша: қышқылдар диссоциацияланғанда сутек-иондары мен аниондарға ыдырайды, ал негіздер – гидроксид-иондары мен катиондарға ыдырайды.
1916 жылы Льюис ұсынған теория бойынша: қышқылдарға электрондар жұбын қосып алатын заттар , ал негіздерге – электрондар жұбын бере алатын заттар жатады деп айтылған.
1923 жылы Бренстед және Лоури қышқылдар мен негіздердің протолиттік теориясын ұсынды. Бұл теория барлық қосылыстардың ( соның ішінде органикалық қосылыстардың да) қышқылдық-негіздік қасиеттерін түсіндіріп, осы қасиеттерге еріткіштердің әсерін бағалады.
Протолиттік теория бойынша протонды бөліп шығаратын заттар қышқылдар қатарына жатады, ал протонды қосып алатын заттар – негіздерге жатады:
НА ↔ р + А-
В + р ↔ ВН+
Қышқыл және түзілген негіз қосарласқан жұпты құрайды.
Көптеген қосылыстар протонды бөліп та , қосып та ала алады. Мысалы, HS- сілтілік ортада қышқыл ролін атқарады, ал қышқыл ортада протонды қосып алып – негіздік қасиет көрсетеді. Мұндай қасиет амфотерлік, ал осындай қасиеті бар заттар - амфолиттер деп аталады.
Протон алмасуымен сипатталатын реакцияларды протолиттік реакциялар деп, ал тепе-теңдікті – протолиттік тепе–теңдік деп атайды. Реалды жағдайларда протолиттік реакциялар екі қосарласқан жұптың арасында ғана орын алады: қышқыл протонды негіздің қатысуында ғана бере алады :
HCl + H2O ↔ Cl- + H3O+
қыш. нег. нег. қыш.
H2O + NH3 ↔ NH4+ + OH-
қыш. нег. қыш. нег.
H2SO4 + H2O ↔ HSO4- + H3O+
қыш. нег. нег. қыш.
HSO4- + H2O↔ SO42- + H3O+
қыш. нег. нег. қыш.
Жалпы түрде жазатын болсақ
HA + B ↔ BH+ + A-
қыш.1 нег.2 қыш.2 нег.1
Протолиттік ілімде еріткіштің протолизі маңызды орын алады. Қышқылдық – негіздік қасиеттері бар еріткіштер амфипротты еріткіштер деп аталады (су, спирттер, қышқылдар, аминдер және т.б.). Мысалы, су протолизі:
H2O + H2O ↔ H3O+ + OH-
қыш.1 нег2 қыш.2 нег.1


спирт протолизі : C2H5OH + C2H5OH ↔ C2H5OH2+ + C2H5O-
қыш.1 нег.2 қыш.2 нег.1
қышқыл протолизі:
H2SO4 + H2SO4 ↔ H3SO4+ + HSO4-
қыш.1 нег.2 қыш.2 нег.1
Протонның бірдей бөлшектер арасында ауысуын автопротолиз деп атайды. Көптеген реакциялар су ортасында жүретінболғандықтан судың автопротолизі өте маңызды роль атқарады.Судың автопротолиздену тепе – теңдігіне массалар әрекеттесу заңын қолдансақ
H2O + H2O ↔ H3O+ + OH-
Ko = 

Су өте аз ионданатындықтан, оның иондалмаған концентрациясын (активтігін) тұрақты және 1 литрде 55,5 моль деп (1000/18) есептесек, сонда
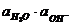 = Ko .
= Ko .  = Kw = 1.10-14
= Kw = 1.10-14
Мұнда Kw – судың автопротолиздену константасы, немесе судың иондық көбейтіндісі деп те аталады. Судың протолиздену реакциясында бірдей мөлшерде H3O+ және ОН- иондары пайда болады, сондықтан орта бейтарап (қышқыл да емес, негіз да емес)
 =
=  = √Kw
= √Kw
Тажрибеде бұл мәндердің теріс таңбамен алынған логарифмдерін пайдалануы ыңғайлы:
-lgKw = pKW
-lg  = pH
= pH
-lg  = pOH
= pOH
Сонда жоғардағы теңдеулерді келесі түрде жазуға болады:
pH + pOH = pKW = 14
pH = pOH = ½ pKW = 7
Гидроксоний иондарының активтігі гидроксил иондарының активтігінен көп болса –орта қышқылдық болады:
 >
>  ; pH< pOH
; pH< pOH
Егер керісінше болса – орта негіздік.
5 дәріс
Су емес еріткіштердегі протолиттік тепе-теңдігі.
Басқа да протонды еріткіштер су сияқты автопротолиз реакциясына қатысады: сонда еріткіштің бір молекуласы қышқыл қасиет көрсетеді, екіншісі – негіз қасиетін. Жалпы түрде кез келген еріткішті HSolv деп белгілесек, автопротолиз процесін келесі түрде жазып көрсетуге болады:
HSolv + HSolv ↔ H2Solv+ + Solv-
H2Solv+ - иондарын лионий-иондары (мысалы, гидроксоний, аммоний-иондары), ал Solv- -иондарын лиат-иондары деп аталады. Автопротолиз реакциясының константасы лионий және лиат- иондарының активтіктерінің көбейтіндісіне тең:
KHSolv = 
KHSolv =  ·
· 
Автопротолиз константасы еріткіштің өте маңызды термодинамикалық сипаттамасы. Автопротолиз көрсеткіші pKH2Solv = - lgKHSolv тікелей еріткіштің қышқылдық шкаласының ұзындығын көрсетеді. Егер активтіктердің аралығын  = 1 деп, ал
= 1 деп, ал  = KHSolv дейін алсақ, рН мәндерінің аралығы нөлден pKHsolv дейін өзгереді:
= KHSolv дейін алсақ, рН мәндерінің аралығы нөлден pKHsolv дейін өзгереді:
| Еріткіш HSolv | Лионий H2Solv+ | Лиат Solv - | KHSolv | рН шкаласы |
| Н2О Н2SO4 HCOOH CH3COOH CH3OH NH3 | Н3О+
H3SO  HCOOH
HCOOH 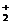 CH3COOH
CH3COOH 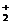 CH3OH
CH3OH 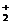 NH
NH 
| ОН-
HSO  HCOO-
CH3COO-
CH3O-
NH
HCOO-
CH3COO-
CH3O-
NH 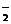
| 10-14 10-3,6 10-6,7 10-14,4 10-17,3 10-22 | 0-14,0 0-3,6 0-6,7 0-14,4 0-17,3 0-22 |
Бұдан келесі қорытынды жасауға болады: кез келген еріткіште ең күшті қышкылдық қасиет көрсететін бөлшек ( қышқыл) сол ерітіндіде түзілетін лионий-ионы, ал негіздік қасиет көрсететін (негіз) – лиат-ионы.
Күшті және әлсіз протолитер
Қышқылдар мен негіздер күшті және әлсіз протолиттер болып бөлінеді. Күшті протолиттер еріткішпен толық әрекеттеседі, ал әлсіз протолиттердің аз мөлшері әрекеттеседі де, едауір бөлігі өзгермеген түрде қалады. Мысалы, тұз қышқылының протолиздену тепе-теңдігі оң бағытқа ығысады
HCl + H2O→H3O+ + Cl- ,
ал сірке қышқылының 1%-дай мөлшері ионданады.
Қышқыл-негіздердің күшін сипаттау үшін протолиттік теорияда қышқылдық және негіздік константалар енгізілді


Қосарласқан негіздің протолизденуінің тепе-теңдік константасы негіздік константасы болып табылады
Сl- + H2O → HCl + OH-
 .
.
Қосарласқан қышқылды-негіздік жұптың константаларының көбейтіндісі

Қосарласқан қышқылды-негіздік жұптың константаларының көбейтіндісі еріткіштің автопротолиздену константасына тең, яғни су ерітіндісі үшін:
KA.KB = KW = 10-14 pKA + pKB = pKW = 14.
Күшті протолиттер үшін KA >1; KB > 1 , сонда рКА < 0; pKB < 0.
Әлсіз притолиттер үшін рКА >0; pKB >0.
Осыдан келесі қорытынды шығады: қосарласқан қышқылды-негіздік жұпты құрайтын қышқыл неғурлым күшті болса, оған сәйкес негіз соғурлым әлсіз. Өте күшті қышқылдарға өте әлсіз негіздер сәйкес келеді, ал өте әлсіз қышқылдарға өте күшті негіздер сәйкес келеді. Сол себептен өте күшті және өте әлсіз қышқылдар ерітінділерінің рН мәндері рКА (қышқылдық константаға ) тәуелсіз, өйткені протолиздену тепе-теңдігі толық бір жаққа қарай ығысады. Күшті қышқылдар ерітіндісінде НА молекулары жоқ деп есептеуге болады, олардың орнына эквивалентті мөлшерде Н3О+ -иондары түзіледі. Негіздер үшін де сондай қорытынды жасауға болады. Еріткіштің бұндай әсері еріткіштің нивелирлеу эффектісі деп аталады. HCl, HBr, HNO3 , HClO4 , H2SO4 қышқылдарының күштері суда еріткенде теңеседі. Күшті негіздердің де күштері (КOH, NaOH ,LiOH) теңеседі, себебі протолиздену тепе-теңдігі толық ОН-- иондары түзілетін бағытқа қарай ығысады.
Басқа да амфипротты еріткіштер үшін
KA. KB = K HSolv
Сондықтан күшті қышқылдар мен негіздер эквивалентті мөлшерде еріткіштерге сәйкес
лионий H2Solv+ және лиат-иондарына Solv- айналады. Лионий иондары берілген еріткіште ең күшті қышқыл болып табылады, ал лиат-иондары - ең күшті негіз.
Егер басқа еріткіштің суға қарағанда акцепторлық қасиеті күштірек болса (мысалы NH3), онда қышқылдардың рКa мәндері төмендейді, яғни қышқылдық қасиеттері артады. Ал егер еріткіштің протонды қосып алу қабілеті (акцепторлық) суға қарағанда әлсіздеу болса (мысалы сусыз СН3СООН), күшті қышқылдар әлсіз қышқылдарға айналады да олардың рКb мәндері әр-түрлі болып өзгереді. Негіздер үшін де сондай мысалдарды келтіруге болады. Еріткіштердің бұндай әсері дифференцирлеу эффектісі деп аталады.
6 дәріс
Қышқылдар мен негіздер ерітінділерінің рН-ын есептеу
1. Күшті қышқылдар мен негіздер күшті электролиттерге жатады және толық протолизденеді. Сондықтан
[H3O+] = CHA
[OH-] = CB
Мысалы, 0,01 моль/л HCl ерітіндісінде
[H3O+] = CHCl = 10-2; pH = -lg10-2 = 2
0,01 моль/л NaOH ерітіндісінде
[OH-] = CNaOH = 10-2 ; pOH = -lg10-2 = 2 ; pH = pKW – pOH = 14 – 2 = 12
2. Әлсіз қышқылдар мен әлсіз негіздер сумен қайтымды протолиттік реакцияға қатысады
HA + H2O ↔ H3O+ + A-
және термодинамикалық тепе-теңдік константасымен сипатталады

Ka – қышқылдық иондану константасы (немесе протолиздену), ол қышқылдың протондану қабілетін көрсетеді.
Әлсіз қышқылдардың протолиздену реакциясының тепе-теңдігі оңнан солға қарай ығысқан, сондықтан қышқылдың аз мөлшері гидроксоний ионына айналады да
 = CHA
= CHA
деп алуға болады (егер дисcоциациялану дәрежесі α < 0,03). Сонымен қатар константа теңдігінен көрініп тұрғандай
aH3O = aA- яғни [H3O+] = [A-]
Осыдан [H3O+ ] = √Ka.CHA
pH = -lg[H3O+] = - ½ lgKa - ½ lgCHA = ½ pKa – ½ lgCHA
Сол сияқты әлсіз негіздер үшін де ұқсас жағдайларда
 B + H2O = BH+ + OH-
B + H2O = BH+ + OH-
Kb = 
Kb – негіздік иондану константасы.
[OH-] = √Kb.Cb
pOH = -lg[OH-] = - ½ lgKb – ½ lgCb = ½ pKb - ½ lgCb
ал pH = pKw – pH = 14 - ½ pKb + ½ lg Cb
Көп протонды қышқылдар мен негіздер сатылап ионданады, бірақ бірінші сатысының иондану процесі басқа сатыларына қарағанда бірнеше есе жоғары дәрежеде жүреді. Егер  ≥1000 болса, мұндай қышқылдарды бір протонды қышқыл деп қарастыруға болады. Сонда
≥1000 болса, мұндай қышқылдарды бір протонды қышқыл деп қарастыруға болады. Сонда
pH = ½ pKa1 – ½ lg CHA
Егер әлсіз қышқылдар ерітіндісі өте сұйытылған болса, немесе қышқылдық (негіздік) константалардың мәндері үлкен болса, рН мәнін есептеу күрделенеді.



Буферлі ерітінділердін рН-ын есептеу
Ерітінділердің рН мәндерін белгілі бір шамада сақтау үшін буферлі ерітінділер пайдаланады. Буферлі ерітінділер – бұл қосарласқан әлсіз қышқыл мен әлсіз негізден тұратын жүйелер, оларға күшті қышқыл немесе күшті негіз қосқан кезде және еретіндіні сұйылтқанда рН мәні сақталады.
Қосарласқан қышқылды-негіздік жұбы бар ерітінді екі конкурентті тепе-теңдікке байланысты қышқылдық, негіздік немесе нейтралды болуы мүмкін.
НА -әлсіз қышқыл мен А- - негізі бар ерітіндіде (НА + NaA) келесі протолиттік тепе-теңдіктер орын алады:
HA + H2O = H3O+ + A- 
 (1)
(1)
A- + H2O = OH- + HA Kb =  (2)
(2)
Егер бірінші тепе-теңдік екінші тепе-теңдікке қарағанда оң жаққа көбірек ығысқан болса (Ка > Кв), ерітіндінің қышқылдығы (1)-мен анықталады:

[H3O+] = Ka.  [HA]≈ CHA ; [A- ] ≈ CA-
[HA]≈ CHA ; [A- ] ≈ CA-
Cонда тепе-теңдікке қосарласқан қышқыл мен негіздің концентрацияларының орнына қышқыл мен тұздың жалпы концентрацияларын қойып есептеуге болады:
[H3O+ ] = Ka .  ;
;
pH = pKa – lg 
Сол сияқты әлсіз негіз бен қосарласқан қышқылы ерітіндісіндегі протолиттік реакцияларды қарастырайық
B + BH+ (NH3 + NH4Cl) :
NH3 + H2O = NH4+ + OH- Kb =  = 1,76.10-5 (1)
= 1,76.10-5 (1)
NH4+ + H2O = NH3 + H3O+ Ka =  = 5,68.10-10 (2)
= 5,68.10-10 (2)
Kb > Ka
Сондықтан (1) тепе-теңдік басым болады да гидроксил-иондарының концентрациясы есептеледі:
[OH- ] = Kb.  .
.
pOH = pKb – lg  ; pH = pKW – pKb + lg
; pH = pKW – pKb + lg 
Буферлі жүйені сұйылтқанда ерітінді құрамындағы компоненттердің концентрациялары бірдей өзгереді, олардың қатынасы тұрақты болып сақталады, сондықтан рН мәні өзгермейді. Сонымен қатар, буферлі ерітіндіге күшті қышқыл немесе кұшті негіз қосылғанда да рН айтарлықтай өзгермейді. Буферлі жүйе буферлі сыйымдылықпен (ū) сипатталады, бұл 1 литр ерітіндінің рН-ын бірге өзгертуге (∆рН = 1)
жеткілікті күшті қышқылдың немесе сілтінің моль мөлшері:
ū = +- ∆ 
Буферлі жүйенің компоненттерінің концентрациялары неғұрлым жоғары болса, сыйымдылығы да соғұрлым жоғары болады , және сол компоненттердің қатынасы 1:1
тең болса ең жоғары буферлік сыйымдылығы бар ерітіндіні алуға болады.
7 дәріс
Тұздар ерітінділеріндегі гидролиттік тепе-теңдігі
Тұздардың ерітінділерінде гидролиздің әсерінен ортаның рН-ы өзгереді. Күшті негіз бен күшті қышқыл қалдықтарынан құрылған тұздар гидролизге ұшырамайды, бұндай тұз ерітінділерінің рН = 7. Басқа типті тұз ерітінділері сумен әрекеттесіп оның протолиттік тепе-теңдігін бұзады. Сондықтан рН мәндерін анықтау үшін гидролиздену константасын қолданады.
Егер гидролиз катион арқылы жүретін болса
Kt+ + H2O = KtOH + H+
[H+] = √ Kh. Cтұз
pH = ½ pKW – ½ pKb - ½ lg Cтұз
Гидролиз анион арқылы жүрсе
An- + H2O = HAn + OH-
[OH-] = √ Kb.Cтұз
pH = ½ pKW + ½ pKa + ½ lg Cтұз
Гидролиз катион және анион бойынша жүретін болса
Kt+ + An- + H2O = KtOH + HAn
pH = ½ pKW + ½ pKa – ½ pK
8 дәріс
Комплекс түзу тепе-теңдігі
Комплексті қосылыстар деп орталық ионнан және оған координацияланған лигандылардан тұратын күрделі қосылыстарды атаймыз. Комплексті қосылыстарға жоғары стехиометрия тән. Мысалы: K4[Fe(CN)6],
[Cu(NH3)4]Cl2, K[Ag(CN)2]. Жақша сыртында орналасқан катиондар мен аниондар комплексті қосылыстардың сыртқы сферасын құрайды. Сырқы және ішкі сфералар комплексті қосылыстарда иондық байланыс арқылы байланысқан, ал комплекс түзуші ионымен лигандылар электровалентті байланыс (донорлы-акцепторлы, ковалентті, сутекті) арқылы қосылған. Сондықтан, комплексті қосылыстардың ішкі және сыртқы сфераларға ыдырауы күшті электролиттер диссоциациясы сияқты толық өтеді, ал ішкі сфераның ыдырауы әлсіз электролиттердің иондануына ұқсас, яғни бұл процесс қайтымды, және өте аз мөлшерде жүреді. Мысалы:
K4[Fe(CN)6] = 4 K+ + [Fe(CN)6]4- - бұл толық қайтымсыз диссоциация
[Fe(CN)6]4- ↔ Fe2+ + 6 CN- - қайтымды процесс
Осы тепе-теңдіктің константасы комплексті қосылыстың тұрақсыздық константасы деп аталады. Ал қарама-қарсы процесстің константасы – турақтылық константасы деп аталады.
Әдетте комплекс түзілуі сатылап жүреді:
M + L = ML K1= aML/aMal
ML + L = ML2 K2 = aML2/amLaL
Және әр реакцияға жалпы тұрақтылық константаларды келтіруге болады:
M + L = ML β1 = K1
M + 2L = ML2 β2 = K1.K2 = aML2/aMaL2
Активтіктің орнына концентрацияны қойсақ концентрациялық тұрақтылық константаларының мәндері шығады:
β1c = [ML]/[M].[L] және β1c = β1 .fMfL/fML
Комплексті бөлшектер үшін материалдық баллансты метал-ионы және лиганд арқылы келтіруге болады
CM = [M] + [ML] + [ML2] + …+ [MLn]
CL = [L] + [ML] + 2[ML2] + …+n[MLn]
Комплекстүзу тепе-теңдігін сипаттау үшін комплекстену функциясы пайдаланады
F(L) = CM/[M]
Комплекстену функциясы кез-келген комплексті бөлшектердің мольдік үлесін есептеуге мумкіндік береді:
αMo = [M]/CM = 1/F(L)
αML = [ML2]/CM = β1.[L]. αMo
αMLn = [MLn]/CM = βn.[L]n. αMo
Комплекс түзілу процесіне түрлі жағдайлар әсер етеді
- лигандтардың концентрациясы
- ерітіндінің рН-ы
- ерітіндінің иондық күші
Қосымша реакциялар жүйедегі метал және лиганд концентрацияларына әсер етіп негізгі процесінің жүру жағдайын өзгертеді. Қосымша реакцияларды ескеру үшін шартты тұрақтылық константаларын пайдалану керек
β`= [ML]/CM.CL = βo.αM. αL
αM. және αL – қосымша реакциялардың коэффициенттері.
9 дәріс
Комплексті иондарды түзу жэне ыдырату процестеріне түрлі жағдайлардың әсері
Комплекс түзілу процесіне түрлі жағдайлар әсер етеді:
- лигандтардың концентрациясы
- ерітіндінің рН
- ерітіндінің иондық күші және т.б.
Компоненттердің концентрацияларының әсері. Комплексті қосылыстардың түзілу процесі сатылап жүретіндіктен комплексті иондарының әр түрінің массалық үлесі тұрақтылық константаға және компоненттердің концентрациялярына тәуелді. Лигандтың концентрациясы неғұрлым жоғары болса, координациялық саны жоғары комплексті иондардың үлесі соғұрлым жоғары болады (MLn).
Ерітіндінің рН әсері. Лиганд ролін күшті қышқылдардың қалдықтары атқаратын болса, онда рн комплекс түзілу процесіне көп әсер етпейді, себебі күшті қышқылдар толық ионданады да бөгде реакцияларға қатыспайды. Мысалы,  комплекстердің түзілуіне рН айтарлықтай әсер етпейді. Сутегі ионының концентрациясының жоғарлауы тек иондық күшінің мәнін өзгертеді.
комплекстердің түзілуіне рН айтарлықтай әсер етпейді. Сутегі ионының концентрациясының жоғарлауы тек иондық күшінің мәнін өзгертеді.
Ал егер лиганд әлсіз кышқылдың қалдығы болса, ерітіндінің рН лигандтың иондану дәрежесіне әсер етеді. Бұндай жағдайда қосымша жүретін реакцияларды ескеру керек: 

Неғұрлым сутек иондараның концентрациясы жоғары болса, тепе-теңдік солға қарай ығысады да, комплексті қосылыстардың бұзылуына әкеледі:

Ерітіндінің иондық күшінің әсері. Иондық күштің өзгеруі иондардың активтік коэффициенттерін өзгертеді де, комплекс түзілу тепе-теңдігіне әсер етеді.
Комплексті қосылысты толық ыдырату үшін:
- комплекс түзуші ионның комплекс түзуге деген қабілетін жою керек
- комплексті қосылыстың диссоциациялануын арттыру қажет.
Мысалы, комплекс түзу қабілетін жою үшін орталық ионның тотығу дәрежесін өзгертуге болады тотықтырғышпен әрекет етіп.
Диссоциациялану процесін арттыру үшін лиганд концентрациясын төмендетуге болады. Ол үшін:
1) ерітіндіні сұйылтады
2) нәтижесінде нашар ерітін немесе нашар диссоциацияланатын зат түзілетіндей реакция жүргізеді

3) ерітіндінің қышқылдығын арттырады

Қышқыл әрекетінен аммоний катиондары түзіледі де, тепе-теңдік оңға қарай ығысады, нәтижесінде комплексті қосылыс ыдырайды.
10 дәріс
Тотығу-тотықсыздану тепе-теңдігі
Тотығу-тотықсыздану реакциялары – электрондар бір заттардан екіншісіне ауысуымен байланысты жүретін реакциялар. Сонда, электрондардың донорлары – тотықсыздандырғыштар, ал электрондарды қосып алатын бөлшектер – тотықтырғыштар болып табылады. Тотығу-тотықсыздану реакцияларында тотықсыздандырғыштар берген электрондар саны мен тотықтырғыштар қосып алған электрондар санына тең болу керек.
Тотығу-тотықсыздану реакцияны жартылай тотығу және жартылай тотықсыздану реакцияларға бөлуге болады. Жартылай реакцияға қатысатын заттар тотығу-тотықсыздану жұбын құрайды. Мысалы:


Тотығу-тотықсыздану реакция тотықтырғыш пен тотықсыздандырғышты бір-бірінен бөлгенде де жүре алады, егер екі жүйені электрондар ауысатын өткізгіш сымымен, ал ерітінділерді иондар ауысатын тұз ерітіндісінен жасалған көпіршемен жалғастырса. Бұндай екі жартылай тотығу-тотықсыздану жұптарынан тұратын жүйе гальваникалық элемент деп аталады, оны сызба нұсқа түрінде көрсетуге болады:

Сызба нұсқада екі жартылай элемент екі вертикалды сызықпен бөлінеді, ал тотығу-тотықсыздану жұбы – бір сызықпен. Вольтметр осындай гальваникалық элементтің электр қозғауыш күшін көрсетеді
Э.Қ.К. = ЕOx – ERed
Тепе-теңдік потенциалдың заттар табиғатына, олардың концентрацияларына және температураға тәуелділігі Нернст теңдігімен өрнектеледі:
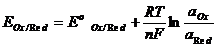
EOx/Red –тотығу-тотықсыздану жұбының реалды потенциалы, В
EoOx/Red – жұптың стандартты тотығу-тотықсыздану потенциалы,В
R – универсалды газ тұрақтысы (8,314 Дж/град.моль)
F - Фарадей саны (96500 Кл)
Т – температура, К
n – тотығу-тотықсыздану жартылай реакциясына қатысқан электрондар саны
а –активті концентрация.
Тотықтырғыш пен тотықсыздандырғыш активтіктері 1-ге тең болғандағы жартылай реакцияның тотығу-тотықсыздану потенциалы стандартты потенциал деп аталады

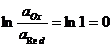 сонда
сонда 
Нернст теңдеуіндегі тұрақты шамалардың мәндерін қойып және натуралды логарифмді ондық логарифмге ауыстырсақ, онда 250 С үшін бұл теңдік келесі түрде жазылады

Сұйытылған ерітінділер үшін активтіктердің орнына тепе-теңдік концентрацияларды қолдануға болады

Электродтық потенциалды өлшеу үшін жұмысшы және салыстырмалы электродтар қажет. Салыстырмалы электродтарға потенциалдары белгілі жағдайларда тұрақты болатын электродтар жатады (сутекті, хлорид-күмісті, меркур-иодидты, каломельді).
Тотығу-тотықсыздану реакциялардың бағытын анықтау
Тотығу-тотықсыздану реакциялардің бағытын электр қозғауыш күшінен және тепе-теңдік константасынан анықтауға болады. Егер ЭҚК ˃0 болса, реакция тура бағытты жүреді, ал егер ЭҚК ˂0 – кері реакция жүреді.
Мысалы,



Мыс ионы – тотықтырғыш, темір – тотықсыздандырғыш.
Э.Қ.К. = EOx- ERed= 0.34 – (-0.44) = 0.78 B ˃0
Тотығу-тотықсыздану реакциясында тепе-теңдік орналғанда екі жұптың потенциал шамалары теңеседі

 тепе-теңдік жағдайда
тепе-теңдік жағдайда
Мұнда n – толық тотығу-тотықсыздану реакцияға қатысатын жалпы электрон саны.

Электр қозғауыш күшінен тек реакцияның бағытын анықтауға болса, ал тепе-теңдік константаның шамасы тотығу-тотықсыздану реакцияның бағытын және тереңдігін көрсетеді:
Кт-т0 ˃1 – реакция тура бағытта жүреді
Кт-т0 ≥ 108 – реакция аяғына дейін жүреді
Мысалы:

Сондықтан реакция аяғына дейін оң жаққа қарай жүреді. 
11 дәріс
Тотығу-тотықсыздану потенциалға әртүрлі
жағдайлардың әсері
1. Тотығу-тотықсыздану потенциалға тотықтырғыш және тотықсыздандырғыш иондарының концентрациялар әсер етеді: Нернст теңдеуінен потенциал [Ox]/]Red] қатынасына тәуелді екендігі көрінеді
Мысалы: 
2.Ерітіндінің иондық күшінің әсері.
Иондық күштің өзгеруі иондардың активтік коэффициентін өзгертеді. Сондықтан Нернст теңдеуіне стандарт потенциалы орнына формалды потенциал шамасы койылады. Мысалы:

Е01 – формалды потенциал, ол иондық күшкежәне бөгде электролиттер концентрацияларына тәуелді.
3.Потенциалға ерітіндінің рН әсері.
1) Көптеген су ортасында өтетін тотығу-тотықсыздану реакцияларына сутек-иондары қатысады. Осындай жүйелердің потенциалдыры ерітіндінің рН-на тәуелді болады:

2) Ерітіндінің рН-нің өзгеруі жүйенің потенциалының өзгеруіне әкеледі, және рН мәніне сәйкес әртүрлі заттар түзілуіне себеп болады. Мысалы:
рН˂˂7 
рН=7 
pH˃7 
Ерітіндінің рН-ның өзгеруі тотығу-тотықсыздану реакцияның бағытын да өзгерте алады.
3) Потенциалға комплексті қосылыс түзілуінің әсері.
Тотығу-тотықсыздану жұбының компоненттері қосымша комплекстүзу реакциясына қатысуы потенциалға өте үлкен әсер етеді. Себебі, жүйеде комплекс түзетін заттың активтігі азаяды. Мысалы,

Осы жүйеге KCN ерітіндісін қосқан кезде, күміс иондары цианидты комплекс түзеді:


Осыдан бос күміс иондарының концентрациясы азайғанын көруге болады. Осы шаманы Нернст теңдеуіне қойып, келесі тәуелділікті аламыз


Егер [Ag(CN)2-] =[CN-] = 1 болса 

4) Алдында қарастырылған Ag+/Ag жұбына NaCl ерітіндісі қосылатын болса, онда

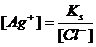
Cол себептен күміс иондарының концентрациясы кемиді, және осы шаманы Нернст теңдеуіне қойсақ, потенциалдың өзгеретінің көруге болады:

 12 дәріс
12 дәріс
Гетерогенді тепе-теңдік. Ерігіштік константасы
Бірнеше фазалардан тұратын жүйелерде жүретін химиялық реакцияларды гетерогенді деп атайды. Фазалар бір-бірінен беттік шекарамен бөлінеді. Мысалы, тұнбаның түзілуімен оның еруі заттың бір фазадан екінші фазаға ауысуымен сипатталанып, гетерогенді жүйелердің заңдылықтарына бағынады.
Нашар еритін қатты зат аз да болса судың дипольдерінің әсерінен ерітіндіге ауыса бастайды, және керісінше, иондар тартылыс күштерінің салдарынан тұнбаға түседі. 

Ерітінді қаныққанша еру процессінің жылдамдығы тұну процессінің жылдамдығынан жоғары болады, уақыт өткен сайын ол белгілі шамаға дейін төмендейді. Оның шамасы фазалар арасындағы тепе-теңдік константасымен сипатталады

Қатты заттардың активтілігі тұрақты шама болғандықтан

Кs0 – термодинамикалық ерігіштік константасы деп аталады ( немесе «ерігіштік көбейтіндісі»). Бұл теңдеуді тұнба еру және тұнба түзілу процесстерінің жылдамдықтары арқылы да шығару болады.
Сонымен, нашар еритін күшті электролиттердің қаныққан ерітіндісіндегі иондардың активті концентрацияларының көбейтіндісі белгілі температура мен қысымда тұрақты шама болып табылады. Бұдан келесі қорытынды жасауға болады: нашар еритін күшті электролиттердің қаныққан ерітіндісіндегі жеке иондардың концентрациялары қаншалықты өзгергенімен, олардың көбейтінділерінің шамалары тұрақты болады.
Ерігіштік константасы тұнба түзілу немесе еру жағдайын сипаттайды:
- егер ерітіндіде иондардың көбейтіндісі (ИК) ерігіштік константасынан төмен болса ИК˂Кs0 жүйе қанықпаған болады да тұнба түзілмейді;
- егер ерітіндіде иондардың көбейтіндісі ерігіштік константасынан жоғары болса ИК˃Кs0 , жүйе аса қаныққан болады да тұнба түзіледі. Тұнба түзілу процесі концентрациялар азайып тепе-теңдік орналғанша жүреді.
- егер жүйеде иондардың көбейтіндісі ерігіштік константасына тең болса
ИК=Кs0 , ерітінді қаныққан болады, жүйеде динамикалық тепе-теңдік орын алады.
Ерігіштік константасын тепе-теңдік концентрациясы арқылы төмендегідей өрнектейді
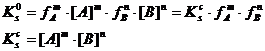
Бұл концентрациялық ерігіштік константасы, ол температураға, қысымға және иондық күшке тәуелді:

Өте нашар еритін электролиттерде ерітіндінің иондық күші I→0, f→1, сондықтан  . Электролиттің ерігіштігі жоғары болса, немесе қатты фаза бөгде күшті электролит ерітіндісінде ерітілсе I≠0, f˂1. Бұндай жағдайда
. Электролиттің ерігіштігі жоғары болса, немесе қатты фаза бөгде күшті электролит ерітіндісінде ерітілсе I≠0, f˂1. Бұндай жағдайда
 .
.
Нашар еритін қосылыстардың ерігіштігі
Химиялық қосылыстардың ерігіштігі нашар еритін заттың қаныққан ерітіндісіндегі катионның немесе анионның концентрациясымен анықталады. Ерігіштікті есептеуге ерігіштік константасы мүмкіндік береді.
Мысалы: АВ – нашар еритін бинарлы қосылыс. АВ қосылыстың қаныққан ерітіндісінде А және В иондарының бірдей мөлшерлері түзілетіндігін көруге болады АВ ↔А + В
Егер қосылыстың ерігіштігін SAB моль/л деп белгілесек, онда [A] = SAB моль/л және [B] =SAB моль/л . Бинарлы қосылыстың ерігіштік константасы

Осыдан ерігіштік 
Жалпы түрде AmBn қосылыс үшін



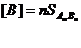


13 дәріс
Тұнба түзілу процесіне әсер ететін жағдайлар
Неғұрлым тұндырылатын қосылыстың ерігіштігі төмен болса, соғұрлым тұну процесі толық жүреді. Химиялық анализде тұндырылатын компоненттің ерітіндіде қалған мөлшері 10-6 моль/л –ден төмен болса, оны толық тұнбаға түсті деп есептейді.
Тұнба түзілу процесіне ерітіндінің иондық күші, аттас иондар қосылуы, еріткіштің табиғаты, температура әсер тигізеді.
1). Иондық күштің әсері.
Ерітіндідегі бөгде электролиттер нашар еритін қосылыстардың ерігіштігін жоғарлатады, бұл құбылыс «тұз эффектісі» деп аталады. Ерітіндінің иондық күші нашар еритін қосылыстың иондарының активтік коэффициенттерін төмендетеді, соның нәтижесінде Кsc мәні өзгереді де тұнба ерігіштігі жоғарлайды.
2). Аттас иондардың әсері.
Тұндырғыштың артық мөлшері тұнатын компоненттердің иондық көбейтіндісінің (ИК) шамасын жоғарлатып, тұнбаның толық тұнуына ықтимал етеді. АВ нашар еритін қосылыс
АВ ↔А + В
Егер қосылыстың ерігіштігін SAB моль/л деп белгілесек, онда [A] = SAB моль/л және [B] =SAB моль/л . Қосылған аттас ионның концентрациясын С(Вқос.) белгілесек. Сонда
Кs=S.(S+C(Bқос)
Жақшаның ішіндегі S шамасы қосылған аттас ионның концентрациясынан көп кіші болғандықтан оны ескермеуге болады
Кs=S.C(Bқос)
Ал ерігіштік келесі теңдеуден анықталады 
Бұл есептеулерден аттас иондар қатысында нашар еритін қосылыстардың ерігіштігі төмендейтіні көрінеді.
Тұнбаларды еріту шарттары
Тұнбаларды еріту үшін оларды құрайтын иондардың концентрацияларының көбейтіндісі тұнбаның ерігіштік константасынан төмен болатын жағдайға әкелу керек . Ол үшің:
- ерітіндіні сұйылтады
- тұнба түзетін иондарды нашар ионданатын, бірақ суда жақсы еритін қосылыстарға айналдырады
- қосылысты газ бөле ыдыратады
- суда жаксы еритін комплекске айналдырады
- тұнбаны тотығу-тотықсыздану реакция нәтижесінде жақсы еритін қосылысқа айналдырады.
Нашар еритін марганец сульфидінің күшті қышқылда еруін қарастырайық

Реакция нәтижесінде нашар диссоциацияланатын күкіртсутек қышқылы түзіледі де газ түрінде ұшып кетеді. Бұл жүйенің тепе-теңдік константасы төмендегі теңдіктеп анықталады:
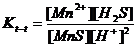
Осы теңдікті [S2-] концентрациясына көбейтіп және бөлсек , белгілі константалар арқылы өрнектеуге болады:

Тепе-теңдік константаның шамасынан еру процесі туралы қорытынды жасауға болады:
Кт-т˃1 - тура реакция жүреді яғни тұнба ериді
Кт-т˂1 - кері реакция басыь яғни тұнба ерімейді
Кт-т =1 – 10-4 - тұнба еріткіштің артық мөлшерінде ғана жүреді
Кт-т ˂1.10-4 - бұл тұнба осы еріткіште ерімейді
Бірақ жүйеде көптеген қосарлана жүретін реакциялар болуы мүмкін, сондықтан олар да қосылыстың ерігіштігіне үлесін қосады. Мысал ретінде MnCO3 тұнбасының рН 5 тең ерітіндімен тепе-теңдік күйдегі ерігіштігін есептейік. Бұл жағдайда жүйеде келесі тепе-теңдіктер орын алады:

Тепе-теңдік ерігіштік константасымен сипатталады

Негізгі реакциямен қатар жүйеде мына қосарлана жүретін реакциялар байқалады


Жүйедегі ерігіштік СО32- жалпы концентрациясына тең, ал ол төмендегі теңдікпен анықталады
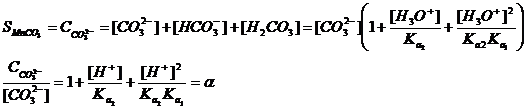
α – CO32- иондардың мольдік үлесі немесе жанама әсерлесу коэффициенті


Сонда ерігіштік константа теңдігіне осы шаманы қойса, онда

Неғұрлым қосылыстың ерігіштігі жоғары болса, қосарлана жүретін реакциялардың әсері соғұрлым жоғары болады.
Комплекстүзу реакциялардың ерігіштікке әсері.
Комплекс түзетін лигандтар қатысында көптеген нашар еритін қосылыстардың ерігіштігі өзгереді. Жалпы түрде нашар еритін қосылыстың лигандпен әрекеттесуін төмендегі тепе-теңдікпен сипаттауға болады:

Егер осы теңдікті метал-иондарының концентрациясына көбейтіп және бөлсе, келесі теңдікті алуға болады

Сондықтан, тұнбаның еруі оның ерігіштік константасы мен түзілетін комплекстің тұрақтылық константасына тәуелді. Мысал ретінде күміс хлоридінің аммиак ерітіндісінің артық мөлшерінде еруін келтіруге болады.
Тотығу-тотықсыздану реакцияларды тұнбаларды еріту үшін қолдану.
Көптеген нашар еритін қосылыстар қышқылдар мен сітілерде ерімейді. Оларды еріту үшін тотықтырғыш қасиеті бар қышқылды немесе басқа да тотықтырғышты қолданады. Мысалы:

14 дәріс
Сандық анализ. Гравиметрлік әдіс
Сандық анализдің мақсаты – зерттелінетін заттар құрамына кіретін элементтердің, иондардың немесе химиялық қосылыстардың сандық мөлшерін анықтау.
Сандық талдау әдістері химиялық, физика-химиялық және физикалық деп бөлінеді.
Химиялық анализ әдістері (классикалық әдістер) химиялық реакцияларды пайдалануға негізделген (қышқылды-негіздік, тотығу-тотықсыздану, комплекстүзу, тұндыру). Оларға гравиметрлік және титриметрлік әдістер жатады.
Гравиметрлік әдіс дегеніміз анықталынатын заттың құрамы тұрақты қатты фаза күйінде бөліп, массасын дәл өлшеуге негізделген сандық анализдің бір түрі. Гравиметрлік талдаудың аналитикалық сигналы – масса.
Титриметрлік әдіс әрекеттесетін заттардың ерітінділерінің көлемдерін дәл өлшеуге негізделген. Сондықтан титриметрлік әдісті көлемдік әдіс деп атайды. Классикалық әдістерге кинетикалық және билхимиялық әдістерді де жатқызады. Мұнда аналитикалық сигнал ретінде реакция жылдамдығын қарастырады.
Физика-химиялық әдістер химиялық реакциялар жүру кезінде байқалатын физикалық шамаларды өлшеуге негізделген. Олар бірнеше топқа бөлінеді:
- оптикалық әдістер (фотометрлік, СФ, люмин., ИК, ААС).
- электрохимиялық әдістер (потенциометрлік, ионометрлік, вольтметрлік, хроматографиялық, кулонометрлік т.б. әдістер)
Физикалық әдістерде анықталатын заттың концентрациясымен байланысты физикалық шамалар өлшенеді (спектрлік, рентген-фазалық).
Химиялық анализдердің ішінде гравиметрлік әдіс ең дәл тәсілдердің біріне жатады: оның дұрыстығы – 0,1-0,2%, ал анықтау шегі 0,1%.
Гравиметрлік әдісте алмасу, орын басу, ыдырау, комплекс түзу реакциялары пайдаланады және бұл әдіс келесі химия заңдарына негізделеді:
1. құрам тұрақтылық заңына
2. химиялық эквивалент заңына
3. масса сақталу заңына
Гравиметрлік әдісті орындалу тәсіліне байланысты үш топқа бөлуге болады:
- бөлу тәсілі
- айдау тәсілі
- тұндыру тәсілі
Бөлу тәсілінде анықталатын компонент зерттелетін үлгіден бос күйінде бөлінеді де, аналитикалық таразыда өлшенеді.
Айдау тәсілінде анықталатын компонент ұшқыш қосылыс күйінде бөлінеді. Оны каз күйінде бөлу үшін қажетті реагент қосылады, немесе үлгі жоғары температурада қыздырылады.
Тұндыру тәсілінде анықталатын компонент суда нашар еритін, құрамы тұрақты қосылыс күйінде тұндырылады.
Гравиметрлік анықтаудың дәлдігі жоғары болу үшін ірі кристалдық, ерігіштігі төмен, өзі таза, жақсы сүзілетін тұнба алынуы қажет.
Тұнбаның қасиеті көбінесе тұнбаның пайда болу механизмінің екі сатысымен анықталады. Ол: 1. кристалдану орталықтар пайда болуы
2. пайда болған орталықтардың өсуі
Жаңа пайда болған бөлшектердің мөлшері осы екі сатының қайсысы басым болатына байланысты. Егер тұну бірінші жолмен жүрсе, тұнба өте ұсақ бөлшектерден тұрады; егер екінші жол басым болса – ірі кристалды тұнба алынады. Сапалық түрде қандай тұнба түзілетіні көрсететін Веймарн ұсынған салыстырмалы асақанығу деген ұғым (СА)пайдаланылады.

Бұл ереже бойынша тұнба түзілу барысында тұнба бөлшектерінің шамасы мен салыстырмалы аса қанығу арасында кері пропорционалдық байқалады:
СА – салыстырмалы аса қанығу;
S – тепе-теңдік күйдегі тұнбаның ерігіштігі, моль/л
G – тұнба түзетін ерітінділерді бір-біріне қосқанда ерітінділердің бастапқы мольдік концентрациясы.
Кристалдану орталықтарының түзілу жылдамдығы мен I-ші және II-ші механизмдердідің жылдамдықтары мен салыстырмалы аса қанығудың арасындағы тәуелділік экспоненциалдық заңдылыққа бағынады.
Ал кристалдық орталықтарының өсу жылдамдығы мен аса қанығудың арасындағы тәуелділік тура сызықты.
Кристалдық тұнбаларды алу үшін тұндыруды жоғары температурада (S↑), сұйытылған ерітіндіден (G↓) жүргізеді. Және тұндырғышты тамшылатып, араластыра отырып қосады (G↓). Керісінше жағдайда амарфты тұнба түзіледі.
Кристалдық және аморфты тұнбалар түзілу жағдайлары.
1. сұйытылған ерітінділерге тұндырғыштың сұйытылған ерітіндісін қосу керек.
2. тұндырғышты баяу, тамшылатып қосады.
3. ерітіндіні шыны таяқшамен үнемі араластырыптұру қажет (тамызған жерде СА азайту үшін).
4. тұндыруды ыстық ерітінділерден ыстық тұндырғышпен жүргізеді. Жоғары температурада ұсақ кристалдар ериді де, ірі кристалдық тұнба түзілуіне мүмкіндік туады.
5. ерігіштікті жоғарылататын жағдай жасау (рН, комплекс түзуші реагент).
6. тұндырғышты 1,5-2 есе артық мөлшерде қосады.
7. тұнбаны жетілдіру үшін оны тұндырылған ыдыста 24 сағатқа қалдырады (қайта кристалдану).
Амофты тұнбалар түзілу жағдайлары:
1. тұндыруды концентрлі реагенттермен жүргізеді. Бұл кезде адсорбция төмендейді.
2. тұндыруды жоғары температурада жүргізеді.
3. ерітіндіні үнемі араластырып тұру қажет
4. коагулятор (электролит) қатысында жүргізеді.
5. тұндырғыш қосып болған соң, тұнба мен ерітіндіге (100 мл) ыстық су қосып, араластырып, бірден сүзіп алады (тұнбаны ерітіндімен бірге ұзақ уақытқа қалдыруға болмайды).
Коллоидты бөлшектердің бір-бірімен қосылмай ерітіндіде жүруінің бір себебі – бөлшектердің аттас электрлік зарядпен зарядталғандығында. Бөлшектер бір-бірімен тебіседі де ірі агрегаттар түзбейді.
Зарядталудың себебі мысалы сульфидтердің кристалдық орталықтары ерітіндіден катиондарды немесе аниондарды адсорбциялайды:
{[As2S3]m·n HS-·(n-x)H+}x-
крист.орта
зарядталған бөлшек
{[AgJ]m·nAg+·(n-x)NO3-}x+
зарядталған бөлшек
Коллоидты ерітінділердегі бөлшектерді ірілету – коагуляция деп аталады.
Тағы бір клагуляцияның әдісі – күшті электролиттердің концентрациясын арттыру. Бұл жағдайда коллоидты бөлшектердің зарядтары кеміді, сондықтан олардың бір-бірімен қосылу қабілеттігі өседі.
Коагуляцияланған тұнба аморфты тұнба деп аталады. Бұл тұнба ұсақ бөлшектерден тұратындықтан, оның беттік қабаты үлкен болады. Ал беттік ауданы үлкен бөлшектер бөгде иондарды адсобциялап, оңай ластанады.
Тұнба түзілу нәтижесінде тұнбаның құрамында бөгде қосылыстар болуы мүмкін. Қосарлана тұнбаға түсу процестерінің табиғаты әр түрлі болуы мүмкін, олардың ең негізгілері:
1. иондардың беттік адсобциясы
2. окклюзия
3. изоморфты қосылыстар түзу
4. кейіннен тұнбаға түсу
Тұнба бетінде бөгде иондардың (молекулалардың) концентрленуі (адсорбция) 4 негізгі жағдайға тәуелді:
1. Панет-Фаянс-Ган заңы.
Егер ерітіндідегі барлық иондардың концентрациялары бірдей болғанда, кристалдық торға тұнбаның құрамына кіретін бір ионымен нашар еритін қосылыс түзетін ион бірінші адсорбцияланады.
2. Адсорбция концентрацияға тәуелді. Тұнбаның үстіндегі ерітіндіде қандай ионның концентрациясы жоғары, сол ионның адсорбциясы басым болады, сонымен қатар, кез келген ионның адсобциялануы оның концентрациясына тура пропорционал.
3. Адсорбция зарядқа тәуелді, себебі ерітіндідегі иондар заряды мен криста бетінде орналасқан орталықтар арасындағы электростатикалық тартылыс күштірек болады.
4. Адсорбцияланатын ионның шамасына иондық радиусы әсер етеді. Тұнба түзуші ионмен иондық радиустары ұқсас иондар тұнба бетінде жақсы адсобцияланады.
Тұнбаның ластануын болдырмау үшін мына шаралар қолданылады:
1. Тұндыруды сұйытылған ерітінділерде жүргізеді,бұл кезде бөгде компоненттердің концентрациясы негізгі компоненттің концентрациясынан салыстырмалы төмен болады.
2. Ірі кристалдық тұнба алынатын шарттарды қолдану.
3. Ерітіндідегі барлық компоненттердің ерігіштігін жоғарлату үшін, және коллоидты ерітінділедің түзілуін болдырмау үшін тұндыруды ыстық ерітінділермен орындау қажет.
4. тұнба бетінде жақсы адсорбцияланатын жоғары зарядты иондарды төмен зарядты иондарға ауыстыру.
5. тұндырғышты дұрыс таңдау керек, яғни тұнбамыз бөгде компоненттермен нашар еритін қосылыс түзбеу қажет.
15 дәріс
Тұнбаның ластануы.
Окклюзия дегеніміз тұнба түзілу кезінде бөгде иондарды бірге ала кету. Кристалдық тордың ішінде адсобцияланған қоспалар болуы мүмкін (ішкі адсобция), екіншіден тор қуыстарында ерітінді қалып қалу (инклюзия).
Ерітінділерді қосу ретіне байланысты окклюзияның әсерін азайтуға болады:
1. Ba2+ + H2SO4 → BaSO4 · Ba2+/Cl- (барий хлориді окклюзияға ұшырайды, ол өте ауыр, қателік жоғары)
2. H2SO4 + Ba2+ → BaSO4 · SO4-/H+ (күкірт қышқылы окклюзиясы, қателік азаяды)
Изоморфты кристалдану (қатты ерітінділер).
Кристалдық тордың түйіндерінде негізгі тұнбаның иондары басқа иондармен алмасады:
1. иондық радиустары жақын иондар
2. зарядтары бірдей
3. кристалл пішіндері бірдей
Кейіннен тұнбаға түсу.
Тұндыру және тұндырылған түрге қойылатын талаптар.
гравиметрлік әдісте тұнбаны массасы тұрақты болғанша кептіреді, не күйдіреді, сонда тұнбаның түрі өзгеруі мүмкін. Тұнбаларды тұндырылған және гравиметрлік деп бөледі.
Тұндырылған түрге келесі талаптар қойылады:
1. тұнба суда нашар еритін болуы тиіс әне анықталатын компонент саедық жағынан толық тұнбаға түсуі қажет (ерігіштікке әсер ететін жағдайлар – рН, органикалық еріткіштер, артық мөлшері).
2. тұнбаның құрамы кептірілгеннен кейін белгілі формуласына сәйкес болуы тиісті.
3. түзілген тұнба химиялық таза болып ерітіндіден бөлінуі тиіс.
4. тұндырылған түрі гравиметрлік түріне оңай ауысуы керек.
Гравиметрлік түрге қойылатын талаптар:
1. тұнбаның өлшенетін құрамы, оның химиялық формуоасына дәл сәйкес келуі тиісті, себебі тек осы жағдайда заттың массасын өлшеп, оның құрамындағы анықталынатын компоненттің мөлшерін анықтауға болады.
2. гравиметрлі түрінің химиялық құрамы тұрақты болуы тиіс. Ол салыстырмалы төмен температурада (400-5000С) алынуы тиіс және одан жоғары температурада (700-8000С) өзгермеуі керек. Сонымен қатар ауадағы сумен, көмірқышқыл газбен т.б. әрекеттеспеуі қажет.
3. гравиметрлік түрдің салыстырмалы мольдік массасы жоғары, ал анықталынатын компоненттің үлесі төмен болғаны қажет, себебі сол кезде анализ мәліметтерінде өлшеу қатесі төмен болады.
Сонымен анықталынатын заттың F неғұрлым төмен болса, анализ қателігі соғұрлым төмен.
Дата добавления: 2018-02-18; просмотров: 8572; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
