Расчетные формулы для решения задач.
Нижний концентрационный предел воспламенения φн определяют по предельной теплоте сгорание. Установлено, что 1м3 газо-воздушной смеси на НКПВ выделяет при горении приблизительно постоянно количество тепла-1830кДж, называемое предельной теплотой горения. Следовательно,
φн = 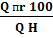 (3.1)
(3.1)
где Q пr-предельная теплота сгорания 1830 кДж/м3;
Q н-низшая теплота сгорания горючего вещества, кДж/м3.
Нижний и верхний КПВ могут быть определены по аппроксимационной формуле:
φн (в)= 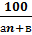 (3.2.)
(3.2.)
Где 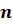 –стехиометрический коэффициент при кислороде в уравнении химической реакции;
–стехиометрический коэффициент при кислороде в уравнении химической реакции;
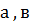 -эмпирические константы, значение которых приведены в табл.3.1.
-эмпирические константы, значение которых приведены в табл.3.1.
Таблица 3.1.
| Концентрационные пределы воспламенения | Значение коэффициентов | |
| а | в | |
| Нижний предел | 8,684 | 4,679 |
| Верхний предел | ||
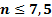
| 1,550 | 0,560 |
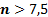
| 0,765 | 6,554 |
Концентрационные пределы воспламенения паров жидких и твердых веществ могут быть рассчитаны, если известны температурные пределы:
φн (в)= 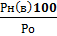 ; (3.3.),
; (3.3.),
где 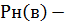 давление насыщенного пара вещества при температуре, соответствующей нижнему пределу воспламенения, Па (табл.4 приложения);
давление насыщенного пара вещества при температуре, соответствующей нижнему пределу воспламенения, Па (табл.4 приложения);
Ро- давление окружающей среды, Па.
Для расчета концентрационных пределов воспламенения смесей горючих газов используют правило Ле-Шателье:
|
|
|
φ смн (в)=1/ 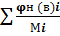 ; (3.4),
; (3.4),
где φ смн (в)-нижний (верхний) КПВ смеси газов, % об;
φ смн (в)-нижний (верхний) предел воспламенения i-го горючего газа .
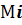 -мольная доля i-го горючего газа в смеси.
-мольная доля i-го горючего газа в смеси.
Следует иметь при этом в виду, что 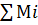 =1,т.е. концентрация горючих компонентов газовой смеси принимается за 100%.
=1,т.е. концентрация горючих компонентов газовой смеси принимается за 100%.
Если известны концентрационные пределы воспламенения при температуре Т1, то при температуре Т2они вычисляются по формуле:
φНТ2= 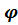 нТ1
нТ1 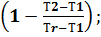 (3.5)
(3.5)
φВТ2= 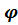 вТ1
вТ1 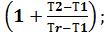 (3.6.)
(3.6.)
где φНТ2; 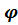 нТ1- нижний концентр. предел воспламенения соответственно при температруреТ1 и Т2;
нТ1- нижний концентр. предел воспламенения соответственно при температруреТ1 и Т2;
φВТ2= 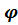 вТ1-верхний концентрационный предел воспламенения соответственно при температуре Т1 и Т2;
вТ1-верхний концентрационный предел воспламенения соответственно при температуре Т1 и Т2;
Тr -температура горения смеси. Приближенно при определении НКПВ Тr принимают 1550К, при определении НКПВ -1100К.
При разбавлении газо-воздушной смеси инертными газами ( N2,CO2, H2O) область воспламенения сужается: верхний предел уменьшается, а нижний – возрастает. Концентрация инертного газа(флегматизатора), при которой нижний и верхний пределы воспламенения смыкаются, называется минимальной флегматизирующей концентрацией φф. Содержание кислорода в такой системе называют минимальным взрывоопасным содержанием кислорода φО2 МВСК. Некоторое содержание кислорода ниже МВСК называют безопасным φО2без. Расчет указанных параметров проводят по формулам :
|
|
|
φф= h1f∆H0f+hф+ 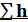 1i∙mi (3.7)
1i∙mi (3.7)
h2ф-1+ 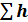 2i∙mi
2i∙mi
φO2=100-φФ/4,844 (3.8)
φO2без=1,2 φO2-4,2 (3.9),
где ∆Н0f- стандартная теплота образования горючего, кДж/моль;
h1f; h1ф h2ф-константы, зависящие от элемента в молекуле горючего и вида флегматизатора (Табл. 2 приложение);
mi-количество i-го элемента (структурной группы) в молекуле горючего
Примеры решения задач
Пример №1
По предельной теплоте сгорания определить нижний концентрационный предел воспламенения бутана в воздухе.
Решение: Для расчета по формуле (3.1.)в табл.3 приложения находим низшую теплоту сгорания вещества -2882,3кДж/моль. Эту величину надо перевести в другую размерность- кДж/м3:
|
|
|
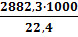 =128,7∙103 кДж/м3
=128,7∙103 кДж/м3
По формуле (3.1) определим НКПВ:
φН=  3=1,42%
3=1,42%
По таблице 4 приложения находим, что экспериментальное значение φН=1,9%.Относительная ошибка расчета, следовательно, составила:
∆н= 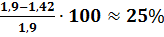
Пример №2
Определить концентрационные пределы воспламенения этилена в воздухе.
Решение: Расчет КПВ проводим по апроксимационной формуле. Определяем значение стехиометрического коэффициента при кислороде:
С2Н2+3О2=2СО2+2Н2О
Таким образом, n=3,тогда:
φн= 100/8,684∙3+4,679=3,25%;
φн=100/1,55∙3+0,56=19,23%.
Определим относительную ошибку расчета. По табл.4 приложения экспериментальные значения пределов равны 3,0+32,0:
∆н=3,25-3,0/3,0≈8%
∆в=19,23-32,0/32≈-40%
Следовательно, при расчете НКПВ этилена результат завышен на 8% , а при расчете ВКПВ - занижен на 40%.
Пример №3
Определить концентрационные пределы воспламенения насыщенных паров метанола в воздухе, если известно, что его температурные пределы равны 280+312К. Атмосферное давление - нормальное.
Решение: Для расчета по формуле (3.3) необходимо определить давление насыщенных паров, соответствующих нижнему (280К) и верхнему (312К) пределам воспламенения.
По табл. 7 приложения находим, что давление насыщенного пара на нижнем температурном пределе воспламенения находится между 53,3 и 79,99 ГПа. Так как ближайшие НТПВ по таблице равны 273 и 285,1 К , линейной интерполяцией находим давление, соответствующее нижнему температурному пределу (280К):
|
|
|
Рн=53,33+ 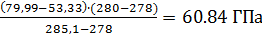
Давление насыщенного пара метанола, соответствующее верхнему пределу, находится между 266,64 и 533,29ГПа:
Рв=266,64+ 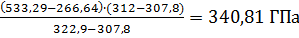
По формуле(3.3) определим НКПВ:
φн= 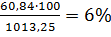
φв = 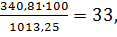
Экспериментальное значение КПВметанола-6,0+34,7% (табл. Приложения 5). Относительная ошибка расчета:
∆ н = 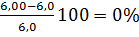
∆в = 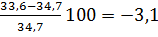
Следовательно, результаты расчета ВКПВ по известным значениям ТПВ занижены на 3 %. Это связано с ошибкой в определении давления насыщенного пара линейной интерполяцией.
Пример №4
Определить концентрационные пределы воспламенения газовой смеси, состоящей из 40% пропана,50% бутана,10%пропилена.
Решение: Для расчета КПВ смеси газов по правилу Ле-Шателье (3.4) необходимо определить КПВ индивидуальных горючих веществ, методы расчета которых рассмотрены выше:
С3Н8-2,1+9,5%; С3Н6-2,2+10,3%; С4Н10-1,9+9,1%
φСМН= 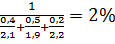 ;
;
φСМВ= 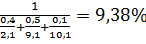
Пример № 5
Каково минимальное количество диэтилового эфира, кг, способное при испарении в емкости объемом 350 м2 .создать взрывоопасную концентрацию.
Решение: Концентрация будет взрывоопасной, если φпr=φн;φпr-концентрация паров горючего вещества.
Расчетом (см. пример 1+3) или по табл. 5 приложения находим НКПВ диэтилового эфира, необходимой для создания в объеме 350м3 этой концентрации:
Vпr= 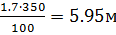 3
3
Таким образом, для создания НКПВ диэтилового эфира в объеме 350м3необходимо ввести 5,95 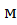 3 его паров. Принимая во внимание, что 1 кмоль(74кг) газа, пара, приведенный к нормальным условиям, занимает объем, равный 22,4
3 его паров. Принимая во внимание, что 1 кмоль(74кг) газа, пара, приведенный к нормальным условиям, занимает объем, равный 22,4 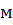 3, находим количество диэтилового эфира:
3, находим количество диэтилового эфира:
Рr= 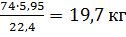
Пример №6
Определить возможно ли образование взрывоопасной концентрации в объеме 50м3при испарении 35кг гексана, если температура окружающей среды 300К.
Решение: Очевидно, паровоздушная смесь будет взрывоопасной, если φн 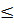 φпr
φпr 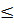 φв. При 300К объем паров гексана, образующийся в результате испарения 5 кг вещества, найдем объем, принимая во внимание, что при испарении 1 кмоля (86кг) гексана при 273К объем паровой фазы будет равен 22,4 м3:
φв. При 300К объем паров гексана, образующийся в результате испарения 5 кг вещества, найдем объем, принимая во внимание, что при испарении 1 кмоля (86кг) гексана при 273К объем паровой фазы будет равен 22,4 м3:
Vпr= 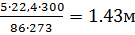 3
3
Следовательно, концентрация паров гексана в помещении объемом 50м3, будет равна:
φпr= 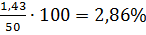
Определив концентрационные пределы воспламенения гексана в воздухе (1.2+7,5%), по таблицам или расчетом устанавливаем, что образующаяся смесь является взрывоопасной.
Пример №7
Определить, образуется ли взрывоопасная концентрация насыщенных паров над поверхностью резервуара , содержащего 60% диэтилового эфира и 40% этилового спирта, при температуре 245К?
Решение: концентрация паров будет взрывоопасной, если
φнсм≤ φнпсм≤ φвсм.
(φвсм-концентрация насыщенных паров смеси жидкостей). Очевидно, что в результате различной летучести веществ состав газовой фазы будет отличаться от конденсированной. Содержание компонентов в газовой фазе по известному составу жидкой определим по закону Рауля для идеальных растворов жидкостей.
1. Определим мольный состав жидкой фазы:
μi= 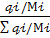 ;
;
где μi-мольная доля -того вещества, 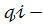 весовая доля 𝒾-того вещества,
весовая доля 𝒾-того вещества, 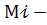 молекулярная масса 𝒾-того вещества (Мдэ=70, Мэс=46)
молекулярная масса 𝒾-того вещества (Мдэ=70, Мэс=46)
μД.З. (Ж)= 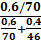 =0,496
=0,496
μЭ.С.(Ж) =1-0,496=0,504
2. По табл.7 приложения определим давление насыщенного пара при 245К над индивидуальными жидкостями:
Рнп(дэ) =53,34ГПа
Рнп(дэ) =1,33+ 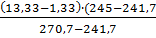 =15,00 ГПа
=15,00 ГПа
3. .По закону Рауля, парциальное давление насыщенных паров -той жидкости над смесью равно произведению насыщенного пара над чистой жидкостью на ее мольную долю в жидкой фазе, т.е.
Р пар(дэ)=53,34∙0,496=26,46ГПа;
Р пар(ас)=15.00∙0,504=7,56ГПа.
4. Приняв сумму давлений насыщенных паров диэтилового эфира и этилового спирта (26,46+7,56), равной 100%, определим:
концентрацию паров в воздухе:
φнпсм= 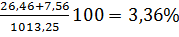
мольный состав газовой фазы(закон Рауля- Дуэртье)
μд.э(r)= 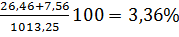
μэ.с(п)=1,00-0,781=0,222
5. Определив расчетом или по справочным данным (табл.5 приложения)КПВ индивидуальных веществ (диэтиловый эфир 1,7+49%,этиловый спирт 3,6+19%),по правилу Ле-Шателье рассчитаем КПВ паровой фазы:
φнсм= 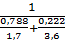 =1,93%;
=1,93%;
φвсм= 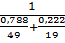 =36,28%
=36,28%
6. Сравнивая полученные в п.4а концентрацию паровоздушной смеси с КПВ, делаем заключение, что при 245К над данной жидкой фазой образуется взрывоопасная концентрация насыщенных паров в воздухе.
Пример №8
Рассчитать безопасную концентрацию кислорода при разбавлении углекислым газом смеси паров ацетона в воздухе.
Решение: По табл.3 приложения находим теплоту образования ацетона 248,1∙103Дж/моль. Из химической формулы ацетона (С3Н6О) следует, что mс=3, m n=6, m0=1.Значение остальных параметров выбираем из табл.2 для двуокиси углерода:
φф=100∙0,735∙105∙248,1∙103+0,584+1,292∙3+0,427∙6+0,570∙1 =48,1%
2,020-1+4,642∙3+1,160∙6-2,321∙1
φО2= 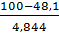 =10,7;
=10,7;
φО2 без=1,2∙10,7-4,2=8,6%.
Следовательно, при снижении концентрации кислорода в четырехкомпонентной системе, состоящей из паров ацетона, двуокиси углерода, азота и кислорода, до 8,6% смесь является взрывобезопасной. При содержании же кислорода, равном 10,7% эта смесь будет предельной по взрываемости. Согласно справочным данным (справочник « Пожарная опасность веществ и материалов, применяемых в химической промышленности».-М,:Химия,1979), МВСК ацетоно- воздушной смеси при разбавлении ее двуокисью углерода составляет14,9%. Определим относительную ошибку расчета:
∆= 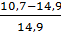 =-28%
=-28%
Таким образом, результаты расчета МВСК занижены на 28%
Контрольные задачи
1. По предельной теплоте сгорания определить, как изменяется нижний концентрационный предел воспламенения в воздухе от положения предельных углеводородов( этан, пропан, бутан, пентан, пропан, гексан) в гомологическом ряду. Построить график зависимости НКПВ от молекулярной массы горючего.
2. По аппроксимационной формуле рассчитать, как изменяются концентрационные пределы жирных спиртов (метиловый, этиловый, гексиловый, октиловый) в гомологическом ряду. Построить график зависимости нижнего и верхнего пределов воспламенения от молекулярной массы горючего.
3. Определить концентрационные пределы воспламенения сероуглерода при атмосферном давлении, равном 990ГПа, если его температурные пределы составляют 223+299К
4. Рассчитать концентрационные пределы воспламенения бензола, если температурные пределы равны 259+283К. Определить ошибку.
5. Определить концентрационные пределы воспламенения парогазовой смеси, состоящей из 20% этана, 60% этилена и 20% паров этилового спирта.
6. Определить концентрационные пределы воспламенения в воздухе смеси паров, состоящей из 50%бензола,35% толуола и 15% фенола, при увеличении температуры с 298 до 373К.
7. Определить , образуется ли взрывоопасная концентрация при испарении в помещении объемом 220м3 15кг деканола, если температура 310К, давление 1105ГПа?
8. Определить возможно ли образование взрывоопасной концентрации при температуре 298 К над поверхностью жидкой фазы, состоящей из 25% уксуснометилового эфира,40% уксусного ангидрида, 35% амилового спирта?
9. Определить состав двухкомпонентной газовой смеси, состоящей из паров аммиака и сероводорода, если известно, что ее нижний концентрационный предел воспламенения в воздухе составляет 5,8%.
10. Определить безопасную концентрацию кислорода при разбавлении паров уксуснопропилового эфира (∆Н0𝒾=513,7∙103Дж/моль)в воздухе двуокисью углерода, водяным паром и азотом. Объяснить причину различной флегматизирующей эффективности инертных газов.
Домашнее задание
Рассчитать концентрационные пределы воспламенения паров i-го вещества в воздухе. Результаты расчета сравнить с имеющимися справочными данными и определить относительную ошибку (табл. 3.2)
Таблица 3.2
Дата добавления: 2018-02-15; просмотров: 5644; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
