СЫРЬЁ ДЛЯ ПРОИЗВОДСТВА ИСКУССТВЕННОГО КАУЧУКА
ВСР#10
Метан, Methane
Рубрика:Статьи о газахКлючевые слова:метан,Methane,CH4: свойства метана,применение метана,производство метана,взрывоопасные газы,парниковый эффект
Часто этот взрывоопасный газ называют «болотным». Всем известен его специфический запах, но на самом деле это — специальные добавки «с запахом газа», которые добавляются для того, чтобы его распознать. При сгорании он практически не оставляет вредных продуктов. Помимо всего прочего, этот газ довольно активно участвует в образовании всем известного парникового эффекта.
Метан — газ, обычно связанный с живыми организмами. Когда в атмосферах Марса и Титана обнаружился метан, у ученых появилась надежда на то, что на этих планетах существует жизнь. На Красной планете метана немного, а вот Титан буквально «залит» им. И уж если не для Титана, то для Марса биологические источники метана столь же вероятны, как и геологические. Метана много на планетах-гигантах — Юпитере, Сатурне, Уране и Нептуне, где он возник как продукт химической переработки вещества протосолнечной туманности. На Земле он редок: его содержание в атмосфере нашей планеты — всего 1750 частей на миллиард по объему (ppbv).
Источники и получение метана
Метан — простейший углеводород, бесцветный газ без запаха. Его химическая формула — CH4. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты со специфическим «запахом газа». Основной компонент природных (77—99%), попутных нефтяных (31—90%), рудничного и болотного газов (отсюда другие названия метана — болотный или рудничный газ).
|
|
|
На 90–95% метан имеет биологическое происхождение. Травоядные копытные животные, такие как коровы и козы, испускают пятую часть годового выброса метана: его вырабатывают бактерии в их желудках. Другими важными источниками служат термиты, рис-сырец, болота, фильтрация естественного газа (это продукт прошлой жизни) и фотосинтез растений. Вулканы вносят в общий баланс метана на Земле менее 0,2%, но источником и этого газа могут быть организмы прошлых эпох. Промышленные выбросы метана незначительны. Таким образом, обнаружение метана на планете типа Земли указывает на наличие там жизни.
Метан образуется при термической переработке нефти и нефтепродуктов (10—57% по объёму), коксовании и гидрировании каменного угля (24—34%). Лабораторные способы получения: сплавление ацетата натрия со щелочью, действие воды на метилмагнийиодид или на карбид алюминия.
В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и калия) или безводного гидроксида натрия с уксусной кислотой. Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен.
|
|
|
Свойства метана
Метан горит в воздухе голубоватым пламенем, при этом выделяется энергия около 39 МДж на 1м3. С воздухом образует взрывоопасные смеси. Особую опасность представляет метан, выделяющийся при подземной разработке месторождений полезных ископаемых в горные выработки, а также на угольных обогатительных и брикетных фабриках, на сортировочных установках. Так, при содержании в воздухе до 5–6% метан горит около источника тепла (температура воспламенения 650—750 °С), от 5–6% до 14–16% взрывается, свыше 16% может гореть при притоке кислорода извне. Снижение при этом концентрации метана может привести к взрыву. Кроме того, значительное увеличение концентрации метана в воздухе бывает причиной удушья (например, концентрации метана 43% соответствует 12% O2).
Взрывное горение распространяется со скоростью 500—700 м/сек; давление газа при взрыве в замкнутом объёме равно 1 Мн/м2. После контакта с источником тепла воспламенение метана происходит с некоторым запаздыванием. На этом свойстве основано создание предохранительных взрывчатых веществ и взрывобезопасного электрооборудования. На объектах, опасных из-за присутствия метана (главным образом, угольные шахты), вводится т.н. газовый режим.
|
|
|
При 150-200 °С и давлении 30-90 атм метан окисляется до муравьиной кислоты.
Метан образует соединения включения — газовые гидраты, широко распространенные в природе.
Применение метана
Метан — наиболее термически устойчивый насыщенный углеводород. Его широко используют как бытовое и промышленное топливо и как сырьё для промышленности. Так, хлорированием метана производят метилхлорид, метиленхлорид, хлороформ, четырёххлористый углерод.
При неполном сгорании метана получают сажу, при каталитическом окислении — формальдегид, при взаимодействии с серой — сероуглерод.
Термоокислительный крекинг и электрокрекинг метана— важные промышленные методы получения ацетилена.
Каталитическое окисление смеси метана с аммиаком лежит в основе промышленного производства синильной кислоты.Метан используют как источник водорода в производстве аммиака, а также для получения водяного газа (т. н. синтез-газа): CH4 + H2O → CO + 3H2, применяемого для промышленного синтеза углеводородов, спиртов, альдегидов и др. Важное производное метана — нитрометан.
|
|
|
Автомобильное топливо
Метан широко используется в качестве моторного топлива для автомобилей. Однако плотность природного метана в тысячу раз ниже плотности бензина. Поэтому, если заправлять автомобиль метаном при атмосферном давлении, то для равного с бензином количества топлива понадобится бак в 1000 раз больше. Чтобы не возить огромный прицеп с топливом, необходимо увеличить плотность газа. Это можно достичь сжатием метана до 20–25 МПа (200–250 атмосфер). Для хранения газа в таком состоянии используются специальные баллоны, которые устанавливаются на автомобилях.
Метан и парниковый эффект
Метан является парниковым газом. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность метана составит 23 единицы. Содержание в атмосфере метана росло очень быстро на протяжении последних двух столетий.
Сейчас среднее содержание метана CH4 в современной атмосфере оценивается как 1,8 ppm (parts per million, частей на миллион). И, хотя это в 200 раз меньше, чем содержание в ней углекислого газа (CO2), в расчете на одну молекулу газа парниковый эффект от метана — то есть его вклад в рассеивание и удержание тепла, излучаемого нагретой солнцем Землей — существенно выше, чем от СО2. Кроме того, метан поглощает излучение Земли в тех «окошках» спектра, которые оказываются прозрачными для других парниковых газов. Без парниковых газов — СO2, паров воды, метана и некоторых других примесей средняя температура на поверхности Земли была бы всего –23°C , а сейчас она около +15°C.
Метан высачивается на дне океана через трещины земной коры, выделяется в немалом количестве при горных разработках и при сжигании лесов. Недавно обнаружен новый, совершенно неожиданный источник метана — высшие растения, но механизмы образования и значение данного процесса для самих растений пока не выяснены.
ВСР№11
ПРИРОДНЫЕ КАУЧУКОНОСЫ
Натуральный каучук получают коагуляцией млечного сока (латекса) каучуконосных растений. Основной компонент натурального каучука - углеводород полиизопрен (91%-96%).В зависимости от того, в каких тканях накапливается каучук, каучуконосные растения делят на:
а) латексные - каучук в млечном соке,
б) паренхимные - каучук в корнях и стеблях
в) хлоренхимные - каучук в листьях и зелёных тканях молодых побегов.
Промышленное значение имеют латексные деревья, которые не только накапливают каучук в большом количестве, но и легко его отдают; из них наиважнейшее - гевея бразильская, дающая 96% мирового производства каучука.
Травянистые латексные каучуконосные растения из семейства сложноцветных (кок - сагыз, крым -сагыз и другие) произрастающие в умеренной зоне, в том числе в южных республиках, содержащие каучук в небольшом количестве в корнях, промышленного значения не имеют.
Среди травянистых растений России есть всем знакомые одуванчик, полынь и молочай которые тоже содержат млечный сок.
Каучуконосы лучше всего произрастают не далее 10 градусов от экватора на север и на юг. Поэтому полоса шириной 1300 километров по обе стороны экватора известна как "каучуковый пояс".
Дело в том, что для каучуконосов требуется очень тёплый влажный климат и плодородная почва. Развитие автомобильной промышленности значительно повысило потребности в резине и, соответственно, в каучуке. Поэтому появились новые плантации гевей: молодые деревца из Южной Америки посадили в Малайзии, Цейлона и Индонезии. Они отлично прижились и дают большой урожай.
Латекс состоит из мельчайших частичек жидкости, твёрдых частиц и других примесей. Только около 33% латекса составляет каучук, 66% вода и около 1% другие вещества.
СЫРЬЁ ДЛЯ ПРОИЗВОДСТВА ИСКУССТВЕННОГО КАУЧУКА
Так как производство природного каучука, там, где не растут каучуконосы, невозможно, то велись работы по получению искусственного каучука. В результате многолетней работы академика С.В.Лебедева был разработан способ получения искусственного каучука. И в 1932 году было налажено промышленное производство каучука.
В разработке синтеза каучука С.В.Лебедев пошёл по пути подражания природе. Поскольку натуральный каучук - полимер диенового углеводорода, то С.В.Лебедев воспользовался также диеновым углеводородом, только более простым и доступным - бутадиеном. Сырьём для получения бутадиена служит этиловый спирт
С2Н5ОН: Н Н Н Н Н-С-С -С-С-Н = СН2=СН-СН=СН2 + 2Н2О + Н2
Синтетические каучуки, превосходя натуральный по отдельным показателям, уступали ему в одном свойстве - эластичности. Между тем это свойство является основополагающим при изготовлении таких изделий, как автомобильные и авиационные шины, испытывающие во время движения многократные деформации. Натуральный каучук - это изопреновый каучук. Поэтому перед учёными стояла задача получить изопреновый каучук. Синтез такого каучука был осуществлён. Но свойств натурального каучука в полной мере достичь не удавалось. Причину этого установили, когда изучили пространственное строение натурального каучука. Оказалось, что он имеет стереорегулярное строение, группы -СН2- в макромолекулах каучука расположены не беспорядочно, а по одну и ту же сторону двойной связи в каждом звене, то есть находятся в цис-положении Полимеризация бутадиена по способу С.В.Лебедева проводится в присутствии катализатора - металлического натрия. Получаемый по этому способу каучук обладает хорошей водо- и газонепроницаемостью. Для повышения прочности и эластичности он, как и натуральный каучук, подвергается вулканизации. Широкое использование бутадиенового каучука для производства разнообразных резиновых изделий сыграло большую роль в развитии мира. Теперь произошли серьёзные изменения в сырьевой базе производства каучука.
Со времён С.В.Лебедева сырьём для бутадиена служил этанол, а на его производство шли зерно и картофель. Интересы экономики требовали более доступных источников сырья. В настоящее время для синтеза каучука используются углеводороды, содержащиеся в нефтяных газах и в продуктах переработки нефти. Бутадиен образуется при дегидрировании бутана:
СН2-СН= СН-СН2 === СН2=СН-СН=СН2 + 2Н2
Изопрен может быть получен из изопентана (2 - метил бутана):
СН3-СН-СН2-СН3 === СН2.=С-СН=СН2 + 2H2 СН3 СН3
Если же ресурсы изопентана недостаточны, можно подвергнуть изомеризации н-пентан:
СН3-СН2-СН2-СН2-СН3 ==СН3-СН-СН2-СН3 СН3
ВСР№13
:Нефть – чудесный дар природы. Археологи установили, что ее добывали и использовали уже за 5-6 тысяч лет до нашей эры. Наиболее древние промыслы известны на берегах Ефрата, в Керчи, в китайской провинции Сычуань. Происхождение самого слова “нефть” следует искать в языках народов Малой Азии, “набата” – “просачиваться”.
Упоминание о нефти также встречается во многих древних рукописных книгах. В частности, уже в Библии говориться о смоляных ключах в окрестностях мертвого моря.
(Слайд)
НЕФТЬ:
Нефть – маслянистая жидкость от светло – бурого до почти черного цвета, с характерным запахом. Залегает в толще земной коры на разных глубинах. Она немного легче воды ( плотность равна 0,73 – 0,97 г/ см3) и практически в ней не растворяется.
Нефть представляет собой сложную смесь различных, в основном жидких углеводородов (алканов, циклоалканов и ароматических), в которых растворены твердые и газообразные углеводороды. Поэтому она не имеет почти постоянной температуры кипения. Состав нефти различается обычно от месторождения. Например, бакинская нефть богата циклоалканами, грозненская – предельными углеводородами. Кроме углеводородов нефть содержит органические соединения, включающие кислород, серу, азот.
Из нефти мы берем для нужд страны своей
Поток бензина, масел и мазута.
И к ним в придачу тысячу вещей
Для дома и домашнего уюта.
(Слайд)
ПРИРОДНЫЙ ГАЗ:
Разведанные запасы природного газообразного топлива на Земле велики, превышают 60 трлн м3, а прогнозируемые запасы оцениваются в 200 трлн м3.
Крупнейшие газовые месторождения в мире в Алжире, Иране, США, Нидерландах. В России – это Западная Сибирь, Республика Коми, Астраханская и Оренбургская области.
Природный газ является главным источником сырья для химической промышленности. Основной составной частью природного газа является метан (80–90 %). Кроме метана в природном газе присутствуют его гомологи – этан, пропан, бутан, а также неорганические примеси – углекислый газ, азот, инертные газы. Предельные углеводороды – газы не имеют ни цвета, ни запаха. Для облегчения обнаружения утечки газа к нему добавляют специальный ароматизатор.
Попутный нефтяной газ по происхождению тоже является природным. Свое название он получил потому, что находится в залежах вместе с нефтью – он растворен в ней и находится над нефтью, образуя газовую “шапку”. При извлечении нефти на поверхность, он отделяется от нее вследствие резкого падения давления. Возможности использования его значительно шире, чем природного, т. к. в нем кроме метана содержится значительное количество других углеводородов. Поэтому путем химической переработки из него можно получить больше веществ, чем из природного газа.
(Слайд)
КАМЕННЫЙ УГОЛЬ:
Каменный уголь – наиболее распространенный вид твердого топлива.
Каменный уголь – это сложная смесь высокомолекулярных соединений, в состав которых входят такие элементы: углерод, водород, азот, кислород, сера. Запасы каменного угля в природе значительно превосходят запасы нефти. В нашей стране находится половина всех мировых запасов угля. Каменный уголь находится в таких регионах: Подмосковный бассейн, Кузбасс, Сибирь, Канско – Ачиннский бассейн. При коксовании угля протекают физико – химические процессы, сопровождающиеся поглощением энергии. При нагревании угля без доступа воздуха до высоких температур происходит разложение высокомолекулярных соединений, при этом образуются летучие вещества и твердый остаток – кокс. Кокс содержит 96 – 98% углерода.
ВСР№14
1. Конечным продуктом в цепи превращений
1-бромбутан + NaOH спирт. —> Х1 + HВr —> Х2 + NaOH спирт. —> Х3 + KMnO4 —> Х4
является: А) бутандиол-1,2 Б) бутандиол-2,3 В) бутаналь Г) бутанол-1.
2.Конечным продуктом в цепи превращений
пропанол-1 + H2SO4, t 0 —> Х1 + Br2 —> Х2 + 2 NaOH спирт. —> Х3 + H2O, Hg2+ —> Х4 + H2, Ni —> Х5
является: А) пропан Б) пропанол-2 В) пропен Г) пропанол-1.
3. Осуществите превращения:
Ацетилен  X1
X1  X2
X2  X3
X3
Конечный продукт(X3)-это:
1)нитрометан; 2)нитробензол; 3)анилин; 4)тринитротолуол.
4.
KOH,спирт HBr KOH,(спирт)
Br –CH2 — CH — CH2 — CH3  X1
X1  X2
X2  X3
X3
!
CH3
Конечный продукт (Х3) в цепочке превращений — это:
1) пентен-2; 2) 2-метилбутен-2; 3) 2-метилбутен-1; 4) 2-метилпентен-2.
5.Вещество, структурная формула которого 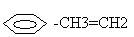 нельзя назвать:
нельзя назвать:
1) винилбензол; 2) бензилэтил; 3) стирол; 4) фенилэтилен.
6. Условия проведения реакции Кучерова — это:
1) Н2 (Ni); 2) С12 (hv); 3) Рt, 5 атм.; 4) НgSО4.
7.Формула метилциклобутана соответствует общей формуле:
1)CnH2n+2 2)CnH2n 3)CnH2n-2 4)CnH2nO
8. CH3CH2OH  X1
X1  X2
X2  X3
X3
Конечный продукт (Х3) в цепочке превращений — это:
1) ацетилен; 2) этан; 3) бутан; 4) 2-бутен.
9. Качественная реакция на непредельные углеводороды — это:
1) С2Н6 + С12  ; 3)СН2=СН-СН3 + Н2
; 3)СН2=СН-СН3 + Н2  ;
;
2) С2Н4 + Вг2  ; 4) С2Н2 + Аg2О
; 4) С2Н2 + Аg2О  .
.
10. КОН спирт
В схеме 2,3-Дихлорбутан  Вещество А
Вещество А
вещество А относят к:
1) алканам; 2) алкенам; 3) алкинам; 4) алкадиенам.
11.Осуществите превращение: 
 Х1
Х1  Х2
Х2
12. Осуществите превращение: 
 Х1+Х2
Х1+Х2  Х3+ Х4
Х3+ Х4
C акт. Br 2 КОН, спирт. KMnO4, Н2О
13. Осуществите превращение: C2H2  Х1 —> C6H5C2H5
Х1 —> C6H5C2H5  Х2
Х2  Х3
Х3  Х4.
Х4.
ВСР№17
Дисахариды
Дисахариды
биозы, углеводы, молекулы которых состоят из двух остатков моносахаридов (См. Моносахариды). Все Д. построены по типу гликозидов (См. Гликозиды). При этом водородный атом гликозидного гидроксила одной молекулы моносахарида замещается остатком др. молекулы моносахарида за счёт полуацетального или спиртового гидроксила. В первом случае образуются Д., не обладающие восстанавливающими свойствами, во втором — Д. с восстанавливающими свойствами (I). В группу невосстанавливающих Д. входят трегалоза (микоза, или грибной сахар), состоящая из 2 остатков глюкозы (См.Глюкоза) (II); Сахароза, состоящая из остатков глюкозы и фруктозы (III), и др. К группе восстанавливающих Д. относятсяМальтоза (IV), Целлобиоза (V), Лактоза (VI) и др. Д. могут содержать 5- и 6-членные кольца моносахаридов (пентозы и гексозы) и различаться по конфигурации гликозидной связи (α- или β-гликозиды). Пространственные формы (конформации (См.Конформация)) колец моносахаридных остатков в разных Д. могут варьировать. Так, целлобиоза и мальтоза различаются не только конфигурацией гликозидной связи (α — у мальтозы и β — у целлобиозы), но и тем, что в целлобиозе оба остатка находятся в одинаковой конформации, а в мальтозе — в разных.
Д. — хорошо кристаллизующиеся вещества, легко растворимы в воде и в 45 — 48°-ном спирте, плохо растворимы в 96°-ном спирте; оптически активны; сладки на вкус. Гидролиз Д. (для сахарозы называется инверсией) происходит при действии кислот; при наличии 5-членного кольца в моносахаридном остатке скорость кислотного гидролиза Д. возрастает. Гидролиз Д. осуществляется также ферментами (карбогидразами), например α- или β-гликозидазами (в зависимости от типа гликозидной связи в Д.). В результате гидролиза образуются моносахариды.
Д. широко распространены в животных и растительных организмах. Они встречаются в свободном состоянии (как продукты биосинтеза или частичного гидролиза полисахаридов), а также как структурные компоненты гликозидов и др. соединений. Обычно Д. получают из природных источников (например, сахарозу — из сахарной свёклы или сахарного тростника, лактозу — из молока животных). Многие Д. синтезируют химическими и биохимическими методами.
Сахароза, лактоза и мальтоза — ценные пищевые и вкусовые вещества. Производством сахарозы занята сахарная промышленность.
ПОЛИСАХАРИДЫ
ПОЛИСАХАРИДЫ
(гликаны), полимерные углеводы, молекулы к-рых построены из моносахаридных остатков, соединенных гликозидными связями.
Степень полимеризации П. составляет от 10-20 до неск. тысяч остатков. Каждый моносахаридный остаток в составе П. может находиться в пиранозной или фуранозной форме и иметь а- или р-конфигурацию гликозидного центра (см. Моносахариды).Моносахаридный остаток способен образовывать одну гликозидную связь с соседним моносахаридом, но может предоставить неск. гидроксильных групп для присоединения др. моносахаридов. В соответствии с этим, как и в случае олигосахаридов, молекулы П. могут быть линейными или разветвленными. Линейные П. имеют один невосстанавливающий и один восстанавливающий конец; в разветвленных П. также м. б. только один восстанавливающий конец, тогда как число невосстанавливающих концевых моносахаридных остатков на 1 превышает число разветвлений. Благодаря гликозидной гидроксигруппе восстанавливающего конца молекулы П. могут присоединяться к молекулам неуглеводной природы, напр. к белкам и пептидам с образованием гликопротеинов и протеогликанов, к липидам с образованием липополисахаридов и гликолипидов и т. д.; в сравнительно редких случаях наблюдается образование циклических П.
Гидрокси-, карбокси- и аминогруппы моносахаридных остатков, входящих в П., в свою очередь могут служить местами присоединения неуглеводных группировок, таких, как остатки орг. и неорг. к-т (с образованием ацетатов, сульфатов, фосфатов и др.), пировиноградной к-ты (образующей циклич. ацетали), метанола (образующего сложные эфиры с уроновыми к-тами) и т. д.
П., построенные из остатков только одного моносахарида, наз. гомополисахаридами (гомогликанами); в соответствии с природой этого моносахарида различают глю-каны, маннаны,галактаны, ксиланы, арабинаны и др. Полное название П. должно содержать информацию об абс. конфигурации входящих в его состав моносахаридных остатков, размере циклов, положении связей и конфигурации гликозидных центров; в соответствии с этими требованиями строгим назв., напр., целлюлозы будет поли(1 : 4)-b-D-глюкопиранан.
П., построенные из остатков двух и более моносахаридов, наз. гетерополисахаридами (гетерогликанами). К ним относятся глюкоманнаны, арабиногалактаны, араби-ноксиланы и др. Строгие назв. гетерогликанов (а также и гомополисахаридов, содержащих разветвления или неск. типов связей) громоздки и неудобны в употреблении; обычно пользуются широко распространенными тривиальными назв. (напр., гепарин, гликоген, инулин, ламтаран, хитин), а для изображения структурных ф-л часто применяют сокращенную запись (см. также Олигосахариды):
ВСР№18
АМИНОКИСЛОТЫ, органические к-ты, содержащие одну или несколько аминогрупп. В зависимости от природы кислотной ф-ции аминокислоты подразделяют на аминокарбоновые, например H2N(CH2)5COOH, аминосульфоновые, например H2N(CH2)2SO3H, аминофосфоновые, например H2NCH[Р(О)(ОН)2]2, и аминоарсиновые, например H2NC6H4AsO3H2. Согласно правилам ИЮПАК, название
аминокислоты производят от названия соответствующей к-ты; взаимное расположение в углеродной цепи карбоксильной и аминной групп обозначают обычно цифрами, в нек-рых случаях - греч. буквами. Однако, как правило, пользуются тривиальными названиями аминокислот.
Структура и физические свойства.По физ. и ряду хим. свойств аминокислоты резко отличаются от соответствующих к-т и оснований (см. табл. 1 и 2). Они лучше раств. в воде, чем в орг. р-рителях; хорошо кристаллизуются; имеют высокую плотность и исключительно высокие т-ры плавления (часто разложения). Эти св-ва указывают на взаимод. аминных и кислотных групп, вследствие чего аминокислоты в твердом состоянии и в р-ре (в широком интервале рН) находятся в цвиттер-ионной форме. Напр., для глицинакислотно-основное равновесие:
Взаимное влияние групп особенно ярко проявляется у аминокислот, где обе группы находятся в непосредств. близости, а также у о- и n-аминобензойных к-т, где их взаимод. передается через систему сопряженных связей. Благодаря электроноакцепторным св-вам группы —Н3 резко усиливается кислотностькарбоксильных групп, напр. рКа глицина 2,34, тогда как уксусной к-ты 4,75, аланина 3,6. Аминогруппаподвергается взаимокомпенсируемому влиянию электроноакцепторной карбонильной группы и электронодонорного отрицательно заряженного атома кислорода, в результате чего, напр., основностьаминогрупп аминоуксусной и n-аминобензойной к-т мало отличается от основности соотв. этиламина ианилина. Аминогруппа аминокислот ионизирована в несколько меньшей степени, чем карбоксильная группа, и водный р-р аминокислоты имеет слабокислый характер. Значение рН, при к-ром концентрация катионоваминокислоты равна концентрации анионов, наз. изоэлектрич. точкой (рI). Все аминокислоты в изоэлектрич. точке имеют минимум р-римости (в р-рах к-т и щелочей р-римость возрастает). Вблизи рI р-ры аминокислот обладают миним. буферным действием, а вблизи рК каждой функц. группы-максимальным.
Табл. 1 .- СВОЙСТВА LАМИНОКИСЛОТ
* В скобках дается однобукв. обозначение аминокислот, рекомендуемое ИЮПАК. ** Некодируемые аминокислоты: остальные кодируются генетич. кодом. *** Р-р в 1 н. НС1.
Табл. 2-СВОЙСТВА АМИНОКИСЛОТ
Цвиттер-ионная структура аминокислот подтверждается их большим дипольным моментом (не менее 50*10-30 Кл*м), а также полосой поглощения 1610-1550 см -1 в ИК-спектре твердой аминокислоты или ее р-ра.
Все кроме аминоуксусной (глицина), имеют асимметрииотносятся к L-ряду (S-конфигурация) и имеют след. пространств. строение:
При переходе от нейтральных р-ров к кислым для аминокислот L-ряда увеличивается положит. вращение, для D-ряда-отрицательное. Гидроксипролин, треонин, изолейцин имеют два асимметрич. атома и образуют по две пары диастереомеров. Оптич. активность аминокислот сильно зависит от длины волны поляризованного света (дисперсия оптич. вращения). Как правило, аминокислоты более устойчивы к рацемизации, чем их производные. Повышенной конфигурационной стабильностью отличаются N-бензилоксикарбонильные производные аминокислот.
Расщепление рацематов аминокислот на оптич. антиподы производят затравочной кристаллизацией их солейс арилсулъфокислотами или кристаллизацией диастереомерных солей ацильных производных аминокислот с оптически активными основаниями или солей эфиров аминокислот с оптически активными к-тами. Часто используют энантиоселективный гидролиз ацилами-нокислот ацилазами или гидролиз эфиров аминокислотэстеразами, причем ферменты атакуют в первую очередь L-аминокислоты. Перспективно расщепление рацематов лигандообменной хроматографией. Хроматографию используют также для анализа энантиомерного состава аминокислот.
Химические свойства.Р-ции по карбоксильным группам аминокислот, аминогруппа к-рых защищенаацилированием или солеобразованием, протекают аналогично превращениям карбоновых к-т. Аминокислоты легко образуют соли, сложные эфиры, амиды, гидразиды, азиды, тиоэфиры, галогенангидриды, смешанныеангидриды и т.д. Эфиры аминокислот под действием натрия или магнийорг. соед. превращаются ваминоспирты. При сухой перегонке в присут. Ва(ОН)2 аминокислоты декарбоксилируются.
Р-ции аминогрупп аминокислот аналогичны превращениям аминов. Аминокислоты образуют соли с минер, к-тами и пикриновой к-той, легко ацилируются хлорангидридами к-т в водно-щелочном р-ре (р-ция Шоттена - Баумана) и алкилируются алкилгалогенидами. Метилиодид и диазометан превращают аминокислоты вбетаины. С формалином аминокислоты дают мегилольные или метиленовые производные, а в присут. муравьиной к-ты или каталитически активированного Н2-N,N-диметиламинокислоты. Под действием HNO2 ароматич. аминогруппы диазотируются, а алифатические замещаются на гидроксил. При обработке эфиров аминокислот изоцианатами и изотиоцианатами образуются производные мочевины итиомочевины. При нагр. с содой или при одноврем. воздействии алкоголята и СО2 аминокислоты дают солиили эфиры N-карбоксипроизводных аминокислот, а при использовании CS2-аналогичные дитиокарбаматы.
Р-ции с одноврем. участием групп NH2 и СООН наиб. характерны дляобразуют прочные хелатные комплексы, что используется в комплексонах и в комплексообразующих ионообменных смолах на основе аминокарбоновых и аминофосфоновых к-т. При взаимод. с фосгеном превращаются в циклич. ангидриды N-карбоксиаминокислот (ф-ла I), а при нагр. с уксусным ангидридом илиацетилхлоридом - в азлактоны (II); нагревание аминокислот с мочевиной или обработка изоцианатами даетгидантоины (III), а при использовании особенно легко их эфиры, при нагр. превращаются в 2,5-пиперазиндионы, или к-ты к-та при нагр. образует в осн. полиамид и лишь частично превращ. в капролактам, что характерно и для аминокислот с большим числом метиленовых звеньев между функц. группами. Бетаиныпри нагр. могут обратимо превращ. в эфиры диметиламинокислот, напрПри элиминировании триметиламинаоетаины с укороченной углеродной цепочкой. Из-за положит. заряда на четвертичном атоме N бетаины не образуют солей со щелочами. По аналогичной причине аминосульфоновые и аминофосфоновые к-ты не образуют солей с к-тами.арилизотиоцианатовтиогидантоины (IV).
на взаимод. с нингидрином, в результате к-рого аминокислота расщепляется до альдегида, СО2 и NH3, a NH3 образует с нингидрином фиолетовый краситель. Для количеств. определения измеряют объем выделившегося СО2 или, чаще, фотометрируют образующийся краситель. Последний метод используется в автоматич. хроматографах, позволяющих разделять на сульфокатионитах и количественно анализировать сложные смеси аминокислот и пептидов. Еще более чувствителенфлуоресцентный анализ продуктов реакции аминокислот с о-фталевым диальдегидом. Быстро развивается лигандообменный хроматографический анализ аминокислот и пептидов на силикагельных сорбентах в присутствии ионов меди. Бумажная и тонкослойная хроматография чаще используются для качественного анализа. Измерение объема N2, выделяющегося при дезаминировании аминокислот азотистой к-той, а такжетитрование аминокислот щелочью в избытке формалина (методы Ван Слайка и Сёренсена) сохранили лишь историческое значение.
галогенированием карбоновых к-т или эфиров в с послед. заменойгалогена на аминогруппу при обработке амином, аммиаком или фталимидом калия (по Габриелю).
аминофосфоновых к-т по р-ции Кабачника-Филдса, напр.:
В этой р-ции вместо альдегидов м. б. использованы кетоны, а вместо диалкилфосфитов - диалкилтиофосфиты, кислые эфиры алкил(арил)фосфонистых к-т RP(OH)OR и диарилфосфиноксиды Аr2НРО. Таким путем получен широкий набор комплексонов.
Альдегиды и кетоны или их более активные производные - кетзли служат исходными соед. для синтеза с увеличением числа углеродных атомов на две единицы. Для этого их конденсируют с циклич. производными аминоуксусной к-ты - азалакгонами, гидантоинами, тиогидантоинами, 2,5-пиперазиндионами или с ее медными или кобальтовыми хелатами, напр.:
Удобные предшественники эфир и нитроуксусный эфир. К их атомамможно предварительно ввести желаемые радикалы методами алкилирования или конденсации. Кетокислоты превращ. в в присут. NH3 или гидрированием их оксимов или гидразонов.
Нек-рые Lаминокислоты ввиду сложности синтеза и разделения оптич. изомеров получают микробиол. способом (лизин, триптофан, треонин) или выделяют из гидролизатов прир. белковых продуктов (пролин,цистин, аргинин, гистидин). Перспективны смешанные химически-ферментативные способы синтеза, напр.:
Исходные тетрахлоралканы получают теломеризациеи этилена с СС14.
Ароматич. аминокислоты синтезируют восстановлением нитробензойных к-т или окислением толуидиновпосле предварит. бензоилирования аминогруппы. Антраниловую к-ту получают из фталевого ангидрида:
изотопами 15N и 14С, обычно пользуются методами Габриеля и Штреккера соответственно. Меченные 3Н аминокислоты получают из ненасыщ. предшественников.
Сульфаниловая к-та образуется при нагр. сульфата анилина до 180°С. Ее мета-изомер получаютсульфированием нитробензола с послед. восстановлением нитрогруппы.
Применение.Наиб. интерес представляют 20 Lаминокислот (аланин, аргинин, аспарагин и др.), входящих в состав белковых молекул. Смеси L-аминокислот., а также индивидуальные аминокислоты (напр.,метионин)применяют в медицине для парэнтерального питания больных с заболеваниями пищеварит. и др. органов, при нарушениях обмена в-в и др.; лизин, метионин, треонин, триптофан - в животноводстве для обогащения кормов; глутамат натрия и лизин - в пищ. пром-сти к-та (аминалон) - медиатор в центр. нервной системе, применяется как лек. ср-во при сосудистых заболеваниях головного мозга. Ароматич. аминокислоты используют в синтезекрасителей и лек. ср-в. На основе аминокарбоновых и аминофосфоновых к-т синтезируют селективныекомплексоны, комплексообразующие иониты, лигандообменные сорбенты, ПАВ.
ВСР№19
Рибонуклеиновые кислоты
рибонуклеиновые кислоты
рибонуклеи́новые кисло́ты
(РНК), высокомолекулярные органические соединения, тип нуклеиновых кислот. Образованы нуклеотидами, в которые входят аденин, гуанин, цитозин и урацил и сахар рибоза (в ДНК вместо урацила — тимин, вместо рибозы — дезоксирибоза). В клетках всех живых организмов участвуют в реализации генетической информации. Три основных вида: матричные, или информационные (мРНК, или иРНК); транспортные (тРНК); рибосомные (рРНК). У многих вирусов (так называемых РНК-содержащих) — вещество наследственности. Некоторые РНК (так называемые рибозимы) обладают активностью ферментов.
* * *
РИБОНУКЛЕИНОВЫЕ КИСЛОТЫ
РИБОНУКЛЕИ́НОВЫЕ КИСЛО́ТЫ (РНК), семейство нуклеиновых кислот (см. НУКЛЕИНОВЫЕ КИСЛОТЫ), содержащих в качестве углеводного компонента остаток рибозы (см. РИБОЗА). PНK присутствуют во всех живых клетках, участвуя в процессах, связанных с передачей генетической информации от дезоксирибонуклеиновой кислоты(см. ДЕЗОКСИРИБОНУКЛЕИНОВЫЕ КИСЛОТЫ)(ДНК) к белку. Из РНК образованы геномы (см. ГЕНОМ) многих вирусов.
Строение рибонуклеиновых кислот
За редким исключением все PНK состоят из одиночных полинуклеотидных цепей. Их многомерные единицы — монорибонуклеотиды — содержат пуриновые (см.ПУРИНОВЫЕ ОСНОВАНИЯ)— аденин (см. АДЕНИН)и гуанин(см. ГУАНИН)и пиримидиновые (см. ПИРИМИДИНОВЫЕ ОСНОВАНИЯ)основания — цитозин (см. ЦИТОЗИН)и урацил(см. УРАЦИЛ). Обычно нуклеотиды обозначают начальными буквами названий входящих в их состав оснований на английском или русском (в русскоязычной научной литературе) языках: соответственно А, G (Г), С (Ц) и U (У). Как и в молекулах ДНК, отдельные нуклеотиды связаны между собой 3"- , 5"- фосфодиэфирными связями: остаток фосфорной кислоты служит связующим звеном между 3"-атомом углерода рибозы одного нуклеотида и 5"-атомом углерода рибозы другого (исходя из этого различают 3"-; и 5"-конец молекулы).
Молекулы PНK содержат от нескольких десятков до нескольких десятков тысяч нуклеотидов. Все РНК способны к формированию вторичной структуры, основным элементом которой являются сравнительно короткие двуцелочечные тяжи, образованные комплементарными основаниями одной и той же молекулы, и связывающие их однотяжевые участки.
Синтез РНК
В живой клетке синтез РНК происходит с помощью фермента РНК-полимеразы в процессе транскрипции — считывания (переписывания) информации заложенной в молекуле ДНК, или в гене (часто группе генов).
Молекулы РНК формируются на матрице, которой служит одна из цепей ДНК, последовательность нуклеотидов в которой определяет порядок включения рибонуклеотидов по принципу комплементарности (гуанин против цитозина, урацил против аденина и т. д.). РНК-полимераза, продвигаясь вдоль одной из цепей ДНК, соединяет нуклеотиды в том порядке, который определен матрицей. Образовавшиеся молекулы РНК называют транскриптами.
История изучения РНК
Впервые РНК была выделена в 1889 году немецким биохимиком Р. Альтманом из клеток дрожжей. Но только в 1950-х гг., после доказательства генетической роли ДНК и установления ее двуцепочечной структуры, были описаны основные типы РНК и определены их функции. Было показано, что основная масса РНК в клетке (до 80%) приходится на рибосомные рибонуклеиновые кислоты (рРНК), которые в комплексе с белками образуют клеточную органеллу — рибосому (см. РИБОСОМЫ), и непосредственно участвуют в биосинтезе белка (см. Трансляция (см. ТРАНСЛЯЦИЯ (в биологии))).
В начале 19б0-х гг. на основании того, что у эукариот (см.ЭУКАРИОТЫ)почти вся ДНК сосредоточена в ядре, а синтез белка протекает главным образом в цитоплазме (см.ЦИТОПЛАЗМА)на рибосомах (см. РИБОСОМЫ), была высказана мысль о том, что какой-то вид РНК несет генетическую информацию для синтеза белка, то есть должна существовать какая-то молекула, переносящая информацию от ядра к рибосомам. Вскоре было установлено, что эту роль играют информационные, или матричные, рибонуклеиновые кислоты (иРНК, мРНК) — комплементарные копии генов.
Каждому работающему гену (или группе генов) соответствует своя молекула мРНК. Первичный транскрипт (мРНК-предшественник) по размерам намного (в 4—5 раз) превышает зрелую мРНК, которая, в свою очередь, служит матрицей для синтеза белка на рибосомах. Это связано прежде всего с экзон-интронным строением большинства эукариотических генов. В ходе созревания (процессинга) мРНК ее интронные участки удаляются, а экзоны — сшиваются друг с другом, или, как говорят, подвергаются сплайсингу. Кроме того, молекула мРНК претерпевает и некоторые другие изменения (укорачивание со стороны 3"-конца, присоединение от 20 до 200 остатков адениловой кислоты и т. д.). Каждые три последовательно расположенных основания в зрелой мРНК, называемые кодонами, соответствуют определенной аминокислоте в молекуле белка, который синтезируется по мере продвижения вдоль нее рибосомы. У прокариот мРНК не претерпевает существенных изменений после синтеза на ДНК.
В расшифровке же (декодировании) записанной в мРНК информации участвуют транспортные рибонуклеиновые кислоты (тРНК). Они переносят нужную аминокислоту к растущей полипептидной цепи в ходе синтеза белка. Узнавание кодона в мРНК осуществляется с помощью трех оснований в тРНК, называемых антикодонами, а доставляемая аминокислота присоединена к ее 3"-концу. Специфичность такой системы переноса обеспечивается тем, что имеется по крайней мере одна тРНК для каждой аминокислоты (валиновая тРНК переносит валин, аланиновая — аланин и т. д.). Но, как правило, в цитоплазме клеток встречается около 40 видов тРНК, которые доставляют 20 аминокислот, так как одна и та же аминокислота может кодироваться несколькими разными кодонами (см. Генетический код (см. ГЕНЕТИЧЕСКИЙ КОД)).
В дальнейшем были разработаны способы определения последовательности нуклеотидов в РНК, установления ее пространственной структуры. Крупнейшим открытием явилось обнаружение у некоторых РНК, названных рибозимами, способности расщеплять полирибонуклеотидные цепи, то есть играть роль фермента (ранее считалось, что ферментами могут быть только белки). Этот факт дал основания предполагать, что в период зарождения жизни на Земле РНК могла действовать самостоятельно (без белков и ДНК) и все биохимические превращения осуществлялись при ее участии.
Среди всех вышеперечисленных основных трех классов РНК наиболее изучены тРНК. Отличительной особенностью тРНК является наличие в их структуре так называемых минорных (необычных) оснований (описано более 40 таких оснований). Среди них наиболее часто встречаются инозин — производное аденина, псевдоуридин и другие производные урацила. Минорные основания появляются в тРНК уже после ее синтеза на ДНК, причем превращение обычных оснований в модифицированные происходит при участии специальных ферментов. Различные виды тРНК имеют сходную структуру и состоят примерно из 76 нуклеотидов (молекулярная масса 25 тыс.). Укладка молекул тРНК напоминает по форме клеверный лист. В ней выделяют 4 участка (стебли), в которых комплементарные пары оснований образуют водородные связи, и 3 одноцепочечных участка (петли). Значительно сложнее выглядят структуры высокомолекулярных рРНК или геномной РНК вирусов, однако детали пространственной организации их молекул пока неизвестны.
Помимо вышеописанных типов РНК, все эукариотические клетки содержат множество низкомолекулярных (коротких) молекул РНК, которые находятся в виде комплекса с молекулами белка (нуклеопротеидные частицы). Так называемые малые ядерные РНК (мяРНК) играют ключевую роль в процессинге транскриптов. Роль цитоплазматических низкомолекулярных РНК до конца не ясна.
У РНК-содержащих вирусов геномы могут быть представлены или двуцепочечной РНК, или одноцепочечной. Во многих случаях структурная организация геномных РНК сходна с мРНК эукариот. Поэтому при синтезе вирусных белков в клетке вирусная РНК может использоваться непосредственно в качестве матрицы.
ВСР№20
Химия в жизни человека
Значение химии в жизни человека трудно переоценить. Приведём фундаментальные области, в которых химия оказывает своё созидательное воздействие на жизнь людей.
1. Возникновение и развитие жизни человека невозможно без химии. Именно химические процессы, многие тайны которых учёные ещё не раскрыли, ответственны за тот гигантский переход от неживой материи к простейшим одноклеточным, и далее к вершине современного эволюционного процесса - человеку.
2. Большинство материальных потребностей, возникающих в жизни человека, обслуживается природной химией или получает удовлетворение в результате использования в производстве химических процессов.
3. Даже возвышенные и гуманистические устремления людей в своей основе опираются на химию человеческого организма, и, в частности, сильно зависят от химических процессов в мозге человека.
Конечно же, всё богатство и разнообразие жизни нельзя свести только к химии. Но наряду с физикой и психологией, химия как наука, представляет собой определяющий фактор развития человеческой цивилизации.
Химия жизни
Насколько сейчас известно, наша планета образовалась приблизительно 4.6 миллиарда лет назад, а простейшие ферментирующие одноклеточные формы жизни существуют 3.5 миллиарда лет. Уже 3.1 миллиарда лет они могли бы использовать фотосинтез, но геологические данные об окислительном состоянии осадочных отложений железа указывают, что атмосфера Земли приобрела окислительный характер лишь 1.8-1.4 миллиарда лет назад. Многоклеточные формы жизни, которые, по-видимому, зависели от изобилия энергии, возможного только при дыхании кислородом, появились на Земле приблизительно от миллиарда до 700 миллионов лет назад, и именно в то время наметился путь дальнейшей эволюции высших организмов. Наиболее революционным шагом, после зарождения самой жизни, было использование внеземного источника энергии, Солнца. В конечном итоге, именно это превратило жалкие ростки жизни, которые использовали случайно встречающиеся природные молекулы с большой свободной энергией, в огромную силу, способную преобразовать поверхность планеты и даже выйти за её пределы.
Первые живые организмы получали энергию, разлагая молекулы небиологического происхождения с большой свободной энергией на меньшие молекулы без их окисления. Предполагается, что на ранней стадии существования Земли она имела восстановительную атмосферу, состоящую из таких газов как водород, метан, вода, аммиак и сероводород, но содержащую очень мало свободного кислорода или вообще его не имевшего. Свободный кислород разрушал бы органические соединения быстрее, чем они могли синтезироваться в результате естественно протекающих процессов (под воздействием электрического разряда, ультрафиолетового излучения, теплоты или естественной радиоактивности). В этих восстановительных условиях органические молекулы, которые образовались небиологическими способами, не могли разрушаться в результате окисления, как это происходит в наше время, а продолжали накапливаться в течении тысячелетий, до тех пор, пока, наконец, не появились компактные локализованные образования из химических веществ, которые можно уже считать живыми организмами.
Появившиеся живые организмы могли поддерживать существование за счёт разрушения естественно образующихся органических соединений, поглощая их энергию. Но если бы это был единственный источник энергии, то жизнь на нашей планете была бы крайне ограниченной. К счастью, около 3 миллиардов лет назад появились важные соединения металлов с порфиринами, и это открыло путь к использованию совершенно нового источника энергии – солнечного света. Первым шагом, который поднял жизнь на Земле над ролью простого потребителя органических соединений, было включение в неё процессов координационной химии.
По-видимому, перестройка явилась побочным следствием появления нового способа запасания энергии – фотосинтеза*, – который давал его обладателям огромное преимущество над простыми ферментативными поглотителями энергии. Организмы, в которых развилось это новое свойство, могли использовать энергию солнечного света для синтеза своих собственных энергоёмких молекул и уже не зависеть от того, что находится среди их окружения. Они стали предшественниками всех зелёных растений.
Сегодня все живые организмы можно подразделить на две категории: те, которые способны изготовлять свою собственную пищу при помощи солнечного света, и те, которые не имеют такой возможности. Некоторые нынесуществующие бактерии сегодня являются живыми ископаемыми, потомками тех древних, способных к ферментации анаэробов, которые отступили в редкие анаэробные области мира, когда атмосфера в целом накопила большие количества свободного кислорода и приобрела окислительный характер. Поскольку организмы второй категории существуют за счёт поедаемых ими организмов первой категории, накопление энергии посредством фотосинтеза является источником движущей силы для всего живущего на Земле.
Общая реакция фотосинтеза в зелёных растениях обратна реакции сгорания глюкозы и проходит с поглощением значительного количества энергии.
6 CO2 + 6 H2O --> C6H12O6 + 6 O2
Вода расщепляется на элементы, что создаёт источник атомов водорода для восстановления углекислого газа в глюкозу, а нежелательный газообразный кислород выделяется в атмосферу. Энергия, необходимая для осуществления этого в высшей степени несамопроизвольного процесса, обеспечивается солнечным светом. В наиболее древних формах бактериального фотосинтеза в качестве источника восстановительного водорода использовалась не вода, а сероводород, органические вещества или сам газообразный водород, но лёгкая доступность воды сделала этот источник наиболее удобным, и в настоящее время он используется всеми водорослями и зелёными растениями. Простейшими организмами, в которых осуществляется фотосинтез с высвобождением кислорода, являются сине-зелёные водоросли. Их правильнее обозначать современным названием цианобактерии, поскольку это, в самом деле бактерии, научившиеся добывать собственную пищу из углекислого газа, воды и солнечного света.
К сожалению, фотосинтез приводит к высвобождению опасного побочного продукта, кислорода. Кислород был не только бесполезен для ранних организмов, он конкурировал с ними, окисляя естественно образующиеся органические соединения прежде, чем они могли быть окислены в процессе метаболизма этими организмами. Кислород представлял собой гораздо более эффективный «пожиратель» энергоёмких соединений, чем живая материя. Ещё хуже было то, что слой озона, который постепенно образовывался из кислорода в верхней части атмосферы, преграждал доступ ультрафиолетовому излучению Солнца и ещё более замедлял естественный синтез органических соединений. Со всех современных точек зрения, появление свободного кислорода в атмосфере представляло собой угрозу для жизни.
Но, как часто случается, жизнь сумела обойти это препятствие и даже обратила его в преимущество. Отходами жизнедеятельности первичных простейших организмов были такие соединения, как молочная кислота и этанол. Эти вещества намного менее энергоёмки по сравнению с сахарами, но они способны высвобождать большое количество энергии, если полностью окисляются до СО2 и Н2О. В результате эволюции возникли живые организмы, способные «фиксировать» опасный кислород в виде Н2О и СО2, а взамен получать энергию сгорания того, что прежде было их отходами. Преимущества сжигания пищи с помощью кислорода оказались столь велики, что подавляющее большинство форм жизни – растения и животные – пользуются в настоящее время кислородным дыханием.
Когда появились новые источники энергии, возникла новая проблема, связанная уже не с получением пищи или кислорода, а с транспортировкой кислорода в надлежащее место организма. Малые организмы могли обходиться простой диффузией газов через содержащиеся в них жидкости, но этого недостаточно для многоклеточных существ. Так перед эволюцией возникла очередная преграда.
Выход из тупика в третий раз оказался возможен благодаря процессам координационной химии. Появились такие молекулы, состоящие из железа, порфирина и белка, в которых железо могло связывать молекулу кислорода, не окисляясь при этом. Кислород просто переносится в различные участки организма, чтобы высвободиться при надлежащих условиях – кислотности и недостатке кислорода. Одна из таких молекул, гемоглобин, переносит О2 в крови, а другая, миоглобин, получает и запасает (хранит) кислород в мышечных тканях до тех пор, пока он не понадобится в химических процессах. В результате появления миоглобина и гемоглобина были сняты ограничения на размеры живых организмов. Это привело к появлению разнообразных многоклеточных, и, в конечном итоге, человека.
* Фотосинтез – это процесс преобразования энергии света в энергию химической связи получающихся веществ.
** Метаболизм – расщепление богатых энергией веществ и извлечение их энергии.
Дата добавления: 2018-02-15; просмотров: 1671; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
