Блок 4. Электродные потенциалы
Рубежная «Физическая Химия» Осен Сем_2016
Блок 1
При кондуктометрическом титровании аналитическим сигналом, позволяющим определить точку эквивалентности, является:
+электрическая проводимость раствора электролита
Кондуктометрическое титрование может быть использовано во всех случаях, когда реакция, происходящая при титровании, сопровождается:
+изменением количества ионов в растворе
Характер кривых титрования в кондуктометрии зависит от:
+изменения числа ионов и их подвижности
На рисунке (а) приведена:
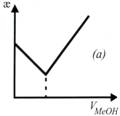
+кривая кондуктометрического титрования сильной кислоты щелочью
На рисунке (б) приведена:
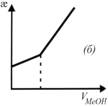
+кривая кондуктометрического титрования слабой кислоты щелочью
На рисунке (в) приведена:
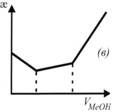
+кривая кондуктометрического титрования смеси слабой и сильной кислот щелочью
Какой из перечисленных типов проводников относится к проводникам второго рода?
+ионные проводники
Каким из приведенных уравнений определяется связь между удельной и эквивалентной электропроводностями?
+ 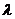 =
= 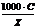 (1000*χ/С)
(1000*χ/С)
Как изменяется удельная электропроводность растворов электролитов с ростом концентрации?
+ проходит через максимум
Практическое применение электропроводности - определение степени диссоциации электролита по формуле:
+ 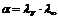 (не *, а / )
(не *, а / )
Чем объясняется увеличение удельной электропроводности растворов электролитов с ростом концентрации?
|
|
|
+ увеличением числа носителей тока в растворе
Как изменяется эквивалентная электропроводность водных растворов электролитов с ростом концентрации?
+уменьшается
Какой закон лежит в основе одного из методов экспериментального определения λ∞ для слабых электролитов?
+предельные закон Дебая Кольрауша
Какое уравнение выражает сущность закона разведения Оствальда?
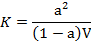
Для какой группы ионов, приведенных ниже, приблизительно одинаковы подвижности?
+ H+, NH4+, Li+, OHˉ
Для измерения электропроводности растворов используется:
+мост переменного тока
+мост Кольрауша
Резкое падение электропроводности раствора при нейтрализации кислоты щелочью связано:
+с уменьшением концентрации очень подвижных ионов гидроксония
Уравнение выражает закон разбавления Оствальда
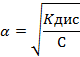
class=Section2>
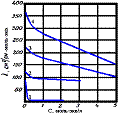
Даны графики зависимости удельной электрической проводимости водных растворов CH3COOH, KCl, KOH, HCl от концентрации. Укажите соответствие номера кривой и соответствующего электролита :
KOH +2
CH3COOH +4
KCl +3
HCl +1
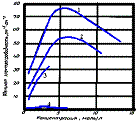
Даны графики зависимости эквивалентной электрической проводимости водных растворов CH3COOH, KCl, KOH, HCl от концентрации. Укажите соответствие номера кривой и соответствующего электролита:
|
|
|
KOH +3
KCl +2
HCl +4
Для раствора сильного электролита, диссоциирующего на два однозарядного иона, уравнение закона независимого движения ионов Кольрауша имеет вид:
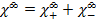
Увеличение электрической проводимости растворов сильных электролитов с ростом температуры может быть обусловлено:
+уменьшением вязкости раствора
+увеличением степени диссоциации
Уменьшение эквивалентной проводимости водного раствора CH3COOH при повышении концентрации электролита обусловлено главным образом:
+снижением степени диссоциации
Уменьшение эквивалентной проводимости водного раствора NaCl при повышении концентрации электролита обусловлено главным образом
+электрофоретическим эффектом
+релаксационным эффектом
При бесконечном разведении эквивалентная электропроводимость водного раствора электролита равна:
+ сумме предельных подвижностей ионов
В проводниках первого рода носителями электричества являются: ……..+молекулы
Величина, равная обратному значению удельного сопротивления называется: ……..+удельной проводимостью
|
|
|
Примером проводника второго рода является:
+расплав хлорида натрия
Величина, измеряемая обратным значением удельного сопротивления, называется: ……..+электропроводность
Молярная электрическая проводимость:
+ уменьшается с увеличением концентрации раствора
Скорость движения ионов в растворе не зависит от:
+ давления
С увеличение разбавления молярная электрическая проводимость:
+увеличивается
Предельную молярную электрическую проводимость можно рассчитать по:
+закону Кольрауша
Условный заряд, который приписывается атому в соединении при условии, что вещество построено из ионов, называется
+ степень окисления
Коллигативными свойствами растворов называются такие, которые определяются:
+концентрацией частиц
Раствор кипит при температуре:
+большей температуры кипения растворителя
Вычислите осмотическое давление при 27°С раствора сахара, один литр которого содержит 91г растворенного вещества.
+663кПа
Осмотическое давление некоторого раствора при -3°С составляет 2735кПа. При какой температуре осмотическое давление достигнет 3040 кПа?
+27С
|
|
|
Электролитом называется:?……
+вещество, образованное ионами
Степень диссоциации электролита – это ……..
+отношение числа продиссоциировавших молекул к числу растворенных
+отношение эквивалентной проводимости к эквивалентной проводимости при бесконечном разбавлении
рН – это…….
+отрицательный десятичный логарифм активности ионов водорода
Концентрация ионов водорода в растворе с рН=2 :
+0,01 моль/л).
Рассчитайте рН буферного раствора, содержащего 0,5 моль/л ацетата натрия и 1моль/л уксусной кислоты (рК=4,76).
+4,45
Утверждения, справедливые для парциальных мольных величин, описывающих раствор данной концентрации. Парциальная мольная величина это -
+ функция состояния
+интенсивная величина;
+характеристика вклада компонента в соответствующее свойство раствора
Утверждения, справедливые для эбуллиоскопической константы:
+зависит только от свойств растворителя;
+уменьшается с ростом соотношения удельной теплоты испарения к квадрату температуры кипения.
Криоскопические константы для бензола и воды равны соответственно 5,12 и 1,86 К·кг/моль. Молекула вещества в водном растворе полностью диссоциирует на две частицы, а в бензоле не диссоциирует и не ассоциирует. Укажите, во сколько раз будут различаться понижения температуры начала отвердевания разбавленного раствора одного и того же вещества в бензоле и в воде при одинаковых моляльных концентрациях?
+1,4
Изотонический коэффициент Вант-Гоффа это поправка, учитывающая:
+изменение числа частиц в растворе при диссоциации или ассоциации молекул;
Вычислите изотонический коэффициент Вант-Гоффа для разбавленного водного раствора некоторого вещества, если молекула вещества диссоциирует в растворе на две частицы и степень диссоциации составляет 60%.
+1,6
Известно, что практически все молекулы бензойной кислоты, растворенной в бензоле, ассоциированы в димеры. Вычислите изотонический коэффициент Вант-Гоффа для разбавленного раствора бензойной кислоты в бензоле.
+0,5
Выберите выражение, которое может использоваться для определения кажущейся молярной массы растворенного вещества криоскопическим методом
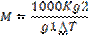
Выражение, которое может использоваться для определения кажущейся молярной массы растворенного вещества по результатам измерений осмотического давления
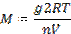
Какое уравнение правильно передает связь между изотоническим коэффициентов Вант-Гоффа и степенью диссоциации слабого электролита?
+ i-1=(v-1)a
Абсолютная скорость движения ионов – это …
+скорость движения ионов при напряженности поля 1В/м
Коллигативнымисвойстваминазываются свойства разбавленных растворов, зависящие:
+только от концентрации в растворе
Нелетучимисчитают такие вещества,……
+давление пара которых ничтожно мало по сравнению с давлением пара растворителя;
+которые не испаряются при нагревании
К коллигативным свойствам разбавленных растворов относятся:
+скорость диффузии
+осмотическое давление
+давление насыщенного пара растворителя над раствором
+температура кипения над раствором
+темп. Кристаллизации раствора
Давление пара растворителя над раствором нелетучего вещества может быть выражено уравнением: (указать уравнение).
Давление насыщенного пара растворителя над разбавленным раствором Р равно произведению Р0…:
на ……………………………?
Относительное понижение давления насыщенного пара растворителя над раствором равно: (привести формулу и назвать эту величину).
Замерзание растворов можно охарактеризовать величиной понижения температуры замерзания ΔTзам., равной: (указать формулу и ..равной ……… между температурой………...).
Kзам. – криоскопическая постоянная растворителя – определяется:
+свойствами растворителя
Константа Kзам. связана с температурой замерзания растворителя Т и его теплотой плавления ΔНпл
уравнением:
Метод исследования, основанный на измерении понижения температуры затвердевания растворов, называют:
+криоскопией(эбулиоскопией)
Молярную массу растворенного вещества (М2) методом криоскопии вычисляют по формуле (где g1 –масса растворителя; g2 –масса расиворенного вещества):
Понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего неэлектролита:
+прямо пропорционально молярной конценрации;
обратно пропорционально ………..
Средняя активность электролита(a±), определяемая как среднее геометрическое активностей отдельных ионов для Al2(SO4)3 записывается:
a± =……… -
Блок 2
Уравнение Клапейрона-Клаузиуса описывает зависимость равновесного давления от температуры для:
+однокомпонентной двухфазной системы
Выберите правую часть уравнения, описывающего ход линии моновариантного равновесия на P-T-диаграмме состояния для однокомпонентной двухфазной системы, соответствующую левой части dP/dT=
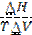
Выберите правую часть уравнения температурной зависимости давления насыщенного пара, соответствующую левой части ln(P2/P1) =
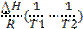
Взаимные переходы кристаллических модификаций чистого вещества, которые могут протекать как в прямом, так и в обратном направлениях в условиях равновесия
+ энантиотропные
+обратимые
Диаграмма состояния воды при невысоких давлениях. Номер области существования жидкости на фазовой диаграмме воды
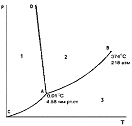
+2
Диаграмма состояния воды при невысоких давлениях. Кривая АD описывает зависимость:

+температуры плавления льда от давления
Диаграмма состояния воды при невысоких давлениях. Область 1, область 2, область 3 соответствует (соответственно):
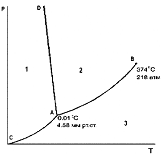
Область 1 +твердому состоянию воды
Область 2 +жидкому состоянию воды
Область 3 +газообразному состоянию воды
Диаграмма состояния воды при невысоких давлениях. Точки, лежащие на линии СА, AD, AB соответствуют (соответственно):
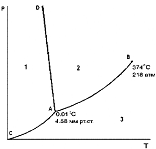
CA +равновесию твердой и газообразной фаз
AD +равновесию твердой и жидкой фаз
+равновесию двух фаз
AB +равновесию жидкой и газообразной фаз
+моновариантной системе
Диаграмма состояния воды при невысоких давлениях. Линия ОС - это зависимость давления насыщенного пара над жидкой водой от……..
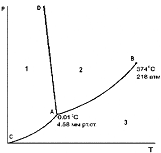
+температуры
Точки диаграммы, отражающие состояние и условия существования системы через равновесные значения Р и Т, называют………..
Диаграмма состояния серы. В соответствии с фазовой диаграммой серы при повышении давления температура плавления ромбической серы
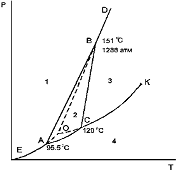
(увеличивается, уменьшается, не изменяется, изменяется различным образом в зависимости от давления).
Диаграмма состояния серы. Число стабильных инвариантных равновесий на фазовой диаграмме серы
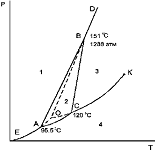
Диаграмма состояния серы. Точка A, B, C на диаграмме (соотстветственно):

B +трехфазная инвариантная система
+система: сера ромбическая-сера моноклинная-жидкость
C+ трехфазная инвариантная система
+система: сера моноклинная-жидкость-газ
+тройная точка
Укажите область применимости уравнения 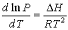 при описании двухфазных равновесий в однокомпонентных системах:
при описании двухфазных равновесий в однокомпонентных системах:
+равновесия с участием пара, рассматриваемого как идеальный газ, при условиях, далеких от критической точки;
Число степеней свободы двухфазной однокомпонентной системы, на которую из внешних условий влияют только температура и давление?
+1
Число степеней свободы двухфазной двухкомпонентной системы, на которую из внешних условий влияют только температура и давление?
+2
Число степеней свободы трехфазной двухкомпонентной системы, на которую из внешних условий влияют только температура и давление?
+1
На диаграмме состояния для чистого вещества имеются линии:
+для равновесия жидкость-пар
+для равновесия кристаллы-пар
+для равновесия жидкость-кристаллы
Блок 3
Находящаяся в состоянии равновесия система 2SO2(г) + О2(г) = 2SO3(г)
+гомогенная
+однофазная
Находящаяся в состоянии равновесия система NH4HCO3(к) = NH3(г) + CO2(г) +H2O(ж)
+гетерогенная
+трехфазная
Находящаяся в состоянии равновесия система PCl5(ж) = PCl3(г) + Сl2(г)
+ гетерогенная
+ двухфазная
Число степеней свободы (вариантность состояния) системы, состоящей из K компонентов и Ф фаз, на которую из внешних условий влияют только давление и температура
+ К-Ф+2
Правило равновесия фаз Гиббса (уравнение).
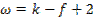
Число степеней свободы (вариантность состояния) системы, состоящей из К компонентов и Ф фаз, на которую из внешних условий влияют только температура (давление постоянно)
+ К-Ф+1
Число независимых компонентов в равновесной системе N2(г) + 2H2(г) = 2NH3(г), полученной в результате смешения 2 моль азота и 5 моль аммиака……
+2
Число фаз в равновесной системе NH4Cl(к) = NH3(г) + HСl(г)
+2
Число степеней свободы двухфазной однокомпонентной системы, на которую из внешних условий влияют только температура и давление
+1
Наибольшее число различных фаз, которые могут сосуществовать в равновесии в двухкомпонентной гетерогенной системе, на которую из внешних условий влияют только температура и давление
+4
Число параметров состояния, определяющее в общем случае размерность координатного пространства диаграммы состояния трехкомпонентной системы
+4
Кривой охлаждения называется:
+зависимость температуры охлаждающейся смеси от времени
Относительные количества фаз, находящихся в равновесии, находят:
+по правилу фаз Гиббса
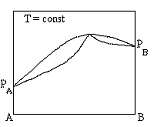
Диаграммы состояния азеотропной бинарной системы с положительными отклонениями от идеальности в жидком состоянии
+ 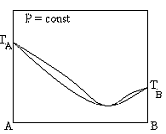 +
+ 
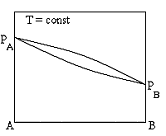
Диаграммы состояния бинарных систем, в которых увеличение содержания компонента A приводит к росту общего давления пара при любой концентрации раствора
+ 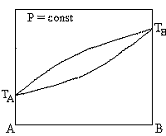 +
+ 
Утверждения, справедливые для точки азеотропа на диаграмме кипения бинарной жидкой системы: в этой точке:
+линии жидкости и пара имеют минимум или максимум;
+концентрации компонентов в жидкости равны соответствующим концентрациям в равновесном паре;
+линии жидкости и пара имеют общую горизонтальную касательную
Однофазные области, выражающие состояние жидкости, на диаграмме кипения бинарных систем (указать цифрами).
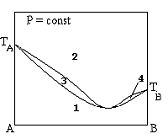
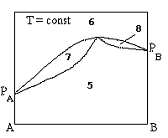
+1
+6
Блок 4. Электродные потенциалы
Электролитический ключ, служащий для элиминирования диффузионного потенциала, …….
+содержит ионы с одинаковой подвижностью;
+содержит насыщенный раствор хлористого калия
Металл, используемый в газовый электродах должен…?
+быть инертным к электродной реакции
+хорошо сорбировать газы
+иметь сильно развитую поверхность
Используемый в хингидронном электроде хингидрон представляет собой:
+эквимолекулярное соединение хинона и гидрохинона
Соответствие схематичного изображения электрода его типу
1. Cu2+|Cu. - электрод первого рода
2. Cl-,AgClТВ, Ag . - электрод второго рода
3. H3O+|H2,Pt . - газовый электрод
Образование потенциала стеклянного электрода происходит за счет:
+ионообменных процессов.
+обмена между ионами в стекле и в растворе.
Каломельный электрод относится к:
+электродам второго рода
+электродам сравнения
Хлорсеребряный электрод относится к:
+электродам второго рода
+электродам сравнения
Хингидронный электрод относится к:
+окислительно-восстановительным
+индикаторным электродам
Что называется условным электродным потенциалом?
+-условным электродным потенциалом называется эдс элемента, составленного из данного электрода и стандартного водородного электрод;
Значения средних ионных коэффициентов активности электролитов:
+берутся уз справочника
+рассчитываются по уравнению Нернста
+рассчитываются по уравнению Гиббса-Дюгема
Число ne входящее в уравнение Нернста, соответствует:
+числу электронов, участвующих в реакции
Стандартный потенциал хингидронного электрода при 250С равен +0,699В. Какой из перечисленных ниже электродов следует выбрать для построения гальванического элемента, при работе которого гидрохинон будет окисляться в хинон при 250С?
+Hg2+/Hg (aHg2+= 1) φ0Hg2+/Hg = + 0,854 В
Какой электрод называется каломельным?
+Hg| Hg2CI2, CI-
Какие ионы участвуют в электродном процессе на каломельном электроде?
+Hg2+
+Cl-
По какому уравнению рассчитываются равновесные электродные потенциалы и ЭДС гальванических элементов?
+уравнению Нернста
Как называется потенциал, возникающий на границе раздела электролитов в элементах типа:
М, МА, aq || aq, MA, | M ?
a1 < a2
+диффузионный
Какого автора теория двойного электрического слоя объясняет наблюдаемые на опыте перезарядку поверхности и изменение знака электрокинетического потенциала?
+Штерна
Установите соответствие между типом проводника и носителями электрического тока …
| Тип проводника | Носители электрического тока |
| Проводник I рода Проводник II рода | электроны. ионы; |
Электрод, потенциал которого зависит от концентрации анализируемого иона, называется…
+индикаторным электродом
Неверно, что согласно уравнению Нернста потенциал электрода зависит от …
+его массы;
Электродные потенциалы определяют по ЭДС гальванического элемента, составленного из данного электрода и стандартного …... электрода.
+водородного
Электродом 1 рода является электрод …
+Cu | Cu2+;
Электродом 2 рода является электрод …
+Ag | AgCl, KCl;
Окислительно-восстановительным электродом является электрод …
+Pt | Co3+, Co2+;
Блок 5. ЭДС
Число Z, входящее в уравнение Нернста соответствует:
+числу моль электронов, участвующих в электродном процессе
Для расчета ЭДС с помощью уравнения Нернста необходимо: знать:
+стандартную ЭДС элемента и температуру; +стехиометрическое уравнение реакции в элементе
Величину ЭДС гальванического элемента можно рассчитать
+ с помощью уравнения Нернста
Для нормально разомкнутого гальванического элемента электродвижущая сила равна:
+разности электродных потенциалов на выходах ГЭ
Известны следующие методы измерения ЭДС гальванического элемента………………
+потенциометрический
+компенсационный
Какие гальванические элементы используются для измерения чисел переноса по методу электродвижущих сил?
+концентрационные элементы с переносом ионов
Обратимо работающий гальванический элемент выделяет теплоту в окружающую среду. Зависит ли, и как, э.д.с. этого элемента от температуры?
+ с ростом температуры эдс этого элемента падает
Какую роль при измерении эдс гальванических элементов выполняет элемент Вестона?
+элемент Вестона выполняет роль нормального элемента и используется для определения эдс аккумулятора в электрической компенсационной схеме
Величину эдс гальванического элемента можно рассчитать:
+с помощью уравнения Нернста
+как разность электродных потенциалов гальванического элемена
Какое термодинамическое уравнение используется при выводе зависимости ЭДС гальванического элемента от концентрации веществ, участвующих в реакции?
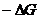 =
= 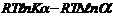
Какой процесс протекает на левом электроде в цепи Ag|AgCl, HCl || HCl|Cl2,Pt, если φ0Ag|AgCl|Clˉ = + 0,222 B, φ 0 Cl2/Сlˉ + 1,360 B?
+окисление Ag
Указать суммарное уравнение реакции, протекающее в гальваническом элементе, состоящем из 1н каломельного электрода при 250С (φ= +0,281) и стандартного водородного электрода.
+H2 + Hg2Cl2 → 2H+ + 2Hg + 2Cl–
Каким термодинамическим уравнением следует воспользоваться для установления зависимости между э.д.с. гальванического элемента и ее температурным коэффициентом?
A'max=Qp+T(dA'max/dT)
Значение, какой величины необходимо определить для расчета изменения энтропии ∆S в реакции, протекающей в гальваническом элементе Ag | AgCI, KCIнасыщ., Hg2CI2| Hg?
+Е
Требуется рассчитать по термодинамическим данным эдс элемента Даниеля – Якоби при 25°С Zn | Zn2+ (a=1),aq || Cu2+ (a=1), aq| Cu. Какая пара термодинамических величин необходима для расчета?
+ΔН0298 и ΔS0298
Как правильно записать гальванический элемент в виде формулы?
+Cu| Zn| ZnSO4, aq|| CuSO4, aq| Cu|Cu
Уравнение Нернста для расчета эдс гальванических элементов?
E=E0-RT/neF*lnao/are
Для чего нужен «солевой мостик» в гальваническом элементе?
+для возникновения эдс и работы элемента
Суммарный токообразующий процесс, протекающий в гальваническом элемента Даниэля-Якоби?
+Zn2++Cu2+=Zn2++Cu0
Реакции на электродах в гальваническом элементе?
+на катоде – восстановление
+на аноде – окисление
Какова причина возникновения диффузионного потенциала в гальваническом элементе?
+различие в природе и в концентрациях электролитов полуэлементов
+различие в подвижностях катиона и аниона в электролитах полуэлементов
За счет чего возникает э.д.с. в гальваническом элементе?
+за счет окислительно-восстановительных реакций на электродах
В гальваническом элементе на катоде (+) протекает процесс?
+ВОССТАНОВЛЕНИЯ ИОНОВ ЭЛЕКТРОЛИТА
В гальваническом элементе на аноде (-) протекает процесс?
+окисление металла
Схема записи гальванического элемента Даниэля-Якоби
(-) Zn / ZnSO4, aq // aq, CuSO4 / Cu (+)
c1 c2
Дать понятие электролизу?
+окислительно-восстановительный процесс на электродах при пропускании электрического тока через электролит
Химическим гальваническим элементом называют устройство:
+из 2-х электродов,в котором химическая энергия превращается в электрическую
ЭДС гальванического элемента Даниэля-Якоби вычисляется по формуле?
+E= фиCu-фиZn
Согласно схеме гальванического элемента Fe|Fe2+||Ni2+|Ni …
в процессе работы элемента на электроде осаждается ………;
+ электроны движутся от железного электрода к никелевому
Максимальное значение ЭДС (при одинаковых концен-трациях солей) будет у гальванического элемента Мe|Me(NO3)2||Cu(NO3)2|Cu, если стандартный потенциал второго металла равен …
+-2,36 В;
Если гальванический элемент составлен из двух водородных электродов, один из которых стандартный, то для достижения наибольшего значения ЭДС другой электрод следует погрузить в …
+01 М раствор СН3СООН;
Для увеличения ЭДС гальванического элемента, состав-ленного из кадмиевого и цинкового электродов следует …
+увеличить концентрацию ионов кадмия;
Максимальное значение ЭДС (при одинаковых концентрациях солей) будет у гальванического элемента Мe|Me(NO3)2||Cu(NO3)2|Cu, если стандартный потенциал второго металла равен …
+-0,76 В.
Дата добавления: 2018-02-15; просмотров: 5496; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
