I-s диаграмма для идеального газа.
Изохорный процесс.
Изохорным называется процесс, протекающий при постоянном объеме рабочего тела. Примером изохорного процесса служит нагревание газа в металическом баллоне. Уравнение данного процесса:
v = const , dv = 0 .
Согласно уравнения Клайперона, для двух состояний газа в изохорном процессе можно записать: p1v=RT1 и p2v=RT2. Следовательно, соотношение между параметрами газа в изохорном процессе имеет вид:
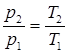 . (2.22)
. (2.22)
Так, как объем рабочего тела в данном процессе не изменяется (dv=0), работа расширения будет равна нулю: l = 0 .
В p-v диаграмме изохорный процесс изображается прямой, перпендикулярной к оси объемов (рис. 2.12).

|
Изменение внутренней энергии в изохорном процессе равно:

 (2.23)
(2.23)
|
Согласно формулировки первого закона термодинамики для закрытой термодинамической системы вся теплота, подведенная к рабочему телу в изохорном процессе пойдет на изменение его внутренней энергии (рис. 2.13):
 . (2.24)
. (2.24)
Для изображения изохорного процесса в T-s диаграмме температура рабочего тела определится из уравнения Клайперона, а изменение энтропии:
 . (2.25)
. (2.25)
В T-s диаграмме изохора представляет собой логарифмическую кривую, c углом уклона равным:  (рис. 2.12, 2.14).
(рис. 2.12, 2.14).
|
|
|

|
Площадь под изохорой, в T-s диаграмме, представляет собой теплоту, сообщаемую системе, а т.к. в данном процессе теплота идет только на увеличение внутренней энергии газа, то она же будет соответствовать и изменению удельной внутренней энергии рабочего тела.
Если рассмотреть несколько изохорых процессов: v1 < v2 < v3, то в T-s диаграмме они изобразятся эквидистантными кривыми, имеющими одинаковый уклон в сходственных точках (рис 2.14).
Изобарный процесс.
Изобарным называется процесс, протекающий при постоянном давлении рабочего тела. Примеро изобарного процесса горение топлива в камере сгорания газотурбинного двигателя. Уравнение данного процесса:
p = const , dp = 0 .
В соответствии с уравнением Клайперона соотношение между параметрами газа в изобарном процессе имеет вид:
 . (2.26)
. (2.26)

|
В p-v диаграмме изобарный процесс изображается прямой, перпендикулярной к оси давлений (рис. 2.15).
Работа расширения данного процесса, которой на рисунке 2.15 соответствует площадь фигуры v1-1-2-v2 , определится как:
|
|
|
 , [Дж/кг] . (2.27)
, [Дж/кг] . (2.27)
Так, как давление рабочего тела в данном процессе не изменяется (dp=0), располагаемая работа будет равна нулю: l ¢ = 0 .
Изменение внутренней энергии и энтальпии определится как:

 (2.28)
(2.28)
 (2.29)
(2.29)
|
Согласно 1ого законом термодинамики, теплота, сообщаемая рабочему телу в изобарном процессе, будет расходоваться на изменение его энтальпии и совершение располагаемой работы но т.к. l ¢ = 0 то (рис. 2.16):
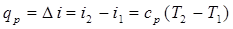 . (2.30)
. (2.30)
Для изображения изобарного процесса в T-s диаграмме температура рабочего тела определится из уравнения Клайперона, а изменение энтропии:
 . (2.31)
. (2.31)
В T-s диаграмме изобара, представляет собой логарифмическую кривую, с уклоном  (рис. 2.15, 2.17).
(рис. 2.15, 2.17).
Для сравнения изображения изохор и изобар в T-s координатах (обе представляют собой логарифмические кривые), необходимо сопоставить их углы наклона к оси энтропий в сходственных точках:
|
|
|
 ,
, 
 .
.
   
|
В T-s диаграмме изобара, по сравнению с изохорой располагается более полого (рис. 2.17).

|
Если наряду с изобарой, в T-s координатах, изобразить вспомогательную изохору (рис. 2.18), то графически можно показать какая часть теплоты, сообщаемой газу в изобарном процессе, расходуется на изменением внутренней энергии, а какая на совершение работы расширения.

|
Если рассмотреть несколько изобарых процессов: p1 < p2 < p3 , то в T-s диаграмме они изобразятся эквидистантными кривыми, имеющими одинаковый уклон в сходственных точках (рис 2.19).
Анализируя формулировки первого закона термодинамики в условиях изобарного процесса, можно теоретически обосновать, приведенное ранее, соотношение между изохорной и изобарной теплоемкостями идеального газа.
Согласно первого закона термодинамики для открытой и закрытой термодинамических систем, теплоту изобарного процесса можно определить как:
 , (а)
, (а)
 . (б)
. (б)
Приравнивая правые части уравнений (a) и (б), получим:
|
|
|
 (2.32)
(2.32)
Соотношение (2.32) носит название уравнение Майера.
Изотермический процесс.
Изотермическим называется процесс, протекающий при постоянной температуре рабочего тела. Уравнение данного процесса: T = const , dT = 0 , или, в соответствии с уравнением Клайперона ( pv=RT): pv=const.

|
Уравнение изотермы можно записать и в виде p = const / v. Из него видно, что графически, в p-v диаграмме, изотермический процесс будет представлен равнобокой гиперболой (рис. 2.20).
Соотношение между параметрами в изотермическом процессе:
 . (2.33)
. (2.33)
Работа расширения данного процесса определится как:
 , (2.34)
, (2.34)
на p-v диаграмме ей будет соответствовать площадь фигуры v1-1-2-v2.
Аналогично может быть определена и располагаемая работа изотермического процесса, которая, в p-v координатах, изобразиться площадью фигуры p1-1-2-p2 :
 . (2.35)
. (2.35)
Т.к. температура идеального газа в изотермическом процессе остается неизменной, то изменение внутренней энергии и энтальпии газа будут равны нулю: D u=0, D i=0 .
|
Поэтому, в соответствии с первым законом термодинамики, вся теплота, сообщаемая системе в изотермическом процессе пойдет на совершение работы расширения (рис. 2.21):
 . (2.36)
. (2.36)
В T-s диаграмме данный процесс изобразится прямой линией, параллельной оси энтропий. Изменение энтропии определится как:
 , [Дж/кг×К]. (2.37)
, [Дж/кг×К]. (2.37)
В T-s диаграмме площадь фигуры m-1-2-n будет характеризовать количество подведенной к рабочему телу теплоты, а так как в изотермическом процессе вся теплота идет на совершение работы расширения, то она же будет изображать и работу процесса.
Адиабатный процесс.
Адиабатным называется процесс, протекающий без теплообмена с окружающей средой. Такой процесс может быть осуществлен в том случае, когда все элементы устройства, содержащего газ, надежно изолированы и не допускают теплообмена с окружающей средой. Уравнение процесса:
q = 0 , d q = 0.
В реальных тепловых машинах, в следствии обязательно присутствующего теплообмена с окружающей средой, процессы никогда не бывают в точности адиабатными. Однако ввиду кратковременности протекания некоторых процессов (расширение газа в ДВС), а следовательно недостаточности времени для теплообмена, многие реальные процессы расширения и сжатия оказываются близкими к адиабатному.
Изменение энтропии в обратимом адиабатном процессе определится как ds= d q/T, а с учетом того, что d q = 0 : s=0, s=const.
В адиабатном обратимом процессе энтропия рабочего тела остается постоянной, поэтому его называют изоэнтропным.
В адиабатном процессе изменяются все параметры состояния рабочего тела: p, v, T, u, i. Для вывода соотношений между ними воспользуемся формулировками 1ого закона термодинамики для открытой и закрытой термодинамических систем:
 , (а)
, (а)
 . (б)
. (б)
Разделим (а) на (б):  . Обозначим
. Обозначим  , тогда
, тогда  .
.
Проинтегрировав последнее выражение, получим:
 ,
,
а окончательно уравнение адиабаты (изоэнтропы) примет вид:
pvk = const , (2.38)
где k - показатель адиабаты, который, при умеренных температурах, для воздуха и двухатомных газов » 1.4 , а для трехатомных » 1.3 . С увеличением температуры показатель адиабаты уменьшается.
Уравнение адиабаты можно записать в виде: p = const / vk. Видно, что в p-v диаграмме адиабата изобразится неравнобокой гиперболой (рис. 2.22).

|
Если, в p-v координатах, сопоставить между собой изображения изотермического (pv=const) и адиабатного (pvk=const) процессов, то можно заметить, что по сравнению с изотермой, адиабата имеет более крутой уклон:
 ,
,  Þ a T < a s .
Þ a T < a s .
В T-s диаграмме адиабата (изоэнтропа) изобразится прямой линией, параллельной оси температур (рис. 2.22).
Соотношения между параметрами рабочего тела в адиабатном процессе можно получить, если записать уравнение адиабаты для двух состояний рабочего тела: p1v1k = p2v2k . В соответствии с этим:
 ,
,  . (2.39(а,б))
. (2.39(а,б))
Для нахождения соотношений между температурой и давлением, температурой и удельным объемом можно воспользоваться следствием из уравнения Клайперона:  . Подставляя полученное соотношение в 2.39(а), получим:
. Подставляя полученное соотношение в 2.39(а), получим:
 , (2.39(в))
, (2.39(в))
| ||||||||||||||||||||||
а подставляя 2.39(б) в 2.39(в) получим:
 . (2.39(г))
. (2.39(г))
Так, как рассматриваемый процесс протекает без теплообмена с окружающей средой, то согласно первого закона термодинамики работа в адиабатном процессе совершается только за счет изменения внутренней энергии рабочего тела (рис. 2.23).
Для определения работы расширения адиабатного процесса воспользуемся соотношением (2.3), в которое, согласно уравнения адиабаты, подставим выражение p1v1k = pvk Þ  :
:
 ,
,
вынося за скобки v1k-1 и домножив числитель и знаменатель на “-1”, окончательно получим:
 . (2.40(a))
. (2.40(a))
Если, в соответствии с выражением 2.39(в), заменить в 2.40(а) отношение удельных объемов отношением температур, то с учетом уравнения состояния выражение для определения работы расширения адиабатного процесса примет вид:
 , (2.40(б))
, (2.40(б))
 , (2.40(в))
, (2.40(в))
а заменяя в 2.40(а) отношение удельных объемов отношением давлений, из 2.39(б), получим:
 . (2.40(г))
. (2.40(г))
Еще одно уравнение для определения работы расширения адиабатного процесса можно получить из математического выражения первого закона термодинамики для закрытой т.д.с. (q= D u+l):
 . (2.40(д))
. (2.40(д))
Располагаемую работу адиабатного процесса можно определить из уравнения:  .
.
Подставим в данное выражение вместо работы расширения ее значение из соотношения 2.40(в):
 . (2.41(а))
. (2.41(а))
Из полученного уравнения видно, что зависимость между располагаемой работой и работой расширения адиабатного процесса имеет вид: l = k l ‘, поэтому для определения располагаемой работы применимы соотношения аналогичные, формулам для работы расширения:
 ,
,  , (2.41(б,в))
, (2.41(б,в))
 . (2.41(г))
. (2.41(г))
И еще одно выражения для определения располагаемой работы можно получить из математического выражения первого закона термодинамики для открытой т.д.с. (q= D i+l’):
 . (2.41(д))
. (2.41(д))
Политропный процесс.
Кроме рассмотренных термодинамических процессов, протекающих в идеальном газе, возможно существование бесчисленного множества других обратимых процессов (рис. 2.24). Такие обобщенные термодинамические процессы называются политропными.
В политропных процессах могут изменяться все параметры состояния рабочего тела, подводится или отводится теплота, совершаться или затрачиваться работа. Для получения уравнения политропного процесса воспользуемся математическими выражениями первого закона термодинамики. При этом, согласно определения понятия теплоемкости, количество теплоты, подводимое или отводимое в политропном процессе, можно определить как 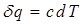 , где с - массовая теплоемкость политропного процесса.
, где с - массовая теплоемкость политропного процесса.
 . (а)
. (а)
 . (б)
. (б)
Разделим (а) на (б):  и обозначим
и обозначим  - показатель политропы, тогда:
- показатель политропы, тогда:  . Проинтегрировав, получим:
. Проинтегрировав, получим:  . Таким образомс, окончательно уравнение политропы примет вид:
. Таким образомс, окончательно уравнение политропы примет вид:
pvn = const . (2.42)

|
Полученное уравнение политропы охватывает весь класс обратимых процессов, включая ранее рассмотренные изохорные, изобарные, изотермические и адиабатные процессы (рис. 2.24):
* n = ¥ Þ pv ¥ =const Þ v=const - изохорный процесс;
* n = 0 Þ pv0=const Þ p=const - изобарный процесс;
* n = 1 Þ pv1=const Þ pv=const - изотермический процесс;
* n = k Þ pvk=const - адиабатный процесс.
Соотношения между параметрами рабочего тела в политропном процессе получаются по аналогии с соотношениями для адиабатного процесса с заменой в них “k” на “n”:
 ;
;  ;
;  ;
;  . (2.43(а,б,в,г))
. (2.43(а,б,в,г))
Исходя из определения введенного понятия показателя политропы, можно получить формулу для определения массовой теплоемкости политропного процесса:
 ,
,
а с учетом того, что k=cp / cv , окончательно получим:
 . (2.44)
. (2.44)
Согласно первого закона термодинамики количество теплоты, сообщаемое рабочему телу в политропном процессе, определится как:
 , (2.45)
, (2.45)
а изменение энтропии:
 . (2.46)
. (2.46)
Все формулы для определения работы расширения и располагаемой работы политропного процесса получаются также, как и для адиабатного, и отличаются заменой в них “k “ на “n”:
 ,
,  , (2.47(а,б))
, (2.47(а,б))
 ,
,  , (2.47(в,г))
, (2.47(в,г))
 ,
,  , (2.48(а,б))
, (2.48(а,б))
 ,
,  . (2.48(в,г))
. (2.48(в,г))
Определение массовой теплоемкости политропного процесса, в практическом плане, представляет определенную трудность. Поэтому показатель политропы “n”, как правило, находится по экспериментальным данным (рис. 2.25).
По результатам опытов строится график процесса, а показатель политропы находится одним из двух способов (рис. 2.25).
1. С графика процесса снимаются координаты двух точек (рис. 2.25(а)): 1(p1; v1) и 2(p2; v2), и для них записывается уравнение политропы p1v1n=p2v2n. После логарифмировав, получают что:
 .
.

|
2. Проводится касательная к графику политропного процесса в выбранной точке А(pa; va) (рис. 2.25(б)) и измеряется угол ее наклона к оси объемов. Показатель политропы определяется как:
 .
.

|

|
Учитывая, что уравнение политропы охватывает все обратимые термодинамические процессы, протекающие в идеальном газе, определенный интерес представляет их классификация. Для ее осуществления воспользуемся выражением для определения массовой теплоемкости политропного процеса:  , из которого видно, что последняя может принимать отрицательные значения (рис. 2.26).
, из которого видно, что последняя может принимать отрицательные значения (рис. 2.26).
При n® -¥ величина c>0 и стремится к “cv“. При изменения показателя политропы от -¥ до 0 теплоемкость процесса положительна и возрастает, причем при n= 0 она равна теплоемкости изобарного процесса “cp”, а при n®1 - c ®+¥.
На участке изменения показателя политропы от 1 до k теплоемкость процесса будет отрицательной, и с ростом n будет увеличиваться. При k<n<+¥ теплоемкость политропного процесса положительна и возрастает с ростом n. При n®+¥ ее значение стремится к “cv“.
В соответствии с таким изменением теплоемкости все политропные процессы подразделяются на три группы (рис. 2.27).
|
1. -¥ <n<1 Процессы, протекающие при расширении за счет теплоты. Во всех процессах расширения политроп этой группы теплота, сообщаемая системе из вне, расходуется на совершение работы расширения и увеличение внутренней энергия рабочего тела. Во всех процессах сжатия теплота отводится, внутренняя энергия уменьшается, работа затрачивается.
| ||||||||||
|
|
2. 1<n<k Процессы, протекающие при расширении за счет теплоты и изменения внутренней энергии. Подвод теплоты в процессах расширения политроп этой группы сопровождается уменьшением температуры, а следовательно и внутренней энергии, и совершением работы расширения. При отводе теплоты в процессах сжатия температура и внутренняя энергия рабочего тела повышается. Работа затрачивается.
3. k<n<+¥ Процессы, протекающие при расширении с отводом теплоты. Работа расширения в процессах данной группы совершается за счет изменения внутренней энергии рабочего тела. Теплота от системы отводится.
i-s диаграмма для идеального газа.
В практике, наряду с p-v и T-s диаграммами, широкое применение находит i-s диаграмма. Рассмотрим изображение основных обратимых термодинамических процессов в такой диаграмме (рис. 2.31).

|
Изотермический процесс. Для идеального газа энтальпия является однозначной функцией от температуры: i=f(T). Т.к. в изотермическом процессе температура рабочего тела не изменяется, следовательно и энтальпия тоже будет постоянна. Поэтому в i-s диаграмме изотерма представляет собой прямую, перпендикулярную оси температур.
Адиабатный процесс. Поскольку по условиям данного процесса изменение энтропии равно нулю (s=const), адиабата в i-s диаграмме, также как и в T-s, изобразится прямой линией, параллельной оси этропий.
Согласно первого закона термодинамики, располагаемая работа адиабатного процесса равна перепаду энтальпии системы l’=i1-i2. Поэтому в i-s диаграмме ей будет соответствовать длина отрезка 1-2, что делает ее графическое определение исключительно простым.
Изобарный процесс. В изобарном процессе затрачиваемая теплота полностью расходуется на увеличение энтальпии рабочего тела: q= D i . Изменение энтропии идеального газа определится как:  . Следовательно в i-s диаграмме изобара изобразится логарифмической кривой с углом наклона:
. Следовательно в i-s диаграмме изобара изобразится логарифмической кривой с углом наклона:  .
.
Изохорный процесс. Измерение энтропии идеального газа в изохорном процессе определится как:  , следовательно в i-s диаграмме она изобразится логарифмической кривой. Угол наклона изохоры будет равен:
, следовательно в i-s диаграмме она изобразится логарифмической кривой. Угол наклона изохоры будет равен:  .
.
Дата добавления: 2021-06-02; просмотров: 186; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!








