Электролиты имеют различную степень диссоциации, т. е. степень диссоциации зависит от природы электролита.
Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты разделяют на сильные и слабые.

Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3Na+ + 3OH— + Fe3+ + 3Cl— = Fe(OH)3 + 3Na+ + 3Cl—
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3Na+ + 3OH— + Fe3+ + 3Cl— = Fe(OH)3 + 3Na+ + 3Cl—
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe3+ + 3OH— = Fe(OH)3
На ионы мы не разбиваем:
|
|
|
· Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
· Анионы кислотных остатков кислых солей слабых кислот (НСО3—, Н2РО4— и т.п.) и катионы основных солей слабых оснований Al(OH)2+
· Комплексные катионы и анионы: [Al(OH)4]—
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
н р р р
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H+ + SO42— = Zn2+ + SO42— + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H+ = Zn2+ + H2S
Составляем уравнение реакции и проверяем растворимость всех веществ:
р р р
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na+ + НСО3— + Na+ + ОН— = 2Na+ + CO32- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3—+ ОН— = CO32- + H2O
Составляем уравнение реакции и проверяем растворимость всех веществ:
р р р р
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
|
|
|
Na+ + [Al(OH)4]— + 4H+ + 4Cl— = Na+ + Cl— + Al3+ + 3Cl— + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4]— + 4H+ = Na+ + Al3+ + H2O
6)Гидролиз солей
Гидролиз солей — взаимодействие ионов соли с водой, в результате которого образуются малодиссоциируемые соединения (ионы или молекулы) и изменяется реакция среды.
Гидролизу подвергаются три типа солей:
· а) соли, образованные слабым основанием и сильной кислотой (CuCl2, NH2Cl, Fe2(S04)3 — гидролиз по катиону);
· б) соли, образованные сильным основанием и слабой кислотой (К2С03, Na2S — гидролиз по аниону);
· в) соли, образованные слабым основанием и слабой кислотой (NH4)2C03, Fe2(C03)3 - гидролиз ng катиону и по аниону).
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются (NaCl, К2SО4, Ba(N03)2).
В растворе NaCl индикаторы не изменяют свою окраску, т. к. растворенный в воде хлорид натрия находится в виде ионов:

NaCl «=* Na+ + СГ. Вода, хоть и незначительно, но диссоциирует на ионы, и устанавливается равновесие:

Таким образом, в растворе поваренной соли есть смесь катионов Na+ и анионов ОН-, Сl-. Ионы в растворе перемещаются беспорядочно и постоянно сталкиваются друг с другом. Но эти столкновения ионов Na+ и ОН- , ионов Н+ и Сl- к образованию соединений не приводят, так как NaOH - сильное основание, а НСl - сильная кислота. Так как слабые электролиты при растворении хлорида натрия в воде не образуются, хлорид натрия гидролизу не подвергается. Концентрация ионов Н+ равна концентрации ионов ОН-, поэтому окраска индикаторов не изменяется.
|
|
|
Фенолфталеин становится малиновым в растворе соды Na2C03, т. к. Na2CO3 хорошо растворяется в воде и диссоциирует:

Столкновение ионов Na+ и ' C032- образуется малодиссоциирующий гидрокарбонатион. Вследствие связывания ионов Н+ в малодиссоциируюущий продукт, равновесие диссоциации воды смещается в сторону накопления ионов ОН-. Раствор приобретает щелочную реакцию:
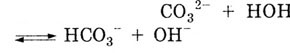
Под действием анионов ОН- фенолфталеин становится малиновым.
Раствор хлорида алюминия имеет кислую среду, т. к. в растворе АlСl3 диссоциирует на ионы:

Столкновение ионов Н+ и Сl- к образованию соединения не приводит. Из имеющихся в растворе ионов малодиссоциирующий продукт образуют ионы Аl3+ и ОН-. Связывание ионов ОН- в малодиссоциирующий ион АlOН2+ вызывает смещение равновесия диссоциации воды в сторону накопления ионов Н+.


Дата добавления: 2021-05-18; просмотров: 342; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
