Процесс, протекающий без теплообмена термодинамической системы с окружающей средой, называется адиабатным процессом.
Применение первого начала термодинамики к изопроцессам
На прошлом уроке мы с вами говорили о фундаментальном законе сохранения и превращения энергии. А также рассмотрели его частный случай в применении к термодинамическим системам, который называется первым законом или первым началом термодинамики.
С помощью первого закона термодинамики можно делать важные заключения о характере протекающих процессов. Рассмотрим различные процессы, при которых одна из физических величин, характеризующих состояние газа, остаётся неизменной (то есть изопроцессы). Естественно, что для простоты мы будем считать газ идеальным одноатомным.
Итак, пусть газ находится в цилиндрическом сосуде, закрытом неподвижным поршнем. Что произойдёт, если мы начнём подводить теплоту к газу?

Если пренебречь тепловым расширением сосуда, то объём газа остаётся практически неизменным, хотя давление газа увеличивается. Следовательно, работа силы давления газа равна нулю. А это, согласно первому закону термодинамики, означает, что при изохорном процессе всё передаваемое газу количество теплоты идёт на увеличение его внутренней энергии:

Очевидно, что если теплота отводится от газа, то изменение внутренней энергии отрицательно и внутренняя энергия газа уменьшается.
Мы уже с вами знаем, что изменение внутренней энергии идеального одноатомного газа прямо пропорционально изменению его абсолютной температуры и не зависит от других макроскопических параметров системы:
|
|
|
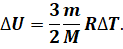
Следовательно, при изохорном процессе количество теплоты также пропорционально изменению абсолютной температуры:

С другой же стороны, количество теплоты, переданное термодинамической системе, прямо пропорционально её массе и изменению абсолютной температуры:

В записанной формуле cV — это удельная теплоёмкость газа при постоянном объёме. Давайте подставим записанное уравнение в предыдущую формулу:
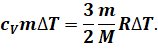
Сократив полученное выражение на массу газа и изменение его температуры, получим, что удельная теплоёмкость газа при изохорном процессе обратно пропорциональна его молярной массе:

Теперь предположим, что наш сосуд с газом под поршнем находится в термостате (напомним, что это устройство, в котором поддерживается постоянная температура).
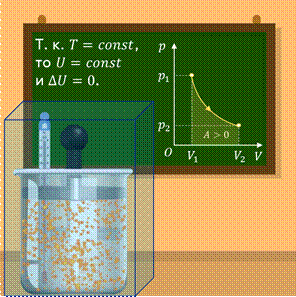
Если теперь, например, мы с помощью внешнего устройства начнём медленно перемещать поршень в сосуде так, чтобы объём газа увеличивался, то работа силы давления расширяющегося газа будет положительной. При одинаковой первоначальной температуре термостата и газа теплопередачи не происходит. Положительная работа силы давления расширяющегося газа совершается за счёт уменьшения его внутренней энергии, а значит, и температуры. Но как только температура газа начинает уменьшаться, тут же возникает теплопередача от термостата газу. При медленном перемещении поршня в сосуде температура газа успевает выровняться, а реально происходящий процесс близок к изотермическому.
|
|
|
Значит, и внутренняя энергия идеального одноатомного газа остаётся постоянной, а её изменение:
∆U = 0.
Отсюда следует, что при изотермическом процессе всё подведённое к газу количество теплоты идёт на совершение газом работы:
Q = A.
Если же внешнее устройство обеспечивает медленное уменьшение объёма газа в сосуде, то работа газа будет отрицательной. А это приводит к увеличению внутренней энергии и, следовательно, температуры газа. В результате возникает теплопередача от газа термостату.
Что касается теплоёмкости газа при изотермическом процессе, то она стремится к бесконечности (предлагаем вам самостоятельно доказать это):

Теперь предположим, что наш газ находится в цилиндрическом сосуде, закрытом поршнем, который может свободно перемещаться.

Будем изобарно нагревать газ (напомним, что изобарный процесс — это процесс, протекающий при постоянном давлении). Очевидно, что в этом случае газ будет нагреваться, расширяться и совершать работу, то есть будет изменяться его внутренняя энергия. Следовательно, при изобарном процессе подведённое к газу количество теплоты частично расходуется на увеличение внутренней энергии системы и частично на совершение работы силой давления газа при его расширении:
|
|
|

Давайте распишем величины, входящие в формулу, согласно их определению:

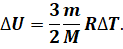

Величина cp — это удельная теплоёмкость газа при постоянном давлении.
Преобразуем формулу для работы газа. Для этого запишем уравнение Клапейрона — Менделеева для двух его состояний (а мы вправе это сделать, так как масса газа и его химический состав в ходе процесса не изменялись):
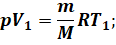

Теперь вычтем из второго уравнения первое:

Сравнивая последнее уравнение с формулой для работы, находим, что работа газа прямо пропорциональна изменению его абсолютной температуры:

Перепишем первое начало термодинамики для изобарного процесса с учётом наших рассуждений:

Полученное равенство разделим на массу газа и изменение его температуры:
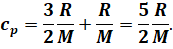
И приведём подобные
|
|
|
Сравнивая полученное равенство с выражением для удельной теплоёмкости газа при постоянном объёме, видим, что удельная теплоёмкость газа при постоянном давлении всегда больше его удельной теплоёмкости при постоянном объёме:

Это объясняется тем, что при постоянном давлении часть подводимой энергии расходуется на совершение силой давления газа работы при расширении.
Расширение жидких и твёрдых тел при нагревании при постоянном давлении значительно меньше, чем газов. Поэтому их работа при расширении намного меньше, чем изменение внутренней энергии. Следовательно, их удельные теплоёмкости слабо зависят от характера процесса (ср ≈ сV).
А теперь давайте представим, что мы смогли теплоизолировать цилиндр с газом и предоставили ему возможность самопроизвольно расширяться. Очевидно, что при этом газ будет совершать положительную работу. Но за счёт чего? Ведь теплообмен с окружающей средой отсутствует, то есть теплота не подводится (Q = 0).

Процесс, протекающий без теплообмена термодинамической системы с окружающей средой, называется адиабатным процессом.
Из первого закона термодинамики следует, что работа газа при адиабатном процессе совершаться только за счёт убыли его внутренней энергии:

Таким образом, при адиабатном расширении газ совершает работу и сам охлаждается. И наоборот, при адиабатном сжатии работа совершается над газом и он нагревается. А так как при адиабатном процессе количество теплоты равно нулю, то и удельная теплоёмкость газа также равна нулю:
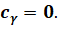
На практике адиабатный процесс осуществляется главным образом не за счёт теплоизоляции (нельзя окружить систему оболочкой, которая абсолютно не допускает теплопередачи), а за счёт скорости протекания процесса. Например, когда вы открываете охлаждённую газировку, то можете заметить облачко тумана, которое растекается из горлышка бутылки. Объясняется это тем, что при адиабатном расширении происходит уменьшение температуры газа и, как следствие, происходит конденсация пара.
Очень нагляден и такой опыт. Возьмём насос и с его помощью через отверстие в пробке будем накачивать воздух в стеклянный сосуд с небольшим количеством воды. Спустя непродолжительное время сжатый воздух совершит работу по преодолению силы трения и силы атмосферного давления и вытолкнет пробку. Теплопередача между сосудом и окружающими телами не успевает проявиться за тот малый промежуток времени, пока пробка вылетает из сосуда. Происходит уменьшение внутренней энергии воздуха в сосуде, которое проявляется в понижении его температуры. Это приводит к конденсации водяных паров, то есть к образованию тумана.
Адиабатный процесс, как и все изопроцессы, можно наглядно представить в виде графика зависимости давления газа от его объёма. График адиабатного процесса в координатах p, V называется адиабатой.
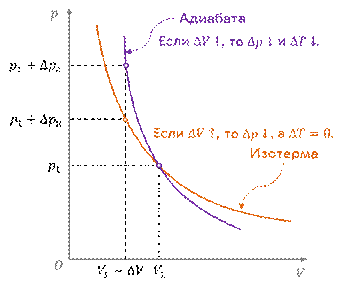
Обратите внимание, что адиабата очень похожа на график изотермического процесса. Отличие состоит лишь в том, что одному и тому же изменению объёма при адиабатном процессе соответствует большее изменение давления, чем при изотермическом. Это объясняется тем, что в случае адиабатного расширения давление уменьшается не только за счёт увеличения объёма газа (и уменьшения концентрации частиц), но и за счёт уменьшения температуры.
Дата добавления: 2021-05-18; просмотров: 97; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
