Титрование сильных и слабых одноосновных кислот
Построение кривых титрования
Титрование — метод количественного анализа, основанный на измерении объема раствора реактива с точно известной концентрацией, прореагировавшего с определенным объемом раствора анализируемого вещества.
Титриметрический (объёмный) анализ является одним из важнейших видов количественного анализа. Его основными достоинствами являются точность, быстрота исполнения и возможность применения для определения самых разнообразных веществ.
Основной операцией титриметрического анализа является титрование – постепенное смешивание веществ до полного окончания реакции. Обычно в титриметрическом анализе используются растворы веществ. В ходе титрования раствор одного вещества постепенно приливается к раствору другого до тех пор, пока вещества полностью не прореагируют.
При титровании расходуется количество реагента, эквивалентное количеству титруемого вещества. Следовательно, возникает необходимость обнаружения момента окончания реакции, т.е. точки эквивалентности.
Точкой эквивалентности называется момент, наступающий в ходе титрования, когда реагирующие вещества полностью прореагировали. В этот момент они находятся в эквивалентных количествах, т. е. достаточных для полного, без остатка, протекания реакции.
Для выбора метода обнаружения конца титрования, выбора индикатора и оценки погрешности титрования полезны кривые титрования.
|
|
|
Кривые титрования представляют собой графическое изображение зависимости какого-либо параметра системы, связанного с концентрацией титруемого вещества или титранта от состава раствора в процессе титрования. Такими параметрами могут служить рН, электропроводность и т.д.
Для расчета этих параметров пользуются выражениями констант равновесия соответствующих химических реакций, протекающих между титруемым веществом и титрантом.
Существует 2 способа построения кривых титрования.
Первый основан на расчете переменного (изменяющегося) параметра при изменении состава раствора в отдельные моменты титрования. Для этого используют формулы, связывающие переменный параметр с концентрацией титруемого вещества или титранта.
Второй способ предполагает вывод и использование общего уравнения кривой титрования.
Первый способ более прост, второй – удобен при расчете кривых с использованием ЭВМ.
Если для построения кривых титрования не используется общее уравнение, то необходимо провести четыре типа расчетов, соответствующих различным участкам кривой:
1. до начала титрования
2. до точки эквивалентности (область буферных растворов)
|
|
|
3. в точке эквивалентности
4. за точкой эквивалентности
По оси абсцисс откладывают либо объем титранта (в мл), либо степень оттитрованности, т.е. долю оттитрованного вещества.
Степень оттитрованности f выражается отношением количества добавленного титранта к исходному количеству титруемого вещества:

где  – концентрация растворов титранта и титруемого вещества соответственно
– концентрация растворов титранта и титруемого вещества соответственно
Vo – исходный объем титруемого вещества
VT – добавленный объем титранта
Величину f можно выразить в процентах. Очевидно, что в начале титрования
f = 0, до точки титрования f < 0 (< 100%), за точкой эквивалентности f > 0 (>100%).
По оси ординат откладывают либо переменный параметр, либо логарифм переменного параметра. В первом случае получается линейная кривая титрования, во втором – логарифмическая.
Для выбора индикатора и определения погрешности титрования более удобны логарифмические кривые титрования.
Логарифмическая кривая представляет собой S-образную кривую, на которой имеются области плавного и резкого изменения логарифма переменного параметра. Резкое изменение наблюдается вблизи точки эквивалентности; эта область называется скачком титрования.
|
|
|
Титрование сильных и слабых одноосновных кислот
Таблица (HCl)
| f,% | Не оттитровано HCl,% | Избыток NaOH,% | рН-определяющий компонент | Формула расчета [Н+] | рН |
| 0 | |||||
| 50,0 | |||||
| 90,0 | |||||
| 99,0 | |||||
| 99,9 | |||||
| 100,0 | |||||
| 100,1 | |||||
| 101,0 | |||||
| 110,0 |
Способы вычисления рН в моменты титрования соответствующие различным участкам кривой титрования.
До начала титрования.
Раствор содержит только титруемую кислоту, следовательно рН раствора до начала титрования рассчитывают по исходной концентрации кислоты:
При титровании сильной кислоты – [Н+] = Со
слабой кислоты – [Н+] = 
До точки эквивалентности.
Раствор представляет собой смесь неоттитрованной кислоты и сопряженного основания. Выбор формулы для расчета рН зависит от силы титруемой кислоты.
При титровании сильной кислоты рН рассчитывают по концентрации неоттитрованной кислоты, поскольку сопряженное основание слишком слабо, чтобы оказать влияние на кислотно-основное равновесие. Поэтому
|
|
|
[Н+] = 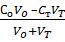
Если Со =СТ, то
[Н+] = 
При титровании слабой кислоты в любой момент титрования в растворе существует буферная смесь, состоящая из неоттитрованной уксусной кислоты и образовавшегося ацетата натрия. Поскольку рН буферной смеси не зависит от разбавления, расчет проводят без учета изменения объема раствора по формуле:
[Н+] = 
где f – степень оттитрованнности, %
В точке эквивалентности.
Раствор содержит только основание А– в количестве, равном исходному количеству титруемой кислоты.
При титровании сильной кислоты образуется очень слабое сопряженное основание, поэтому рН раствора определяется кислотно-основными свойствами растворителя и рассчитывается по формуле:
[Н+] = 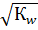
При титровании слабой кислоты образуется сопряженное основание с более ярко выраженными свойствами, чем у растворителя, поэтому рН раствора определяется концентрацией основания и рассчитывается по формуле:
[Н+] = 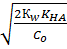
За точкой эквивалентности.
Раствор представляет собой смесь слабого и сильного оснований. Более сильное основание подавляет диссоциацию слабого и поэтому рН раствора определяется избытком добавленного титранта.
[Н+] = 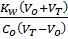
Дата добавления: 2021-05-18; просмотров: 115; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
