Нахождение содержания массовых долей элементов в сложном веществе.
Цели урока:
Повторить основные понятия химии, изученные в 7 классе (вещество, смесь, атом, молекула, ион, химический элемент, относительные атомная и молекулярная массы, простые и сложные вещества, химическая формула, физические и химические явления, химические уравнения)
Тип урока: обобщение и систематизация знаний.
Понятия и термины: химия, вещество, смесь, атом, молекула, ион, химический элемент, относительные атомная масса, относительная молекулярная масса, простое вещество, сложное вещество, химическая формула, физические явления, химические явления, химические уравнения.
Повторение - мать учения .
Ребята!
В курсе 7 класса мы с вами изучили основные понятия и некоторые законы, которыми пользуются в химии. Приобрели практические умения и навыки.
1. Назовите основные химические понятия, которые мы изучали в курсе 7 класса. (Подсказываю: вещество, чистое вещество, смесь, простое вещество, сложное вещество, атом, молекула, химический элемент, химическая формула, химические уравнения, химические явления, физические явления, относительная атомная масса, относительная молекулярная масса, валентность).
Используя учебник или интернет, вспомните, пожалуйста, определения выше написанных терминов.
2. Какие навыки и умения приобрели, изучая курс 7 класса? (Напоминаю: умения составлять формулы по валентности и определять валентность, находить относительную молекулярную массу вещества, записывать химические уравнения, находить массовую долю элемента в веществе.).
|
|
|
Алгоритм составления формул по валентности
| Порядок выполнения действий | Пример |
| 1.Записать символы элементов, над ними привести значения их валентности. | ІІІ І А1С1 |
| 2. Найти наименьшее общее кратное (НОК) значений валентности. | ІІІ І А1С1 НОК = 3 |
| Порядок выполнения действий | Пример |
| 3. Делением НОК на значение валентности первого элемента получить число атомов первого элемента. | 3:3 = 1 |
| 4. Делением НОК на значение валентности второго элемента получить число атомов второго элемента. | 3:1 = 3 |
| 5. Записать формулу вещества. | А1С13 |
Задание. Составить формулы по валентности. Ребята! Проверьте сами себя!
III II IV I I II VI II
Fe O, C H, Na S, S O
II II IV I III II IV II
Mg O, Si H, B O, S O
II II I I II I VIII II
C O, K Cl, Pb I, Os O
III II I III I II IV II
Al S, Na P, Ag O, Sn O
III I III II I I IV II
Al Cl, B O, H I, C O
Алгоритм определения валентности
| Алгоритм определения валентности | Пример | |
| 1. Запишите формулу вещества. | H2S, Cu2O | |
| 2. Обозначьте известную валентность элемента | I H2S, | II Cu2O |
| 3. Найти наименьшее общее кратное (НОК) между известным значением валентности и индексом этого элемента. | 2 I H2S | 2 II Cu2O |
| 4. Наименьшее общее кратное разделить на индекс другого элемента, полученное число и есть значение валентности. | 2 I II H2S | 2 I II Cu2O |
| 5. Сделайте проверку, то есть подсчитайте число единиц валентностей каждого элемента | I II H2S (2=2) | I II Cu2O (2=2) |
Задание. Составить формулы по валентности FeO, K2O, Cr2O3, P2O5 .
|
|
|
Ребята! Выполните самопроверку своих умений.
SO3, As2O5, Fe2O3, Cl2O7
B2O3, N2O, Mn2O7, HgO
SiO2, PH3, PbO, Na3N
Относительная молекулярная масса — это отношение массы Молекулы к 1/12 массы атома Карбона.
Относительную молекулярную массу сокращенно обозначают Mr. Эта величина, как и относительная атомная масса, не имеет размерности.
Математическая формула для ее вычисления, исходя из массы молекулы:
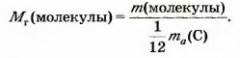
Найдем относительную молекулярную массу кислорода, использовав массы молекулы кислорода (5,32 • 10-23 г) и атома Карбона (1,994 • 10-23 г):

Значительно проще вычислять относительную молекулярную массу, используя относительные атомные массы.
Относительная масса молекулы равна сумме относительных масс атомов, которые входят в ее состав.
Найдем относительные молекулярные массы кислорода и воды, взяв из периодической системы Менделеева значения относительных атомных масс Оксигена и Гидрогена:
|
|
|
Mr(O2) = 2Аr(0) = 2 • 16 = 32;
Mr(H2O) = 2Ar(H) +Ar(O) = 2 • I + 16 = 18.
Задание. Вычислите относительные молекулярные массы азота N2 и аммиака NH3.
Вычислите относительные молекулярные массы: а) оксид железа (III); б) оксида фосфора (V), в) оксида марганца (VII).
Нахождение содержания массовых долей элементов в сложном веществе.
Дано:
H3PO4
Найти:
w%(H)
w%(P)
w%(O)
Решение:
1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав фосфорной кислоты
Ar(H)=1
Ar(P)=31
Ar(O)=16
2. Вычисляем относительную атомную массу соединения
Mr(H3PO4) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98
3. Вычисляем массовые доли элементов по формуле:
w(элемента) = (n· Ar(элемента) · 100%) / Mr(вещества)
w(H) = n(H)·Ar(H)·100% / Mr(H3PO4) = 3·1·100% / 98 = 3,06%
w(P) = n(P)·Ar(P)·100% / Mr(H3PO4) = 1·31·100% / 98 = 31,63%
w(O) = n(O)·Ar(O)·100% / Mr(H3PO4) = 4·16·100% / 98 = 65,31%
Проверка
Сумма значений массовых долей всех элементов должна составить 100% w(H) + w(P) + w(O) = 100%
Подставляем значения,
3,06% + 31,63% + 65,31% = 100%
Таким образом, массовые доли элементов в фосфорной кислоте вычислены правильно.
|
|
|
Ответ:
w(H) = 3,06%
w(P) = 31,63%
w(O) = 65,31%
Задания для усвоения пройденного материала:
Определить массовую долю элемента S в H2SO4.
Определить массовую долю элемента О в Fe(OH)3.
Определите массовую долю элемента Al в Al2(SO4)3.
Определите массовую долю элемента Fe в Fe3O4.
Определите массовую долю элементов H и O в H2O2
Химические уравнения
Закон сохранения массы веществ в химических реакциях иллюстрируют химические уравнения. Химическим уравнением называют условная запись химической реакции с помощью химических формул, математических знаков и коэффициентов. Коэффициенты записывают перед формулами веществ. Назначение коэффициентов в том, чтобы увеличивать число атомов каждого элемента для уравнивания их в обеих частях химического уравнения. Составлять уравнения химических реакций необходимо в определенной последовательности. В качестве примера рассмотрим химическое уравнение синтеза аммиака NH3.
1. Составляем схему взаимодействия: слева записываем формулы исходных веществ (реагентов), ставя между ними знак "плюс". Справа записываем формулу продукта реакции. Между левой и правой частями схемы ставим знак "стрелка".
N2 + H2 → NH3
2. Сравним количество атомов азота, поставив коэффициент два перед формулой ен-аш-три:
N2 + H2 → 2NH3
3. Сравним количество атомов водорода, поставив коэффициент три перед формулой аш-два. Сравним числа атомов каждого элемента в левой и правой частях схемы. Поскольку они одинаковые, вместо знака "стрелка" поставим знак "равно":
N2 +3 H2 → 2NH3
Надо помнить, что при преобразовании схемы химической реакции в уравнение индексы в формулах как реагирующих веществ, так и продуктов реакций менять нельзя.
Задание: расставить коэффициенты в уравнениях реакций
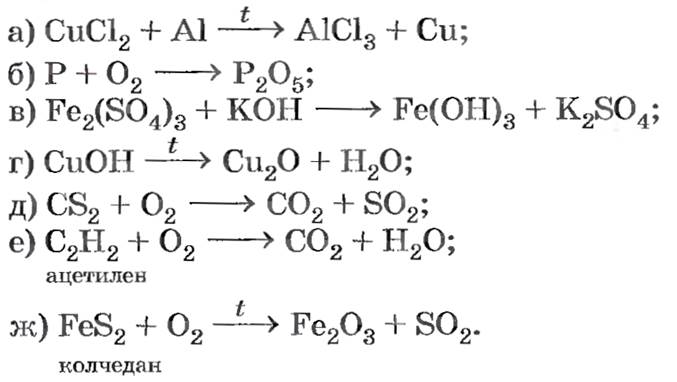
Дата добавления: 2021-05-18; просмотров: 55; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
