Растворимость твердых веществ в жидкости
Коллигативные свойства растворов
Контрольные вопросы
Определение понятия «раствор». Способы выражения концентрации растворов.
Закон Рауля и закон Генри. Идеальные и неидеальные растворы.
Изменение температуры затвердевания и кипения растворов. Криоскопия. Эбулиоскопия. Уравнение Шредера. Осмос. Ограниченная растворимость жидкостей. Закон распределения. Коэффициент распределения вещества между двумя несмешивающимися жидкостями. Экстрагирование.
Общая характеристика растворов. Классификация растворов. Закон Рауля.
Раствором называется однофазная гомогенная система, образованная не менее, чем двумя компонентами. Растворы могут быть в 3-х агрегатных состояниях:
-твердом (твердые растворы, например металлические и солевые сплавы)
-жидком
-газообразном (смесь газов, например воздух).
В жидких растворах различают растворитель и растворенное вещество. Растворителем называют жидкий компонент раствора, который имеется в избытке по сравнению с другими компонентами. Остальные компоненты, которые находятся в растворе в меньшем количестве, называются растворенными веществами.
Образование жидкого раствора связано:
1) с изменением структуры растворителя
2) процессом диффузии частиц растворяемого вещества в растворе
3) изменением характера межмолекулярного взаимодействия.
Образование жидких растворов обычно сопровождается процессом сольватации – взаимодействием частиц растворенного вещества с молекулами растворителя (если растворитель – вода, процесс называется гидратацией).
|
|
|
Одной из важных характеристик раствора является его состав, который выражают как количество растворенного вещества, отнесенное к определенному количеству раствора или растворителя.
Количественный состав в ФХ наиболее часто выражают через:
1. Массовая доля - массы растворенного вещества к общей массе раствора. 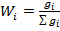
где gi – количество (масса) i-го компонента в граммах.
2. Мольная доля – отношение числа моль i-го компонента к общему числу моль раствора.

где ni – количество i-го компонента в молях.
3. Объемная доля – отношение объема i-го компонента к общему объему раствора.

где Vi – объем i-го компонента в м3.
4. Молярность – отношение количества i-го компонента в молях к объему раствора . 
где V – объем раствора, м3
5. Моляльность – количество i-го компонента в молях в 1000 г растворителя.

Классификация растворов
При заданной температуре общее давление раствора складывается из парциальных давлений, образующих его компонентов.
|
|
|
Парциальное давление – давление отдельно взятого компонента газовой смеси. Общее давление смеси является суммой парциальных давлений ее компонентов.
Например, раствор образован компонентами А и В, тогда общее давление Р =РА + РВ.
На зависимость общего и парциального давлений от концентрации индивидуальные физико-химические свойства компонентов влияют по разному. На этом основании различают 3 группы растворов:
1. Идеальные – раствор, в котором силы взаимодействия между молекулами разных видов равны силам взаимодействия между молекулами одного вида, т.е. в условной записи FA – B = FA – A = FB – B
Идеальные растворы могут образовываться из веществ, молекулы которых сходны по полярности, строению и химическому составу. Например, бензол – толуол, гексан – гептан и др. смешение таких веществ происходит без поглощения или выделения теплоты, т.е. ∆Н = 0 и без изменения объема, ∆ V = 0, т.е. так, что объем полученного раствора равен сумме объемов компонентов.
Поведение идеального раствора подобно поведению идеального газа, зависит только от концентрации компонентов и температуры.
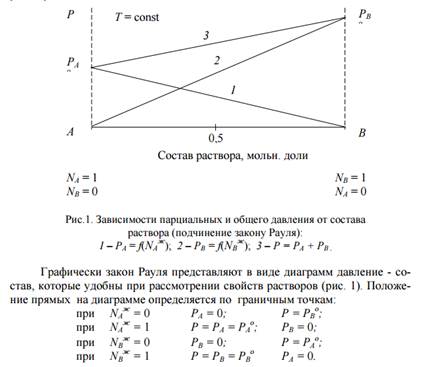
Для идеальных растворов выполняется закономерность, называемая законом Рауля. Pi = Pi о ∙ Ni ж
|
|
|
Уравнение является выражением закона Рауля, согласно которому: при постоянной температуре равновесное парциальное давление пара Pi каждого компонента равно давлению пара Pi о этого компонента в чистом виде при данной температуре, помноженному на его мольную долю Ni ж в жидкой фазе (в растворе).
Зависимость парциальных и общего давлений пара от состава для идеального раствора имеет линейный характер и можно представить графически (рис 1):
2. Реальные – растворы, в которых силы взаимодействия между молекулами разных видов не равны силам взаимодействия между молекулами одного вида, т.е. FA–A ≠ FA–B ≠ FB–B
При образовании реального раствора ∆Н ≠ 0 и ∆ V ≠ 0. В реальных системах наблюдаются отклонения от закона Рауля, вызываемые взаимодействием молекул.
Рассмотрим 2 типа отклонений от закона Рауля:
1. Если FB – B > FA – B < FA – A , FA – B < ( FB – B ≈ FA – A ), т.е. силы взаимодействия между однородными молекулами больше силы взаимодействия между разнородными молекулами, то требуется меньшая затрата энергии для перевода в пар молекул В, окруженных молекулами А, или молекул А, окруженных молекулами В, такой раствор образуется из чистых компонентов с поглощением теплоты ∆Н > 0 и с увеличением объема системы при растворении ∆ V > 0. Вследствие увеличения числа частиц в растворе, парциальные давления (и общее давление пара) оказываются больше, рассчитанных по уравнению Рауля. Это положительные отклонения от закона Рауля, (рис.2)
|
|
|
Pi > Pi о ∙ Ni ж
Для реальных растворов зависимости общего и парциального давлений пара от состава раствора имеют нелинейный характер, например вода – метанол, ацетон – этанол, ацетон - сероуглерод:
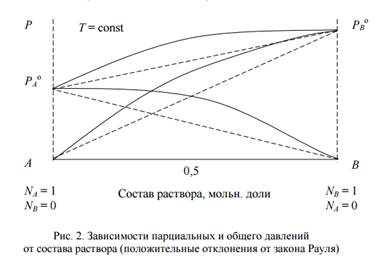 В этом случае облегчается переход молекул из жидкой фазы в газообразную по сравнению с чистыми жидкостями и затрудняется образование растворов. Положительные отклонения наблюдаются при различной полярности компонентов раствора и наличии в исходных жидкостях ассоциатов. В случае больших положительных отклонений, жидкости могут расслаиваться.
В этом случае облегчается переход молекул из жидкой фазы в газообразную по сравнению с чистыми жидкостями и затрудняется образование растворов. Положительные отклонения наблюдаются при различной полярности компонентов раствора и наличии в исходных жидкостях ассоциатов. В случае больших положительных отклонений, жидкости могут расслаиваться.
2. Если FB – B < FA – B > FA – A , FA – B > ( FB – B ≈ FA – A ), то разные виды молекул стремятся к взаимодействию типа притяжения, т.е. энергия (сила) взаимодействия разнородных молекул больше, чем однородных. В этом случае затрудняется переход молекул в газообразную фазу и облегчается образование растворов. Это наблюдается при наличии тенденции к химическому взаимодействию между разнородными молекулами, приводящей к возникновению химических соединений, образованию водородных связей и сольватов. При этом образование сопровождается выделением теплоты ∆Н < 0 и уменьшением объема, ∆ V < 0. Уменьшение числа частиц в растворе, по сравнению с их числом в чистых компонентах, приводит к уменьшению парциальных давлений пара компонентов. Это отрицательные отклонения от закона Рауля, например вода – соляная кислота, хлороформ – ацетон, хлороформ – бензол. Общее давление над раствором (сплошные линии на рис. 3) меньше, чем вычисленные (идеальные) по закону Рауля (пунктирные линии на рис. 3).
Pi < Pi о ∙ Ni ж

3. Предельно разбавленным называется раствор, в котором концентрация растворенного вещества бесконечно мала. Для такого раствора, давление пара растворителя подчиняется закону Рауля:
P 1 = P 1 о ∙ N 1 ж = P 1 о ∙ (1 – N 2 ж )
Индекс 1 соответствует растворителю. Растворяемое вещество (2) не подчиняется закону Рауля.
Растворенным обычно называют компонент, количество которого мало по сравнению с другим компонентом – растворителем.
Для растворенного вещества (индекс 2) характерен закон Генри, согласно которому: при постоянной температуре парциальное давление пар растворенного жидкого (или газообразного) вещества пропорционально его мольной доле, т.е.
P 2 = К2 ∙ N 2 ж ,
К2 – коэффициент пропорциональности, называемой константой Генри. К2 зависит от природы компонентов раствора, от температуры, но не зависит от давления (К2≠ f(P)) и является мерой растворимости газа в жидкости.
Растворимость твердых веществ в жидкости
На растворимость твердых веществ в жидкостях влияют главным образом природа растворенного вещества, природа растворителя, температура.
Процесс растворения твердых веществ в жидкости можно разделить на две стадии: плавление твердого вещества и смешение двух жидкостей. При образовании идеального раствора (∆Нсмеш.= 0) теплота растворения равна теплоте плавления и имеет положительный знак:
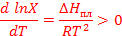
Согласно полученному уравнению Шредера с увеличением температуры идеальная растворимость твердого вещества возрастает и зависит от природы только растворимого вещества, но не зависит от природы растворителя.
Дата добавления: 2021-05-18; просмотров: 171; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
