Микробиологическая диагностика коклюша и паракоклюша
ВОЗБУДИТЕЛИ БАКТЕРИАЛЬНЫХ РЕСПИРАТОРНЫХ И ДРУГИХ ВОЗДУШНО-КАПЕЛЬНЫХ ИНФЕКЦИЙ
Возбудители инфекций, передающихся воздушно-капельным путем (табл. 9), относятся к разным семействам, родам и видам, которые существенно отличаются друг от друга по морфологии, культуральным и биохимическим свойствам, антигенной структуре. Респираторные инфекции разной этиологии клинически диагностируются как острые респираторные заболевания (ОРЗ) или пневмонии. Их возбудители могут быть идентифицированы только с помощью микробиологического исследования. В этиологии ОРЗ и пневмоний важную роль играют сложные микробные ассоциации, преимущественно бактериальные и вирусно-бактериальные.
Таблица 9. Возбудители бактериальных воздушно-капельных инфекций
| Наименование возбудителя | Заболевание или синдром |
| Staphylococcus aureus (+) А Streptococcus pneumonia (+) А S. pyogenes (+) А Klebsiella pneumonia (-) А Mycoplasma pneumonia А Chlamydia psittaci Coxiella burnetii Escherichia coli (-) А Enterobacter spp. (-) А Proteus spp. (-) А Bacteroides spp. (-) Ан Peptococcus spp. (+) Ан Vellonella spp. (-) Ан Haemophilus influenzae (-) А Bordetella pertussis (-) А Bordetella parapertussis (-) А Corynebacterium diphtheriae (+) А Mycobacterium tuberculosis (к/у) А Actinomyces bovis (+) Ан Neisseria meningitides (-) А | Пневмония То же -//- -//- -//- -//- Q-лихорадка (пневмония) Пневмония (аспирационная) То же -//- Пневмония, абсцесс легких То же Пневмония, синусит, отит Пневмония, бронхит Коклюш Паракоклюш Дифтерия Туберкулез легких Актиномикоз легких Менингококковая инфекция |
Условные обозначения: (+) – грамположительные, (-) – грамотрицательные, (к/у) – кислотоустойчивые, А – аэробы, Ан – анаэробы.
|
|
|
Другие бактерии вызывают более избирательные поражения. Так, В ordetella pertussis , как правило, локализуется в эпителии дыхательных путей. Со rynebacterium diphteriae вызывают патологический процесс главным образом в зеве, кроме того, возникают системные поражения, связанные с токсинемией. Менингококки локализуются в носоглотке и вызывают фарингиты, назофагиты, а проникая в мозговые оболочки и кровь, - менингит и сепсис. К бактериям, вызывающим специфические поражения респираторного тракта, относятся возбудители туберкулеза и актиномикоза. Вместе с тем эти бактерии поражают также и другие органы (кишечник, печень, кости, суставы и др.). Вызванные всеми упомянутыми бактериями заболевания существенно различаются по клинической картине и патогенезу.
Для выявления бактерионосителей используют главным образом бактериоскопический и бактериологический методы, иногда биопробы. Экспресс-диагностика осуществляется иммунофлюоресцентным методом. Микробиологическая диагностика респираторных заболеваний, вызванных стафилококками, стрептококками, а также анаэробными бактериями проводится методами, которые излагаются в предыдущих темах.
|
|
|
Лабораторная диагностика менингококковой инфекции, коклюша и дифтерии
Задания для выполнения лабораторной работы
1. Указать приспособления (виды тампонов) для взятия материала при менингококковой инфекции, коклюше и дифтерии.
2. Микробиологическое исследование при менингококковой инфекции, коклюше и паракоклюше:
а) указать материал, подлежащий исследованию;
б) бактериоскопический метод: микроскопировать готовые мазки из спинномозговой жидкости и носоглотки, сделать заключение и наметить план дальнейшего исследования;
в) бактериологическое исследование и иммунохимический метод;
г) по результатам, полученным из лаборатории, сделать заключение.
3. Микробиологическое исследование при дифтерии:
а) указать материал, подлежащий исследованию;
б) бактериоскопический метод: микроскопировать мазки из материала, взятого из зева лиц с подозрением на дифтерию или бактерионосительство, сделать предварительное заключение и наметить ход дальнейшего исследования для подтверждения бактериоскопического диагноза;
|
|
|
в) бактериологический метод: описать рост культуры, полученной на свернутой сыворотке, и колоний на теллуритовой среде, отметить результаты готовых посевов исследуемых культур на средах "пестрого" ряда, в случае обнаружения С. diphtheriae определить ее токсигенность. Сопоставить данные бактериоскопического и бактериологического исследований с целью идентификации выделенной культуры и поставить окончательный микробиологический диагноз.
4. Дать краткую характеристику диагностическим, профилактическим и лечебным препаратам.
Методические указания
Микробиологическая диагностика менингококковой инфекции
Материал для исследования: спинномозговая жидкость, кровь, мазки со слизистой оболочки верхних отделов носоглотки, аспират из высыпных элементов. При обследовании на носительство материал из верхних отделов носоглотки берут специальным носоглоточным тампоном (который на 3/4 длины сгибают под углом 45°). При доставке в лабораторию его предохраняют от охлаждения и высушивания, поскольку менингококк очень чувствителен к воздействию этих факторов. Спинномозговую жидкость берут в количестве 2-5 мл и делят на две части: одну центрифугируют и исследуют осадок, к другой добавляют полужидкую питательную среду и выдерживают при 37 °С для накопления бактерий. Из исследуемого материала готовят мазки и производят посевы.
|
|
|
Бактериоскопическое исследование (схема 8). Мазки из осадка спинномозговой жидкости окрашивают по методу Грама и микроскопируют. При наличии гноя в большинстве случаев обнаруживаются типичные грамотрицательные диплококки, имеющие характерное расположение внутри лейкоцитов, что позволяет сделать окончательное заключение о менингококковой инфекции. При микроскопии мазков из носоглотки бактерионосителей наряду с менингококком обнаруживаются грамположительные стафилококки и стрептококки, а также непатогенные нейссерии ( Moraxella spp . и др.). Дифференцировать их по морфологическим признакам затруднительно.
Бактериологическое исследование.Исследуемый материал засевают петлей на чашки с питательным агаром, содержащим кровь, сыворотку крови или асцитическую жидкость. В среды добавляют антибиотик ристомицин (150 ЕД/мл), который задерживает размножение грамположительных кокков, содержащихся в исследуемом материале, и тем самым способствует выделению чистой культуры менингококка. Образование колоний менингококка на этих средах наблюдается через 48 ч после инкубации посевов при 37 °С в атмосфере с повышенным содержанием СО2 (3-10 %) и высокой влажностью. В отличие от других кокков колонии менингококка величиной с булавочную головку прозрачны, имеют голубоватый оттенок и ровные края. Такие колонии пересевают в пробирку со скошенным агаром для получения чистой культуры. Идентификацию чистой культуры, дифференциацию от сапрофитных нейссерии, обитающих в носоглотке, проводят по ряду культуральных и биохимических признаков. Так, менингококк растет только в присутствии нативного белка, в то время как другие нейссерии размножаются на простых средах и образуют пигмент; на средах Гисса с добавлением сыворотки крови менингококк ферментирует глюкозу и мальтозу до кислоты.
Схема 8. Микробиологическое исследование при менингококковой инфекции и бактерионосительстве
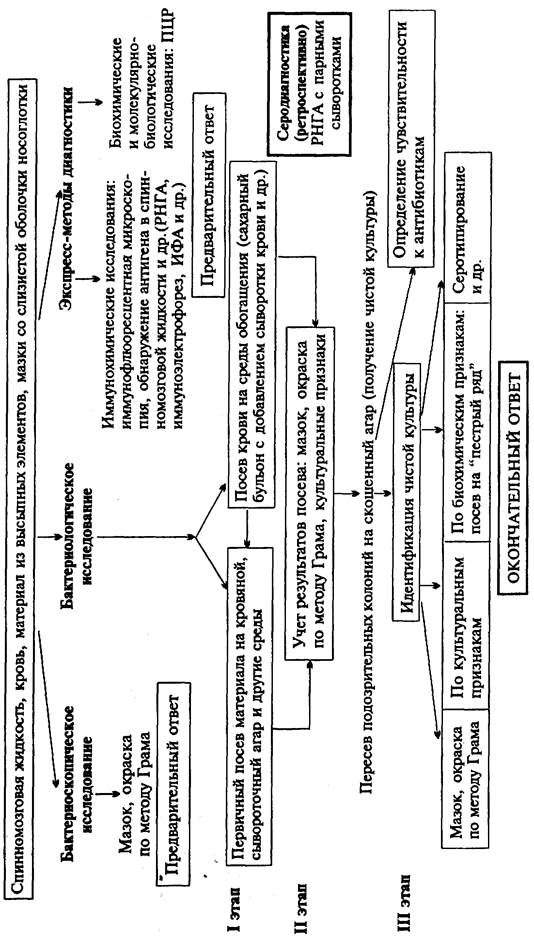
|
Фаготипирование менингококка проводят для эпидемиологического анализа. Определение серовара производят в реакции агглютинации в пробирках.
Экспресс-методы диагностики. Иммунохимические исследования. Для выявления антигенов менингококков в мазках из исследуемого материала используют метод встречного иммуноэлектрофореза. Антигены возбудителя также могут быть обнаружены в материале от больного в реакциях непрямой латекс-агглютинации, РНГА и др.
Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР.
Серодиагностика. Для ретроспективного подтверждения диагноза используют РНГА с парными сыворотками.
Микробиологическая диагностика коклюша и паракоклюша
Материал для исследования: мокрота, слизь из носоглотки. Материал берут стерильным ватным тампоном из носоглотки больного ребенка. Для взятия материала у маленьких детей тампон, приготовленный на тонкой эластичной проволоке, вводят через нос.
Бактериоскопическое исследование (схема 9).Бактериоскопический метод как таковой при диагностике коклюша не применяется. Для быстрого обнаружения и идентификации Bordetella pertussis используют иммунофлюоресцентный метод.
Бактериологическое исследование. Основной метод лабораторной диагностики коклюша. Материал для посева берут с помощью носоглоточного тампона или методом "кашлевых пластинок". Для этого в момент появления кашля открытую чашку Петри с питательной средой подносят ко рту ребенка и держат в течение 6-8 кашлевых толчков. Правильное и раннее взятие материала позволяет выделить возбудителя в начальном периоде болезни от 80-90 % больных. Материал засевают на каменноКУА или кровяные среды - картофельно-глицериновый кровяной агар (среда Борде-Жангу) и молочно-кровяной агар. В питательные среды добавляют пенициллин для угнетения роста посторонней микрофлоры. Колонии B . pertussis на указанных средах обычно появляются через 48-72 ч культивирования. B . parapertussis - несколько раньше: через 24-72 ч. Бордетеллы образуют мелкие (диаметром около 1 мм) выпуклые влажные блестящие колонии. На КУА колонии имеют серовато-кремовый цвет, а на среде Борде-Жангу приобретают жемчужный или ртутный блеск. Колонии B . parapertussis более крупные. На среде Борде-Жангу и молочно-кровяном агаре они образуют ограниченную зону гемолиза. Из колоний, выросших на чашках, готовят мазки, окрашивают их по методу Грама и микроскопируют. При наличии в мазках овоидных грамотрицательных палочек ставят ориентировочную реакцию агглютинации с коклюшной и паракоклюшной сыворотками. Затем подозрительные колонии пересевают в пробирки для дальнейшего изучения чистых культур.
Идентификацию выделенной культуры производят на основании комплексного изучения морфологических, культуральных, биохимических и серологических свойств (табл. 10). В отличие от других бордетелл B . pertussis не растет на простом питательном агаре и не изменяет цвета специальных питательных сред.
Для определения уреазы в агглютинационные пробирки вносят 0,3 мл 2 % раствора мочевины, 0,3 мл густой суспензии испытуемой культуры и 2-3 капли 0,1 % спиртового раствора фенолфталеина. В положительном случае через 20-30 мин появляется малиновое окрашивание, указывающее на расщепление мочевины уреазой.
Серологическую идентификацию бордетелл, дифференциацию видов и определение сероваров (серотипирование) проводят в реакции агглютинации с адсорбированными факторными сыворотками. При этом исходят из того, что антиген (фактор) 7 является родовым, а антиген (фактор) 1 присущ только B . pertussis , 14 - B . parapertussis и 12 - B . bronchisepticas .
Таблица 10. Дифференциальные признаки Bordetella spp .
| Признак | B.pertussis | B.parapertussis | B . bronchisepticas |
| Рост: на агаре (простом) на агаре с тирозином | - - | + (коричневая окраска) + (ярко-коричневая окраска) | + + |
| Изменение окраски: КУА аровяного агара | - - | Буро-коричневая Потемнение | - - |
| Образование уреазы | + | + | + |
| Наличие антигенов: родового видового | 7 1 | 7 14 | 7 12 |
Условные обозначения: (+) - наличие признака; (-) - отсутствие признака; цифрами обозначены номера антигенов.
При бактериологической диагностике коклюша может возникнуть необходимость дифференциации бордетелл от Наето philus influenzae , который часто встречается на слизистой оболочке дыхательных путей и вызывает пневмонии и другие воспалительные заболевания дыхательных путей. В отличие от бордетелл Н. influenzae растет только на кровяных питательных средах - кровяном агаре, "шоколадном" агаре Левинталя, содержащих гемин и коэнзим дегидрогеназы. Бактериологическое исследование продолжается не менее 5 дней.
Схема 9. Микробиологическое исследование при коклюше и паракоклюше
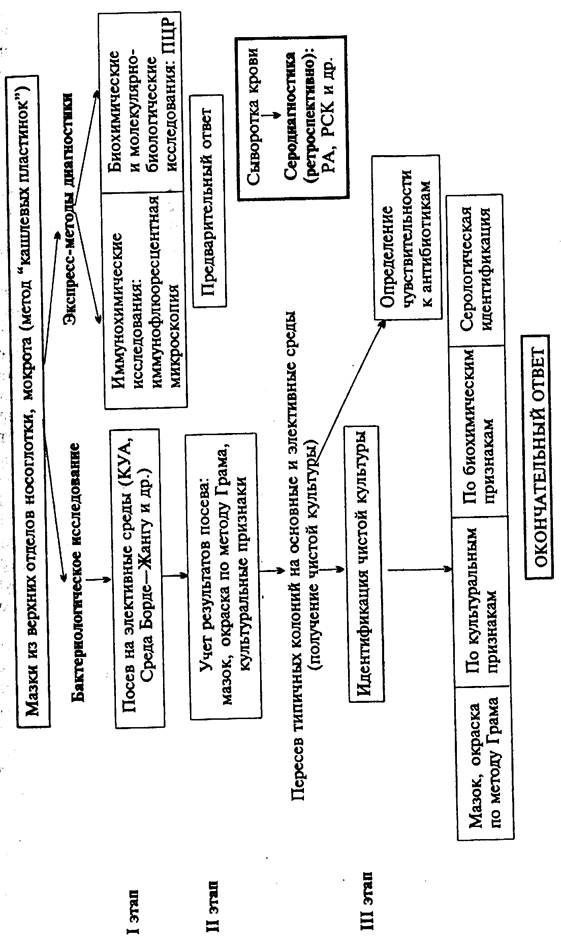
|
Экспресс-методы диагностики
Иммунохимические исследования. Метод ИФ: тампоном делают два мазка, высушивают их на воздухе и фиксируют на пламени. Один мазок обрабатывают флюоресцирующими противококлюшными антителами, другой - паракоклюшными антителами. Препараты микроскопируют в люминесцентном микроскопе, просматривая не менее 50 полей зрения. О положительном результате свидетельствует обнаружение темных бактериальных клеток с четким светящимся венчиком.
Биохимические и молекулярно-биологические исследования проводят методом ПЦР.
Серодиагностика. Реакции агглютинации и РСК применяют в основном для ретроспективного подтверждения диагноза и дифференциальной диагностики атипичных форм коклюша. Агглютинины в крови больных появляются на 3-4-й неделе заболевания в титрах 1:20 и выше. В условиях массовой вакцинации детей против коклюша диагностическое значение имеет нарастание титра антител в динамике болезни, поэтому реакцию ставят повторно через 4-5 дней.
Микробиологическая диагностика дифтерии
Материал для исследования: мазки со слизистой оболочки зева и носа, пленки с поверхности миндалин и носоглотки. Материал берут двумя ватными стерильными тампонами, один из которых используют для приготовления мазков, другой - для посева.
Бактериоскопическое исследование (схема 10). Мазки окрашивают по методу Грама, метиленовым синим по Леффлеру, по Нейссеру. Для Corynebacterium diphtheriae характерно наличие полярно расположенных зерен волютина и расположение в виде буквы "V". Corynebacterium pseudodiphtheriae и дифтероиды не имеют зерен волютина или содержат их не на концах, а по длине палочки. Кроме того, сами бактерии располагаются в виде частокола. Применение люминесцентной микроскопии позволяет повысить эффективность исследования.
При этом C . diphtheriae можно отличить от других коринебактерий по коричнево-красному свечению зерен волютина, которое они приобретают после окраски флюорохромом корифосфином. Цитоплазма этих бактерий дает зеленое или желтое свечение. Однако C . diphtheriae часто изменяют свою морфологию, в частности, при санации зева антибиотиками. В настоящее время бактериоскопическое исследование при дифтерии практически не используют в связи с его низкой надежностью (высокой частотой ложноположительных и ложноотрицательных результатов).
Бактериологическое исследование. Является ведущим методом диагностики дифтерии. Материал засевают на кровяной агар и элективные питательные среды, содержащие теллурит: среда Клауберга (питательный агар с теллуритом натрия, глицерином и дефибринированной кровью) и др. На средах с теллуритом задерживается рост кокков и другой микрофлоры зева, что способствует размножению возбудителя дифтерии. На теллуритовой среде C . diphtheriae образует черные колонии за счет восстановления теллурита (биовар gravis формирует колонии серовато-черного цвета с радиальной исчерченностью
поверхности, напоминающие цветок маргаритки, биовар mitis - круглые выпуклые колонии черного цвета). Типичные колонии, представленные грамположительными палочками булавовидной формы с характерным расположением, содержащими зерна волютина, пересевают на кровяной агар для получения чистой культуры.
Для подтверждения диагноза дифтерии в первую очередь необходимо установить токсигенность выделенной культуры. Наличие токсина определяют с помощью различных серологических реакций. Применяют также метод ПЦР, позволяющий обнаружить присутствие у выделенных бактерий t ох-гена, контролирующего синтез дифтерийного токсина. Общепринятым методом определения токсигенности являлась реакция преципитации в агаре с антитоксической противодифтерийной сывороткой. Методы ИФА и ПЦР, разработанные в последние годы, являются более чувствительными и позволяют получить результат в течение 3-5 ч.
Определение токсигенности в реакции преципитации: в чашку Петри с питательным агаром, содержащим 15-20 % лошадиной сыворотки, 0,3 % мальтозы и 0,03 % цистина, кладут полоску фильтровальной бумаги, пропитанную антитоксической противодифтерийной сывороткой, содержащей 5000 АЕ/мл. Чашку подсушивают при 37 °С в течение 30 мин и засевают исследуемые культуры в виде перпендикулярных к бумаге штрихов на расстоянии 0,6-0,8 см от края бумаги. В качестве контроля используют заведомо токсигенную культуру. Посевы инкубируют при 37 °С до следующего дня. При размножении токсигенной культуры в месте соединения токсина с антитоксическими антителами в плотной питательной среде образуется преципитат в виде белых линий - "усов".
Выделенную культуру идентифицируют и дифференцируют от сходных с ней непатогенных коринебактерий по морфологическим особенностям, культуральным и биохимическим признакам: пробы на цистиназу, уреазу, ферментация углеводов и др. (табл. 11).
В случае выделения нетоксигенной культуры ставят дополнительную реакцию агглютинации с противодифтерийной сывороткой с целью выявления видоспецифического антигена C . diphtheriae .
Для определения цистиназы (проба Пизу) в столбик питательного агара с цистином уколом засевают исследуемую культуру. Посевы инкубируют при 37 °С до следующего дня. C . diphtheriae вызывают почернение среды по ходу посева (в результате образования сульфида свинца), вокруг которого появляется зона коричневого цвета, а на глубине 1 см от поверхности агара в среде образуется коричневое "облачко".
Схема 10. Микробиологическое исследование при дифтерии
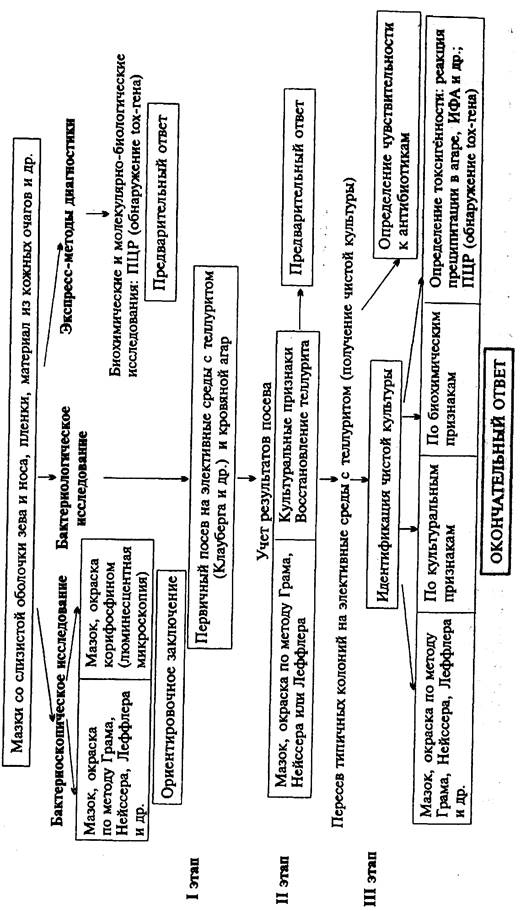
|
Таблица 11. Свойства C. diphtheriae и сходных с ней коринебактерий
| Вид | Зерна волютина | Гемолиз | Ферментация | Токси-генность | Цистиназа | Уреаза | Агглюти-нация противо- дифтерийной сыворотки | ||
| сахарозы | глюкозы | крахмала | |||||||
| C.diphtheriae биовар gravis биовар mitis | + + | - + | - - | + + | + - | +- +- | + + | - - | + + |
| C.xerosis | +- | - | + | + | - | - | +- | - | - |
| C.pseudo-diphtheriticum | +- | - | - | - | - | - | - | + | - |
Условные обозначения: (+) – наличие признака у 85-100 % штаммов; (-) – отсутствие признака; (+ -) – наличие признака у 16-84 % штаммов.
Для определения уреазы (проба Закса) готовят спиртовой раствор мочевины и раствор индикатора - фенолового красного, которые перед употреблением смешивают в соотношении 1:9 и разливают по 1-2 мл в агглютинационные пробирки. Затем исследуемые бактерии петлей вносят и растирают по стенке пробирки. После 20-30-минутной инкубации при 37 °С наблюдают расщепление мочевины уреазой, в результате чего среда приобретает красный цвет.
Экспресс-методы диагностики.
Исследуемый материал, полученный из очага инфекции, используют для обнаружения tox-гена C . diphtheriae с помощью ПЦР.
Диагностические, профилактические и лечебные препараты
Преципитирующие антименингококковые сыворотки. Применяют с диагностической целью для обнаружения менингококкового антигена в спинномозговой жидкости (методом встречного иммуноэлектрофореза).
Эритроцитарные антительные менингококковые диагностикумы. Применяют для обнаружения антигенов N . meningitidis в спинномозговой жидкости в РНГА.
Коклюшная вакцина. Содержит взвесь В.ре rtussis , убитых формалином. Применяют для обязательной активной специфической профилактики коклюша. Входит в состав АКДС (адсорбированная коклюшно-дифтерийно-столбнячная вакцина), которая включает также очищенные концентрированные дифтерийный и столбнячный анатоксины, адсорбированные на гидрате оксида алюминия.
Иммуноглобулин нормальный человеческий. Получен из плацентарной или венозной крови человека. Содержит специфические антитела против возбудителей многих инфекционных заболеваний, в том числе возбудителя коклюша. Применяют для создания пассивного иммунитета с целью профилактики и лечения коклюша.
Агглютинирующие адсорбированные (факторные) сыворотки. Применяют для серологической дифференциации возбудителей коклюша.
Противодифтерийная антитоксическая сыворотка. Получена из крови лошадей, гипериммунизированных дифтерийным анатоксином, очищена и концентрирована методом диаферм-3. Активность сыворотки изменяется в международных единицах. Применяют для экстренной профилактики и лечения дифтерии за счет создания пассивного иммунитета.
Агглютинирующая противодифтерийная сыворотка (поливалентная и типовые). Применяют для дифференциации C . diphtheriae .от дифтероидов.
Антимикробные препараты: пенициллин и другие b-лактамы, хлорамфеникол, рифампицин, сульфаниламиды, тетрациклин, эритромицин.
Дата добавления: 2021-04-24; просмотров: 82; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
