За каждое уравнение по 2 балла
Школьный этап Всероссийской олимпиады школьников по химии в Иловлинском муниципальном районе в 2016/2017 учебном году
Решения и рекомендации по оцениванию
Победители и призеры школьного этапа определяются согласно Положению о Всероссийской олимпиаде по результатам выполнения работ, сведенным в ранжированные по мере убывания набранных участниками баллов итоговые таблицы по каждому классу участников. Победителем, призером школьного этапа олимпиады признается участник, набравший не менее 50 процентов от максимально возможного количества баллов по итогам оценивания выполненных олимпиадных заданий. Победителями и призерами школьного этапа признаются все участники, набравшие более 50 процентов баллов.
Жюри школьного этапа олимпиады принимает для оценивания закодированные (обезличенные) олимпиадные работы участников олимпиады.
Система оценивания
Система оценивания строится на поэлементном анализе возможного решения участником задачи. Следует обратить внимание, что в материалах представленные решения отражают один из вероятных подходов к решению задачи. Поэтому при проверке работ члены жюри должны учитывать, что участник может прийти к ответу другим путем. При оценивании работ участников максимальный балл ставится за полностью выполненное задание, независимо от способа решения.
В каждом задании баллы выставляются за каждый элемент (шаг) решения. Причем балл за один шаг решения может варьироваться от 0 (решение соответствующего элемента отсутствует или выполнено полностью неверно) до максимально возможного балла за данный шаг. Если есть отдельные верно выполненные части решения элемента, оценка лежит от нуля до максимального балла.
|
|
|
Баллы за правильно выполненные элементы решения суммируются.
Шаги, демонстрирующие умение логически рассуждать, творчески мыслить, проявлять интуицию оцениваются выше, чем те, в которых показаны более простые умения, владение формальными знаниями, выполнение тривиальных расчетов и др.
Школьный этап Всероссийской олимпиады школьников по химии в Иловлинском муниципальном районе в 2016/2017 учебном году
Ответы и решения - 8 класс
1. Названия веществ, простых или сложных часто употребляются в словосочетаниях. Определите эти вещества и допишите предложенные словосочетания:
_____________ дыра
Активированный _____________
________________ , _______________ , ______________ век
Дистиллированная ____________
__________________ недостаточность
________________ лампа
________________ _________________ ложка
РЕШЕНИЕ
Озоновая дыра; железный, медный или бронзовый век; кислородная недостаточность; неоновая лампа; активированный уголь; дистиллированная вода; серебряная или золотая ложка.
|
|
|
За каждый ответ по 0,2 балла. Итого 2 балла.
2. Определите, в каких фразах говорится о химическом элементе, а в каких – о простом веществе. Верному утверждению в таблице соответствует буква. Выберите эти буквы и составьте из них фамилию учёного – естествоиспытателя.
| Химический элемент | Простое вещество | |
| кальций необходим для роста клеток | Р | К |
| азот входит в состав воздуха | М | О |
| натрий входит в состав глауберовой соли | О | Е |
| натрий растворяется в ртути с образованием амальгамы | И | Д |
| кислород необходим для дыхания | Я | А |
| хлор получают электролизом расплава поваренной соли | Л | Г |
| капуста содержит около 0,08% серы | А | Б |
| фтор входит в состав зубной эмали | В | Н |
РЕШЕНИЕ: Учёный – Авогадро. 2 балла
3. В состав человеческого организма входит в среднем по массе 65% кислорода, 18% углерода, 10% водорода, 0,15% натрия и 0,15% хлора. Расположите выше названные химические элементы в порядке уменьшения числа их атомов, содержащихся в организме человека.
РЕШЕНИЕ
1) Расчет количества вещества атомов каждого элемента по формуле
n(Э) = m(Э)/Ar(Э)
n(O) = m(O)/Ar(O) = 65:16=4,06 моль атомов кислорода
|
|
|
n(C) = m(C)/Ar(C) = 18:12= 1,5 моль атомов углерода
n(H) = m(H)/Ar(H) = 10:1=10 моль атомов водорода
n(Na)= m(Na)/Ar(Na) = 0,15:23=0,065 моль атомов натрия
n(Cl) = m(Cl)/Ar(Cl) = 0,15:35,5=0,0042 моль атомов хлора
по 0,5 баллов, всего 2,5 балла
2) Число атомов элемента связано с количеством вещества элемента прямопропорционально. Сравнивая величины количества вещества атомов каждого элемента, получаем, что в порядке уменьшения атомы располагаются в следующей последовательности: водород, кислород, углерод, натрий, хлор.(1,5 баллов)
Итого 4 балла
4. В соединении титана с кислородом отношение масс элементов составляет 2 : 1. Установите формулу данного соединения. Определите валентность титана.
РЕШЕНИЕ
Массовая доля элемента в соединении рассчитывается по формуле
 =
=  ω(х.э.)
ω(х.э.)
Запишем формулу оксида титана в виде TixOy, тогда, зная из условия, что отношение масс титана и кислорода составляет 2 : 1, получим следующее уравнение: 2/3=48x/(48x+16y)
Предположим, что х=1, тогда, решая уравнение, получим у=1,5.
Если х=2, то получим у=3.х и у должны быть целыми числами, то есть подходит последний вариант – тогда исходный оксид - Ti2O3. Ответ: оксид титана (III)
Определено простейшее соотношение атомов – 1 балл
|
|
|
Установлена формула соединения – 2 балла
Указана валентность титана – 1 балл
Итого 4 балла
5. Ученик получил задание, в котором по названиям веществ необходимо было составить их химические формулы. Выполняя это задание, он не оставил пробелы между формулами веществ, в результате чего у него получилась запись:
H2OP2O5AlO2NaH2O3CO2Na3NCFeCl3N2К2SSiO2
1) Выделите из этой записи формулы индивидуальных веществ (1балл), подчеркните простые вещества (1 балл);
2) Назовите вещества (2 балла).
РЕШЕНИЕ
1) H2O P2O5 AlO2Na H2 O3 CO2 Na3N C FeCl3 N2 К 2 S SiO2
Названия веществ: вода, оксид фосфора ( V ), алюминий, кислород, водород, озон, углекислый газ (или оксид углерода( IV )), нитрид натрия, уголь (алмаз), хлорид железа ( III ), азот, сульфид калия, оксид кремния (кремнезём).
Итого 4 балла
4. Лесные звери варили клюквенный компот. Клюквенный отвар получился очень кислым, пришлось добавлять сахар. В 4 кг отвара медведь высыпал пакет (1 кг) сахара, барсук - 1 стакан (200 г) сахара, заяц – 5 столовых ложек (по 15 г), белочка и ёжик – по 10 чайных ложек (5 г). Определите массовую долю сахара в полученном компоте.
1.Найдена масса раствора: m( раствора) = 4 + 1 + 0,2 + (5∙0,015) + (20∙0,005) = 5,375 кг
( 1 балла)
2. Найдена масса сахара: m( сахара) = 1 + 0,2 + (5∙0,015) + (20∙0,005) = 1,375 кг (1 балла)
3) Найдена массовая доля сахара в полученном растворе: W = 1,375/5,375 = 0,2558 или 25,58% (1 балла)
Итого 3 балла
5. Даны формулы оксидов азота: N 2O - оксид азота (I); NO - оксид азота (II); N 2O3 - оксид азота (III); NO2 - оксид азота (IV); N 2O5 - оксид азота (V)
Определите, в каком из этих соединений содержание азота наибольшее. Ответ округлите до десятых.
N 2O: Мr=44; w(N)=63,6% ( 0,5 + 0,5 =1 балл)
NO: Мr=30; w(N)=46,7% (0,5 + 0,5 =1 балл)
N 2O3: Мr=76; w(N)=36,8% (0,5 + 0,5 =1 балл)
NO2 : Мr=46; w(N)=30,4% (0,5 + 0,5 =1 балл)
N 2O5: Мr=108; w(N)=25,9% (0,5 + 0,5 =1 балл)
Итого: 5 баллов
8. Юный любитель химии раздобыл порошок серебра, захотев с ним поэкспериментировать в домашних условиях. Но случайно просыпал его на пол. Мальчик расстроился, ведь он с таким трудом раздобыл этот порошок. И решил собрать его с пола. Пол, к сожалению, был «не очень чистым» и смесь, которую он подмел, содержала помимо порошка серебра всякие мелкие частицы: пух из подушки (скорее всего гусиный), древесные опилки, железные опилки, поваренную соль и сахар. Как мальчику избавиться от лишних примесей? Составьте подробный план действий, чтобы очистить серебряный порошок. Какие методы очистки и разделения вы бы предложили использовать и на каких физических явлениях они основаны?
РЕШЕНИЕ
Любой разумно составленный план - 5 баллов.
Методы – флотация, намагничивание, растворение, фильтрование – 2 балла
Физические свойства: несмачиваемость водой, притяжение к магниту, растворение в воде - 3 балла
Итого: 10 баллов
Ответы и решения - 9 класс
1. При химическом анализе в лаборатории был установлен количественный состав четырех веществ: А – H 8 N 2 O 3 C ; Б – H 2 FeO 2 Cl ; В – H 2 S 2 O 6 Ba ; Г – S 3 Al 2 O 12 .
К каким классам неорганических соединений относится каждое вещество? Назовите вещества А, Б, В, Г. Приведите по одному уравнению химической реакции, характерной для каждого вещества, и укажите условия их протекания.
РЕШЕНИЕ
Анализ брутто-формул позволил определить строение веществ А-Г:
А – H8O3N2С - ( NH 4 )2 CO 3 – карбонат аммония, средняя соль (0,5 × 3=1,5 балла)
Б – H2O2Cl Fe – Fe ( OH )2 Cl – хлорид дигидроксожелеза( III ), основная соль (0,5 × 3=1,5 балла)
В – H2O6S2 Ba – Ba ( HSO 3 )2 - гидросульфит бария, кислая соль (0,5 × 3=1,5 балла)
Г – O12 S3 Al2- Al 2 ( SO 4 )3 - сульфат алюминия, средняя соль (0,5 × 3=1,5 балла)
Уравнения характерных реакций:
А : (NH4)2CO3 = NH3↑ + H2O + CO2 ↑ (нагрев.) или (NH4)2CO3 + 2NaOH = NH3↑+ H2O + Na2CO3 (нагрев.) (1 балл)
Б : Fe(OH)2Cl + 2HCl = FeCl3 + 2H2O (обычные усл.) (1 балл)
В : Ba(HSO3)2 + Ba(OH)2 = 2BaSO3 ↓ + 2H2O (об.усл.) или Ba(HSO3)2 = BaSO3 + SO2 ↑ + H2O (нагрев.) (1 балл)
Г : Al2(SO4)3 + 6NaOH = Al(OH)3 ↓ + 3Na2SO4 (об.усл.) или Al2(SO4)3 + 3BaCl2 = 3BaSO4 ↓ + 2AlCl3 (об.усл.) (1 балл)
Итого 10 баллов
2. Сульфид железа (II), полученный при сплавлении 4,8 г серы с порошком железа, обработали избытком раствора соляной кислоты. Выделившийся газ пропустили через раствор нитрата свинца (II). При этом выпал осадок массой 21,15 г. Напишите уравнения указанных реакций и определите выход получившегося осадка в процентах от теоретически возможного.
РЕШЕНИЕ
Уравнения протекающих реакций:
Fe + S = FeS FeS + 2HCl = FeCl2 + H2S↑ H2S + Pb(NO3)2 = PbS↓ + НNO3 (3 балла)
Из этих уравнений можно составить стехиометрическую схему:
S → PbS
из 32 г серы получается 239 г сульфида свинца из 4,8 г серы х г
отсюда масса сульфида свинца теоретическая равна: (4,8·239):32 = 35,85 (г) (1 балл)
Практический выход осадка: 21,15: 35,85 = 0,590 или 59,0%(1 балл)
Итого 5 баллов
3. На схеме приведены превращения вещества Х
Х + О2 →
Х + Сl2 →
Х+ I2O5 →
C+ O2 → Х
Х+Ni →
Предложите Х и запишите уравнения соответствующих превращений.
РЕШЕНИЕ
Х - СО
2СО + O2=2СО2
СО + Cl2= СОCl2
5СО+ I2O5 = 5СО2+ I2
2C + O2 = 2CO
4СО + Ni = Ni(CO)4 (6 баллов)
4. В лаборатории приготовили водный раствор этилового спирта (С2Н5ОН) с массовой долей 10%. Плотность раствора спирта равна 0,98 г/мл. Рассчитайте число молекул спирта в 1 мл такого раствора.
РЕШЕНИЕ
1) m(раствора) = 1·0,98=0,98 г
2) m(вещества) = 0,98·0,1=0,098 г
3) n(вещества) = 0,098:46=0,002 моль
4) N(молекул) = 6,02·10 23·0,02= 1,2· 10 22 молекул (4 балла)
5. Агроном заказал удобрения. Привезли 5 мешков, наполненных белыми гранулами, но без этикеток. В накладной были указаны следующие удобрения: натриевая селитра, аммиачная селитра, хлорид аммония, сульфат аммония, мочевина. Каким образом агроном может определить содержимое мешков, если в его распоряжении имеются вода и еще 3 необходимых реактива. Опишите его действия и приведите уравнения необходимых реакций.
РЕШЕНИЕ
1) Приготовить растворы веществ, разделить их на четыре порции.
2) Подействовать на каждый раствор первой порции раствором щелочи.
Аммиачная селитра и сульфат аммония при действии щелочи дают аммиак − газ с характерным запахом.
NH4+ + OH− = NH3↑ + H2O
Затем сульфат аммония и аммиачную селитру можно различить по реакции с раствором хлорида бария
SO42− + Ba2+ = BaSO4 ↓ - белый осадок
3) Подействовать на оставшиеся растворы раствором нитрата серебра для обнаружения хлорид-иона
Cl− + Ag+ = AgCl↓
4) Растворы с натриевой селитрой и мочевиной нагреть до кипения. Мочевина при нагревании разлагается с выделением аммиака, который определяется по характерному запаху.
(NH4)2CO + H2O = 2NH3↑ + CO2↑
5) Раствор с натриевой селитрой определяется по остаточному принципу.
На случай, если агроном не различает запахи, в первом и четвертом опыте необходимо к выделяющимся газам поднести влажную индикаторную бумажку, которая покажет щелочную среду.
Ответы и решения - 10 класс
1. Рассчитайте массовую долю углерода в молекулах: а) этана; б) этилена; в) ацетилена. Каков характер пламени при горении этих веществ? Составьте уравнения реакций горения данных веществ. (7 баллов)
Решение:
1. Рассчитаны Mr данных веществ: а) 30; б) 28; в)26 (по 0,5 балла - 1,5 б)
2. Рассчитаны массовые доли углерода в данных соединениях: а) 80%; б) 86%; в) 92% (по 0,5 балла - 1,5б.)
3. Объяснена причина: чем выше содержание углерода в соединении, тем пламя более коптящее. ( 1 балл)
4. Составлены уравнения реакций горения данных веществ:
· 2C2H6 + 7O2 = 4CO2 + 6H2O (1 балл )
· C2H4 + 3O2 = 2CO2 + 2H2O (1 балл )
· 2C2H2 + 5O2 = 4CO2 + 2H2O (1 балл )
Итого: 7 баллов
2. Установите соответствие между названием алкана и его характеристикой
| Название алкана | Характеристика алкана |
| А) пропан | 1) имеет пять изомеров |
| Б) бутан | 2) имеет шесть изомеров |
| В) гексан | 3) имеет семь изомеров |
| Г) гептан | 4) имеет восемь изомеров |
| Д) диметилпропан | 5) имеет девять изомеров |
| Е) 2,3,4,5-тетраметилпропан | 6) не имеет изомеров |
| 7) является изомером метилпропана | |
| 8) является изомером 1,2-диметилгептана | |
| 9) не имеет в своем составе вторичных и третичных атомов углерода |
Заполненная таблица имеет вид:
| А | Б | В | Г | Д | Е |
| 6 | 7 | 1 | 5 | 9 | 10 |
1 балл за каждое верно распределенное вещество (всего 6 баллов)
3. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
 HI + H2SO4 I2 + H2S + H2O
HI + H2SO4 I2 + H2S + H2O
Определите окислитель и восстановитель. (3 балла)
Решение:
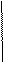 1. Составлен электронный баланс
1. Составлен электронный баланс
 1 S+6 + 8e S-2
1 S+6 + 8e S-2
 4 2I-1 - 2e I20 (1 балл)
4 2I-1 - 2e I20 (1 балл)
2. Расставлены коэффициенты в уравнении реакции:
 8HI + H2SO4 4I2 + H2S + 4H2O
8HI + H2SO4 4I2 + H2S + 4H2O
3. Указано, что сера в степени окисления +6 является окислителем, а йод в степени окисления -1 - восстановителем.
4. Учащимся для проведения опыта были выданы кристаллы соли белого цвета, которые при стоянии на воздухе изменяют окраску на голубую. Известно, что при разложении выданной соли путем нагревания образуется оксид металла чёрного цвета и ядовитый газ бурого цвета. Добавление к раствору выданной соли раствора гидроксида калия привело к образованию студенистого осадка голубого цвета.
Запишите химическую формулу и название выданной соли. Составьте два молекулярных уравнения реакций, соответствующих опытам, проведённым учащимися в процессе исследовании соли. Для второй реакции запишите полные и сокращённые ионные уравнения. (5 баллов)
Решение
1. Cu(NO3)2 - нитрат меди (II) - 1 балл
2. Составлены два уравнения реакции:
t0
 2 Cu(NO3)2 2CuO + 4NO2 + O2 - 1 балл
2 Cu(NO3)2 2CuO + 4NO2 + O2 - 1 балл
Cu(NO3)2 + 2KOH = Cu(OH)2 + 2KNO3 - 1 балл
3. Записаны полные и сокращённые ионные уравнения для второй реакции- по1 баллу (2 б.)
Итого: 5 баллов
5. Продукты бромирования на свету 10,50 г циклогексана обработали избытком водно-спиртового раствора нитрата серебра. В результате выпало 35,10 г желтоватого, темнеющего на свету осадка. Определите состав продуктов бромирования, изобразите для них все возможные структурные и геометрические изомеры.
РЕШЕНИЕ
По схеме реакций получается:С6Н12 → С6H12-nBrn →nAgBr (2 балла)
Числа моль циклогексана и бромида серебра равны, соответственно: 10,5:84,18=0,1247 и 35,10:187,77=0,1869, а их отношение: 0,1869:0,1247=1,50 (2 балла). Это означает, что продукт представляет собой эквимолярную (т.е., с соотношениям по молям 1:1) смесь моно- и дибромциклогексана (2 балла)
Итого 6 баллов
6. В лаборатории устанавливали состав газообразного органического соединения. Для анализа был взят образец объемом 448 мл (н.у.) и массой 1,16 г. Продукты сгорания этого образца полностью поглотились при последовательном пропускании их через трубку с оксидом фосфора(V) и концентрированным раствором гидроксида калия. Масса трубок увеличилась соответственно на 1,8 г и 3,52 г.
А. Какие выводы исследователи могут сделать на основании анализа результатов исследования?
Б. Какое соединение изучали в лаборатории? Выводы подтвердите соответствующими расчетами.
В. Напишите уравнения всех химических реакций, упомянутых в задаче.
Г. Имеет ли искомое соединение изомеры? Если имеет, то напишите их структурные формулы и назовите по систематической номенклатуре.
Решение
А. На основании анализа результатов исследования можно предположить:
- Соединение органическое, следовательно, в его составе есть углерод, а в продуктах горения есть углекислый газ, поглощаемый в эксперименте щелочью. Масса углекислого газа будет равна приросту массы склянки со щелочью.
- Вторым продуктом реакции горения является вода, так как происходит увеличение массы трубки с оксидом фосфора(V), активно поглощающего воду. Масса воды будет равна приросту массы трубки с оксидом фосфора(V).
- В итоге можно сказать, что в состав искомого соединения входят углерод, водород и, возможно, кислород. Последнее можно доказать с помощью расчетов.
Балла
Б. уравнение реакции горения искомого соединения в общем виде:
448 мл (н.у.); 1,16 г 3,52 г 1,8 г
 CxHy(Oz) + O2 CO2 + H2O
CxHy(Oz) + O2 CO2 + H2O
n(CxHy(Oz)) = 0,448 / 22,4 = 0,02 моль
М(CxHy(Oz)) = 1,16 : 0,02 = 58 г/моль
n(CO2) = 3,52 /44 = 0,08 моль
n(H2O) = 1,8 / 18 = 0,10 моль
Расчет количества вещества и массы углерода, водорода, (кислорода) в исходном веществе
n(C) = n(CO2) = 0,08 моль; m(C) = 0,08 × 12 = 0,96 г
n(Н) = n(H2O) × 2 = 0,2 моль; m(Н) = 0,2 × 1 = 0,20 г
m(C) + m(Н) = 0,96 г + 0,20 г = 1,16 г
m(CxHy(Oz)) по условию задачи равна 1,16 г, следовательно, кислорода в исходном соединении нет. Его формулу можно представить так - CxHy
Его формулу можно представить так - CxHy
Нахождение простейшей формулы этого вещества
x : y = n(C) : n(Н) = 0,08 : 0,20 = 1 : 2,5
М(CH2,5) = 14,5 г/моль
M(CxHy) /M(CH2,5) =58/14,5 = 4
Истинная формула искомого соединения C4H10
Балла
В. Уравнение реакции горения бутана
C4H10 + 6,5 O2 = 4 CO2 + 5 H2O
Уравнение реакции взаимодействия углекислого газа со щелочью
2 NaOH + CO2 = Na2CO3 + H2O
Уравнения реакции взаимодействия воды с оксидом фосфора(V)
P2O5 + H2O = 2 HPO3 метафосфорная кислота
P2O5 + 2 H2O = 2 H3PO4 ортофосфорная кислота
P2O5 + 3 H2O = H4P2O7 пирофосфорная кислота
В зависимости от условий образуются разные фосфорные кислоты.
Балла
Г. Бутан имеет два изомера (н-бутан и метилпропан).
Балл
Всего: 10 баллов
Ответы и решения - 11 класс
Задача 1. Для ухода за кожей рук рекомендуют использовать эмульсионные кремы на основе вазелинового масла, в которых содержится до 14% пчелиного воска, около 35% воды, 1% тетрабората натрия Nа2B4O7 и другие вещества. Для приготовления такого крема используют кристаллогидрат тетрабората натрия. Рассчитайте массу декагидрата тетрабората натрия, который требуется для приготовления 60 г такого крема.
Решение
М(Na2B4O7)=202 г/моль 2 балла
М(Na2B4O7*10H2O)=382 г/моль 2 балла
Масса тетрабората натрия в 60 г крема
m(Na2B4O7)= 0,01 * 60 г = 0,6 г 2 балла
m(соли)/M(соли) = m(кристаллогидрата)/M(кристаллогидрата)
0,6:202=x:382 2 балла
х=1,13 г 2 балла
Всего 10 баллов
Задача 2. Восстановите левую или правую часть уравнений следующих химических реакций
1) … → MnBr2 + Br2 + 2H2O
2) … → 2CaCO3↓ + 2H2O
3) … → 4Fe(OH)3↓ + 4Na2SO4
4) CuS + 4H2O2 → …
5) 6HNO3 + P2O5 → …
Решение
1) MnO2 + 4HBr = MnBr2 + Br2 + 2H2O
2) Ca(OH)2 + Ca(HCO3)2 = 2 CaCO3↓ + 2H2O
3) 4FeSO4 + 8NaOH + O2 + 2H2O = 4Fe(OH)3↓ + 4Na2SO4
4) CuS + 4H2O2 = CuSO4 + 4H2O
5) 6HNO3 + P2O5 = 3N2O5 + 2H3PO4
За каждое уравнение по 2 балла
Всего: 10 баллов
Задача 3. В лаборатории устанавливали состав газообразного органического соединения. Для анализа был взят образец объемом 448 мл (н.у.) и массой 1,16 г. Продукты сгорания этого образца полностью поглотились при последовательном пропускании их через трубку с оксидом фосфора(V) и концентрированным раствором гидроксида калия. Масса трубок увеличилась соответственно на 1,8 г и 3,52 г.
А. Какие выводы исследователи могут сделать на основании анализа результатов исследования?
Б. Какое соединение изучали в лаборатории? Выводы подтвердите соответствующими расчетами.
В. Напишите уравнения всех химических реакций, упомянутых в задаче.
Г. Имеет ли искомое соединение изомеры? Если имеет, то напишите их структурные формулы и назовите по систематической номенклатуре.
Решение
А. На основании анализа результатов исследования можно предположить:
- Соединение органическое, следовательно, в его составе есть углерод, а в продуктах горения есть углекислый газ, поглощаемый в эксперименте щелочью. Масса углекислого газа будет равна приросту массы склянки со щелочью.
- Вторым продуктом реакции горения является вода, так как происходит увеличение массы трубки с оксидом фосфора(V), активно поглощающего воду. Масса воды будет равна приросту массы трубки с оксидом фосфора(V).
- В итоге можно сказать, что в состав искомого соединения входят углерод, водород и, возможно, кислород. Последнее можно доказать с помощью расчетов.
Балла
Б. уравнение реакции горения искомого соединения в общем виде:
448 мл (н.у.); 1,16 г 3,52 г 1,8 г
 CxHy(Oz) + O2 CO2 + H2O
CxHy(Oz) + O2 CO2 + H2O
n(CxHy(Oz)) = 0,448 / 22,4 = 0,02 моль
М(CxHy(Oz)) = 1,16 : 0,02 = 58 г/моль
n(CO2) = 3,52 /44 = 0,08 моль
n(H2O) = 1,8 / 18 = 0,10 моль
Расчет количества вещества и массы углерода, водорода, (кислорода) в исходном веществе
n(C) = n(CO2) = 0,08 моль; m(C) = 0,08 × 12 = 0,96 г
n(Н) = n(H2O) × 2 = 0,2 моль; m(Н) = 0,2 × 1 = 0,20 г
m(C) + m(Н) = 0,96 г + 0,20 г = 1,16 г
m(CxHy(Oz)) по условию задачи равна 1,16 г, следовательно, кислорода в исходном соединении нет. Его формулу можно представить так - CxHy
Его формулу можно представить так - CxHy
Нахождение простейшей формулы этого вещества
x : y = n(C) : n(Н) = 0,08 : 0,20 = 1 : 2,5
М(CH2,5) = 14,5 г/моль
M(CxHy) /M(CH2,5) =58/14,5 = 4
Истинная формула искомого соединения C4H10
Балла
В. Уравнение реакции горения бутана
C4H10 + 6,5 O2 = 4 CO2 + 5 H2O
Уравнение реакции взаимодействия углекислого газа со щелочью
2 NaOH + CO2 = Na2CO3 + H2O
Уравнения реакции взаимодействия воды с оксидом фосфора(V)
P2O5 + H2O = 2 HPO3 метафосфорная кислота
P2O5 + 2 H2O = 2 H3PO4 ортофосфорная кислота
P2O5 + 3 H2O = H4P2O7 пирофосфорная кислота
В зависимости от условий образуются разные фосфорные кислоты.
Балла
Г. Бутан имеет два изомера (н-бутан и метилпропан).
Балл
Всего: 10 баллов
Задача 4. Избыток сернистого ангидрида пропустили через раствор перманганата калия. Образовался раствор серной кислоты с концентрацией 4,9 %. Определите концентрацию исходного раствора перманганата.
Решение
Уравнение реакции:
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4 2 балла
ω(KMnO4) = m(KMnO4)/[mр-ра(H2SO4) – m(SO2)]
Пусть mр-ра(H2SO4) = 100 г, тогда
а) m(H2SO4) = 4,9 г; v(H2SO4) = 4,9/98 = 0,05 моль 2 балла
б) по уравнению реакции v(SO2) :v(KMnO4) : v(H2SO4) = 5:2:2
следовательно, прореагировало 0,02 моль KMnO4 и 0,05 моль SO2 2 балла
в) m(KMnO4) = 0,02·151 = 3,02 г; m(SO2) = 0,05·64 = 3,2 г 2 балла
ω(KMnO4) = 3,02/(100-3,2) = 0,0312 или 3,12 % 2 балла
Итого 10 баллов
Задача 5. В представленной схеме превращений вещество А относится к гомологическому ряду бензола и является монозамещенным производным. Массовая доля углерода в этом углеводороде равна 90,57 %, а его молярная масса не превышает 110 г/моль.

А. Установите структурную формулу вещества А.
Б. Напишите уравнения химических реакций в соответствии со схемой.
В. Назовите вещества А-Е.
Решение
А. Установление формулы вещества А.
Допустим, что масса вещества А равна 100 г. Тогда m(C)= 90,57 г, а m(Н)=9,43 г.
x : y = n(C) : n(H) = (90,57/12) : (9,43/1) = 7,5475 : 9,43 = 1 : 1,25
Так как искомое соединение относится к гомологическому ряду бензола, х ≥ 7
Если х=7, то у=8,75 , такое соединение не существует.
При х=8, у=10, что соответствует формуле С8Н10. М(С8Н10)=106 г/моль.
Формуле С8Н10 соответствуют 4 соединения: этилбензол или о-, (м-), (п)-ксилолы. Но к условиям заданной цепочки превращений подходит только этилбензол.
Балла
Б.
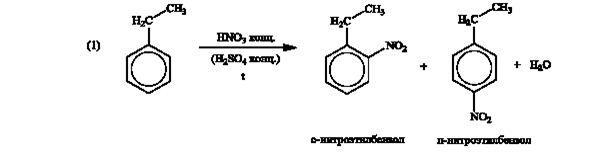
Далее целесообразно продолжать «цепочку» только с одним изомером нитроэтилбензола.
Дата добавления: 2021-04-06; просмотров: 90; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
