Химический потенциал идеального газа
Системы переменного состава. Химический потенциал.
Важной характеристикой веществ, входящих в состав многокомпонентных систем является химический потенциал. Особенно часто он применяется при рассмотрении фазовых превращений и химических процессов.
До сих пор мы рассматривали закрытые системы. Участники химических реакций в таких системах рассматривались как индивидуальные вещества, не влияющие друг на друга. Это позволяло рассчитывать тепловые эффекты, изменение энтропии и термодинамические потенциалы, используя первое начало термодинамики:

и фундаментальное уравнение Гиббса для равновесных процессов в виде:
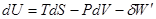 .
.
Последнее слагаемое представляет собой, так называемую полезную работу. Например, работу по созданию новой поверхности - σ∙dΩ, где σ – поверхностное натяжение, Ω – площадь поверхности, по перемещению электрического заряда - φ∙dq, где φ – электрический потенциал, q – заряд.
В этом уравнении изменение внутренней энергии системы выражено через сумму однотипно построенных произведений T, p, φ, σ, которые называются обобщенными силами, на S, V, Ω, q, которые называются обобщёнными координатами.
В качестве независимых переменных здесь выступают те величины, которые использованы в качестве координат при расшифровке теплоты и различных видов работ. Их называют естественными независимыми переменными для внутренней энергии.
|
|
|
Однако для реальных систем с взаимным влиянием одних участников реакции на свойства других такой идеализированный процесс становится неточным. Поэтому для открытых систем в первое начало термодинамики следует добавить еще одно слагаемое, которое должно характеризовать изменение внутренней энергии системы за счет изменения массы системы:

Химическую реакцию можно рассматривать как добавление в систему продуктов реакции и вывод из системы исходных веществ. Если изменяется количество i-того вещества -  , то пропорционально этому количеству произойдет изменение внутренней энергии
, то пропорционально этому количеству произойдет изменение внутренней энергии  . Следует напомнить, что
. Следует напомнить, что  добавляемых веществ берутся со знаком плюс, а выводимых со знаком минус. На основании вышесказанного объединенное первое и второе начало термодинамики для равновесных процессов, если полезной работы не совершается (
добавляемых веществ берутся со знаком плюс, а выводимых со знаком минус. На основании вышесказанного объединенное первое и второе начало термодинамики для равновесных процессов, если полезной работы не совершается ( 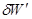 =0) можно записать следующим образом:
=0) можно записать следующим образом:

 .
.
Данное уравнение называется фундаментальным уравнением термодинамики. Коэффициент пропорциональности между  и
и  в данном выражении обозначается через
в данном выражении обозначается через  .
.
Так как  является функцией состояния, то полный дифференциал записывается как:
является функцией состояния, то полный дифференциал записывается как:
|
|
|
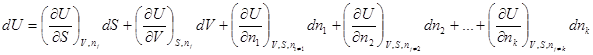 =
= 
Из сопоставления данного выражения с фундаментальным уравнением термодинамики можно сказать, что

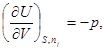
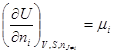
Частная производная внутренней энергии по числу молей данного компонента при постоянных V, S и количествах всех остальных компонентов называется химическим потенциалом  . Он характеризует скорость изменения внутренней энергии при добавлении i-того вещества при постоянных V, S и количествах всех остальных компонентов.
. Он характеризует скорость изменения внутренней энергии при добавлении i-того вещества при постоянных V, S и количествах всех остальных компонентов.
Если вспомнить, что
H=U+pV – энтальпия
A=U-TS – энергия Гельмгольца или свободная энергия
G=U+pV-TS – энергия Гиббса или свободная энтальпия
и продифференцировать эти функции:
dH=dU + pdV + Vdp
dA=dU - TdS – SdT
dG=dU+ pdV + Vdp- TdS – SdT
то заменяя dU на  из фундаментального уравнения термодинамики, можно получить
из фундаментального уравнения термодинамики, можно получить
dH= TdS + Vdp + 
dA= – SdT – pdV + 
dG= – SdT + Vdp + 
Из этих выражений следует, что химический потенциал можно выразить через любой термодинамический потенциал.

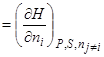

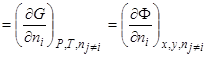
Поскольку обеспечить условие  , а для твердых фаз
, а для твердых фаз  сложно, а большинство процессов проводятся при
сложно, а большинство процессов проводятся при  , то наиболее часто в химии используется химический потенциал, выраженный через производную от энергии Гиббса системы по количеству i-того компонента при постоянных T , p и числах молей остальных компонентов:
, то наиболее часто в химии используется химический потенциал, выраженный через производную от энергии Гиббса системы по количеству i-того компонента при постоянных T , p и числах молей остальных компонентов:
|
|
|

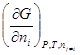 .
.
С практической точки зрения: химическим потенциалом i -того компонента называется величина численно равная изменению энергии Гиббса системы при добавлении 1 моль этого вещества в условиях постоянной температуры и давления к настолько большому количеству смеси, чтобы состав ее при этом практически не изменился.
Химический потенциал является интенсивной величиной, т.е. не зависит от количества вещества, но в отличие от других интенсивных параметров системы, таких как T , p , φ, σ и т.д. химический потенциал нельзя измерить непосредственно. Как интенсивная величина, химический потенциал определяет направление процесса перераспределения числа молей в системе (т.е. направление химического процесса).
Для сложной системы переменного состава
 ;
;
при  первые два члена в правой части уравнения становятся равными 0 и тогда:
первые два члена в правой части уравнения становятся равными 0 и тогда:
 .
.
Согласно 2-ому закону термодинамики критерием состояния равновесия и направления хим. процесса при  является
является
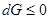 ,
,
Тогда для состояния равновесия:
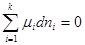 ,
,
а для самопроизвольного процесса:
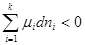
Рассмотрим применение этих критериев для конкретного процесса – фазового перехода:
|
|
|
Пусть  моль
моль  того компонента переходит из фазы a в фазу b. Тогда
того компонента переходит из фазы a в фазу b. Тогда

Очевидно, что сколько моль  того компонента уходит из фазы a столько же моль
того компонента уходит из фазы a столько же моль  того компонента приходит в фазу b, т.е.
того компонента приходит в фазу b, т.е. 
Тогда:

или
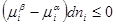
Т.к.  то из предыдущего выражения следует:
то из предыдущего выражения следует:


Знак > относится к самопроизвольному процессу, а знак = к равновесию, т.е. при фазовых переходах вещество будет переходить самопроизвольно из фазы с большим значением химического потенциала  того компонента
того компонента 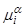 в фазу с меньшей величиной химического потенциала
в фазу с меньшей величиной химического потенциала  . И этот перенос вещества будет продолжаться до тех пор, пока не установится новое состояние равновесия, когда
. И этот перенос вещества будет продолжаться до тех пор, пока не установится новое состояние равновесия, когда  .
.
Таким образом, химический потенциал является движущей силой любого химического процесса в системах переменного состава. Полученное соотношение служит важнейшим критерием фазового равновесия, а именно, при равновесии нескольких фаз химический потенциал каждого компонента во всех фазах системы одинаков.
Частные производные от экстенсивных свойств (V , U , G , A , S и т.п.) по ni при постоянстве T , p , n j называются парциально-молярными величинами. Поэтому химический потенциал  является еще и парциально-молярной энергией Гиббса (Часто обозначаетсяḠi).
является еще и парциально-молярной энергией Гиббса (Часто обозначаетсяḠi).
При 
 ,
,
а функция G ( n 1 , n 2 ,… ni ) обладает тем свойством, что при увеличении количества молей всех компонентов в одинаковое число, раз изобарно-изотермический потенциал увеличивается во столько же раз, т.е. является однородной функцией первого порядка. Действительно, увеличение массы системы в k раз при  приведет к увеличениюэнергии Гиббса G=U+pV-TS тоже в k раз, так как U, V, S увеличиваются в k раз каждая. Поэтому вышеприведенное уравнение можно проинтегрировать по общей массе при постоянном составе:
приведет к увеличениюэнергии Гиббса G=U+pV-TS тоже в k раз, так как U, V, S увеличиваются в k раз каждая. Поэтому вышеприведенное уравнение можно проинтегрировать по общей массе при постоянном составе:

Константа интегрирования равна нулю, так как, если все ni равны нулю, то и энергия Гиббса тоже равна нулю. Для индивидуального вещества химический потенциал из этой формулы можно выразить как:
 ,
,
т.е. химический потенциал индивидуального вещества равен молярной энергии Гиббса.
В общем же случае химический потенциал показывает вклад моля данного компонента в изобарно-изотермический потенциал системы.
Химический потенциал идеального газа
Для индивидуального идеального газа
μ=G/n=G =U+pV-TS=H- TS,
где черта показывает, что соответствующие величины относятся к одному молю вещества.
Из полученного выражения вытекает, что все ранее полученные формулы зависимостей энергии Гиббса от естественных переменных справедливы и для мольной энергии Гиббса, т.е. для химического потенциала. Так при 
dG = d μ = Vdp –RTdlnp,
отсюда следует, что
 ,
, 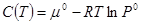
 ,
,
где μ0(T) химический потенциал одного моля идеального газа при температуре T и давлении 1 атм., а  безразмерная величина. Очень часто записывают
безразмерная величина. Очень часто записывают 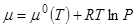 , где
, где  и памятуя, что давление в этой формуле подставляется в атм.
и памятуя, что давление в этой формуле подставляется в атм.
Для компонента i в смеси идеальных газов химический потенциал выражается формулой:
 ,
,
где 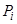 парциальное давление компонента i в смеси. Выражая его через общее давление и мольную долю xi , получим выражение для зависимости химического потенциала i-того компонента от мольной доли:
парциальное давление компонента i в смеси. Выражая его через общее давление и мольную долю xi , получим выражение для зависимости химического потенциала i-того компонента от мольной доли:
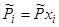

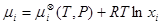 ,
,
где  - химический потенциал идеального газа при xi =1, т.е. в индивидуальном состоянии, температуре T и давлении p .
- химический потенциал идеального газа при xi =1, т.е. в индивидуальном состоянии, температуре T и давлении p . 
Если необходима зависимость химического потенциала от концентрации, то выражая парциальное давление через концентрацию по уравнению состояния идеального газа 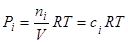 можно получить:
можно получить:
 ,
,
где 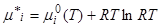 - химический потенциал идеального газа при температуре T и концентрации с i = 1 моль/л, что соответствует давлению pi = RT (в атм.).
- химический потенциал идеального газа при температуре T и концентрации с i = 1 моль/л, что соответствует давлению pi = RT (в атм.). 
Следует подчеркнуть что абсолютное значение химического потенциала, также как и внутренней энергии, энергии Гиббса и Гельмгольца, а также энтальпии определить невозможно.
Для реальных газов найти аналитическую зависимость химического потенциала от давления часто невозможно или зта зависимость получается громоздкой. Поэтому для реальных систем в термодинамике используют метод активностей предложенный Льюисом. В нем вместо давления вводится новая термодинамическая величина – летучесть или фугитивность f (a для растворов активности), которая подбирается так, чтобы выражение для химического потенциала сохранило тот же вид, что и в случае идеального газа.
Фугитивностью называется термодинамическая величина, подстановка которой вместо давления в формулу для химического потенциала делает ее справедливой для реального газа.
Для индивидуального газа:
 ,
,  ,
,
стандартное состояние реального газа: 
для компонента газовой смеси
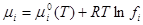 ,
, 
Для однозначного определения необходимо подчинить фугитивность дополнительному условию. Это условие удобно выбрать так, чтобы когда реальный газ близок по своим свойствам к идеальному, его фугитивность превращалась в давление.
Часто используется безразмерная величина  , называемая коэффициентом фугитивности, которая характеризует меру отклонения свойств реального газа от идеального. Для идеального газа фугитивность обращается в давление. При р→0 свойства реальных газов приближаются к свойствам идеального и γ→1. Коэффициенты фугитивности можно вычислить, например, с помощью метода соответственных состояний, согласно которому коэффициенты фугитивности различных газов при одинаковых значениях приведенной температуры и приведенного давления приблизительно одинаковы.
, называемая коэффициентом фугитивности, которая характеризует меру отклонения свойств реального газа от идеального. Для идеального газа фугитивность обращается в давление. При р→0 свойства реальных газов приближаются к свойствам идеального и γ→1. Коэффициенты фугитивности можно вычислить, например, с помощью метода соответственных состояний, согласно которому коэффициенты фугитивности различных газов при одинаковых значениях приведенной температуры и приведенного давления приблизительно одинаковы.
Дата добавления: 2021-07-19; просмотров: 957; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
