Анестезиологическое сопровождение
Ветеринарный Нефрологический Центр
«ОТВЕТ»
Санкт-Петербург
27 Января 2021
 |
Трансплантация почек у животных
Авторы: Алипов А.А., Ващук О.В.,
Соавторы: Кондрашов И.С., Новоселова Е.А.,
Максимовская Л.А., Куприянова А.Л., Комиссаров М.А.
Нефросклероз левой почки и трансплантат в области левого гипогастрия спустя 5 месяцев после трансплантации. 
Трансплантация почки – это операция, целью которой является перенос утратившейся фильтрационной функции почек реципиента на донорскую почку. Данная цель реализуется интеграцией сосудистого русла почки донора в системный кровоток реципиента путем формирования сосудистых анастомозов трансплантата с каудальной полой веной, аортой и мочеточниково-пузырного анастомоза - неоуретероцистоанастомоза.
1. Кандидаты на трансплантацию
Кандидатом на трансплантацию может стать животное с любой нефрологической патологией, при которой заболевание устойчиво прогрессирует. У кандидата не должно быть угрожающих жизни сопутствующих и инфекционных заболеваний, включая вирусоносительство. Возраст, порода, диагноз/скорость прогрессирования нефрологического заболевания, степень уремии, уровень ацидоза, показатели анализа мочи и пр., не являются прямым показанием или противопоказанием к пересадке. Каждый клинический случай является уникальным и решение о пересадке принимается комплексно, учитывая не только измеряемые показатели но и так же общее состояние пациента. Ниже, в разделе «Посттрансплантационные осложнения» приведены примеры двух случаев пересадок, выполненных с противоположными исходными данными:
|
|
|
1. Зрелый возраст (10 лет), высокая степень уремии и как следствие выраженные клинические проявления уремии.
2. Преклонный возраст (15 лет), низкая степень уремии без клинических проявлений.
Гистосовместимость пары донор-реципиент
Зарубежная статистика пересадок почек у животных решительно отличается от результатов в гуманной трансплантологии. В «человеческой» практике вариативность срока состоятельности трансплантата в сходных возрастных группах весьма невелика. В ветеринарной практике, наоборот — он весьма вариативен, на наш взгляд это объясняется ненадежным определением степени совместимости трансплантата (трансплантат — орган или ткань, взятая от особи одного генотипа и пересаженный особи другого генотипа в пределах одного вида) донора с реципиентом. В гуманной медицине, для этих целей применяются исследование главного комплекса гистосовместимости (ГКГС), или MHC - major histocompatibility complex донор-реципиент. Существует 2 класса ГКГС, их еще называют генами лейкоцитарных антигенов человека (HLA - human leukocyte antigen), соответственно, аналоги этих генов есть и кошек и собак: (DLA - dog leukocyte antigen) и (FLA - feline leukocyte antigen). Проблема состоит в том, что в гуманной медицине разработаны методы типирования HLA, основанные на исследовании ДНК, при котором определяются локусы HLA-A, HLA-B, HLA-C, HLA-DP, HLA-DQ, HLA- DR, c определением более 80 антигенов, кодируемых более чем 2200 различными аллелями, а в ветеринарии - эти исследования только начаты. Единственных двух коллег, которые реально практикуют в настоящее время пересадку почек у животных, мы смогли найти в США, это профессор из университета Джорджии C.Smidt и профессор из университета Пенсильвании L. Aronson (Поиск проводила привлеченная нами группа переводчиков, которые адресно связывались со всеми ветучреждениями на всех континентах, публиковавшими хоть какую-то информацию о ветеринарной трансплантации). При подборе донора, наши иностранные коллеги используют метод обычной перекрестной пробы. Мы начали применять данный метод и обнаружили, что при его применении почти каждый донор подходит реципиенту, это если говорить о совместимости в пределах одной группы крови. Данный результат решительно выбивается за рамки представлений о вероятности совместимости при конфликте донор-реципиент у наших гуманных коллег-трансплантологов, так как хоть FLA у кошек и не так изучен как HLA у людей, но от этого он не становится менее вариативным, чем у человека:
|
|
|
|
|
|
«Удивительно, но, несмотря на полезность кошки в моделировании вирусного иммунитета человека, мало что известно о комплексе кошачьих лейкоцитарных антигенов класса I (FLAI). Сообщалось только о нескольких кодирующих последовательностях с неопределенным происхождением локуса и паттернами экспрессии. Предполагается, что из 19 генов класса I три локуса - FLAI-E, FLAI-H и FLAI-K - кодируют классические молекулы. Мы амплифицировали 33 аллеля FLAI-E, FLAI-H и FLAI-K у 12 кошек различных пород, впервые идентифицировав аллели трех разных локусов у одного вида кошек. Мы также определили гипервариабельные области этих генов, что позволило присвоить имена как новым, так и установленным аллелям. Как и предполагалось, FLAI-E, FLAI-H и FLAI-K удовлетворяют основным критериям генов класса Ia. Эти данные представляют собой необходимую предпосылку для изучения эпитоп-специфичных противовирусных CD8 + Т-клеточных ответов у кошек». Polymorphisms and tissue expression of the feline leukocyte antigen class I loci FLAI-E, FLAI-H, and FLAI-K Jennifer C Holmes 1, Savannah G Holmer, Peter Ross, Adam S Buntzman, Jeffrey A Frelinger, Paul R Hess Jun 2013
|
|
|

Рис.1 Определение степени гистосовместимости в процентах выживших лимфоцитов реципиента в иммуноцитотоксичеком тесте.
Возможно, применять прямые аналогии в части гистосовместимости между гуманной трансплантологией и ветеринарной — неверно. Но, усмотрев некоторые логические противоречия, мы решили иммуноцитотоксический тест применяемый в гуманной трансплантологии, адаптировать под наши нужды. Иммуноцитотоксическая проба — это проба, где в качестве мишеней для сыворотки пациента, выступают не эритроциты, а лимфоциты донора. Здесь мы столкнулись с проблемой технического характера: для усиления атаки на лимфоциты, в реакцию обязательно вводится активирующий компонент (он получается в лабораторных условиях путем сложной, многоступенчатой иммунизации кроликов), получить который очень сложно не в промышленных условиях. Применение человеческого компонента, в ветеринарии - решительно неверно, несмотря на гомологичность видов, он иногда работает, а иногда — нет. Мы обратились на завод биопрепаратов и договорились о производстве кошачьего активирующего комплимента. Он получился довольно дорогостоящий и с небольшим сроком хранения, но иммуноцитотоксическая реакция на его основе имеет огромное преимущество перед перекрестной пробой — она на порядок чувствительнее в части гистосовместимости. На данный момент, статистика подбора донора такова: из 5 проб, подходящих по обычной перекрестной пробе, 95% совпадение имеет только одна. На рисунке 1 показаны 4 результата цитотоксических реакций пары донор-реципиент, которые ранее подошли по эритроцитарной перекрестной пробе. Данный результат вполне закономерен, так как обычная перекрестная проба показывает наличие только немедленной реакции на несовместимость. Так же, если пациент сенсибилизирован (например ему ранее перелили неотмытую R-Maccу), реакция будет ложноположительной. Реакция будет ложноотрицательной, если реципиент получал даже непродолжительное время перед тестом глюкокортикостероиды. Даже не в иммуносупрессивных дозах, ГКС сильно влияют на результаты цитоиммунологических реакций экспрессированных антигенов с антителами. За последние годы мы провели сотни исследований на гистосовместимость у кошек, собак и кроликов. По результатам проведенных исследований мы считаем, что идем правильным путем, но окончательные выводы делать пока рано, так как требуется дальнейшее накопление статистического материала.
Предоперационная подготовка
Реципиент
Перед началом иммуносупрессивной терапии у реципиента необходимо исключить наиболее распространенные инфекционные и паразитарные заболевания. При наличии патологии желудочно-кишечного тракта (наиболее распространенное следствие уремии), необходимо назначить адекватную терапию. Терапия должна быть подобрана с учетом предполагаемого иммуносупрессивного протокола, при этом выбранный антибактериальный препарат должен обладать минимальной нефротоксичностью и быть подобран с учетом иммуносупрессивного комплекса, который получает реципиент. Весьма широк спектр лекарств, несовместимых с препаратами из иммуносупрессивного протокола, поэтому сочетаемости препаратов следует уделить особое внимание. К сожалению, реципиент как правило, поступает к нам с достаточно сильным опозданием, что усложняет процесс его стабилизации и подготовки к трансплантации. При поступлении пациента в ОРиИТ, ему проводится инфузионная терапия сбалансированными растворами кристаллоидов и на основании анализа КЩС крови приводятся в референсные значения буферные системы. При необходимости мы проводим гемотрансфузию (цельной кровью или ее компонентами) до достижения уровня гематокрита 30% и более. Гемодиализ нами применяется в том случае, когда концентрация мочевины в крови превышает 70 ммоль/литр и не поддается снижению интенсивной терапией, что связано с необходимостью системной гепаринизации реципиента при ГД процедуре, которая может вызвать обширное кровотечение в пораженном ЖКТ. После стабилизации гемодинамических, физикальных, биохимических показателей, мы начинаем иммуносупрессивную терапию за 48 часов до операции. Во всех наших клинических случаях пересадки - это комбинация преднизолона и циклоспорина. Далее, в разделе «Посттрансплантационные осложнения» будет описан ввод азатиоприна в иммуносупрессивный протокол на фоне криза отторжения.
Донор
К донорству допускаются клинически здоровые животные возрастом от года до пяти лет. Донору проводятся исследования на инфекции, клинический и биохимический анализы крови, УЗИ брюшной полости и сердца для исключения возможных патологий, которые могут быть противопоказанием к донорству. Инфекционная панель зависит от региона, поэтому однозначного перечня проверяемых инфекций нет. Отбор проб на гистосовместимость донор-реципиент и для перекрестной пробы мы выполняем до начала иммуносупресии, так как уже через сутки после ее начала наблюдается значительное снижение иммунологического конфликта в цитотоксической реакции подбора. Донорская кровь или ее компоненты должны быть максимально совместимы как с донором, так и с реципиентом.
Анестезиологическое сопровождение
Протокол анестезии при трансплантации почки не является специфичным, тем не менее существуют некоторые особенности. Индукцию в наркоз следует проводить медленно. Поддержание анестезии осуществляется ингаляционными анестетиками. Для анальгезии, как донору так и реципиенту, следует провести эпидуральную анестезию. Так же, в течение всей операции реципиенту вводится маннит для улучшения перфузии трансплантата. Операция по трансплантации может длиться от 6 до 8 часов, в связи с этим существует риск возникновения гипотермии, что в свою очередь влечет за собой нарушение физиологических процессов в организме, в том числе снижение как почечного, так и кровотока в трансплантате. Термометрия, как и обогрев животного, должны проводиться в течение всей операции. Перед хирургическим вмешательством устанавливается центральный венозный катетер для контроля электролитов (анализатор КОС должен находится в шаговой доступности от анастезиолога), гематокрита и некоторых биохимических показателей интраоперационно — альбумин, лактат, глюкоза и пр. Эти показатели являются важными для измерения на протяжении всей операции и в послеоперационном периоде. При подготовке животных к трансплантации почки необходимо заблаговременно подготовить донорскую цельную кровь, либо ее компоненты, совместимые как с донором, так и с реципиентом по обычной перекрестной пробе. Во время формирования сосудистых анастомозов, происходит резкое перераспределение потоков крови в кровеносном русле у реципиента из-за пережатия магистральных сосудов, что может привести к увеличению внутричерепного давления и скачкам артериального давления, поэтому АД постоянно контролируется как у донора, так и у реципиента в течение всей операции.
5.Оборудование операционной для трансплантации
Операция по поводу пересадки почки должна выполняться в операционной, оснащенной чистой зоной классом чистоты не менее G14. Чистая зона — это направленный ламинарный поток стерильного воздуха, который движется сверху вниз над операционным столом со скоростью 0,3 - 0,4 м/с, накрывая в том числе и операционную бригаду. Ламинарный поток формируется в ламинаризаторе и перед этим проходит через HEPA G14 фильтры, которые задерживают 99,995% частиц в воздухе, включая вирусы, споры и бактерии. Ламинарный поток необходим для вытеснения нестерильного воздуха
 |
над операционным полем и рабочим пространством опербригады. (Рис.2)
Рисунок 2. Ламинарный поток
Обычная стерильная одежда не подходит для работы в ламинарном потоке. Она должна быть выполнена из специальных материалов, иначе во время операции трансплантат и оперполе будут обсеменены частицами, сдутыми ламинарным потоком с одежды опербригады. Простые одноразовые хирургические костюмы хоть и стерильны, но не проходят очистку от частиц. Есть специализированные фирмы, которые такую одежду изготавливают и стерилизуют. На сегодняшний день все трансплантации мы выполнили без чистой зоны, и в каждом случае на следующий день отмечался выраженный лейкоцитоз у реципиента, в разных случаях он варьировал от 30 до 60·109/L . Мы справляемся с ним антибиотикотерапией, но это лишний стресс для организма реципиента, находящегося в иммуносупрессии, который лучше исключить. Обычные меры, которые принимаются для подготовки операционных в ветеринарных клиниках, недостаточны для требуемого уровня чистоты операционной при трансплантации почки. В воздухе, несмотря на кварцевание и влажную уборку, находится взвесь из пылевых частиц, спор и бактерий. Эта взвесь поступает в помещение операционной из предоперационного блока вместе с пациентом и опербригадой, что всегда является проблемой для чистой ветеринарной операционной. При отсутствии стерильного ламинарного потока эта взвесь всегда и во всех случаях обсеменяет трансплантат, опербригаду и оперполе. С целью недопущения обсеменения оперполя и опербригады, мы разработали и заказали чистую зону 3000 на 1500 мм., которая должна быть готова к марту 2021 г. В последующих публикациях мы опишем плюсы и минусы проведения операций в стерильном ламинарном поле, после того как мы наберем достаточно статистического материала. (Рис.3). Предпочтение длинной стерильной зоне двум стандартным мы отдали потому, что при изучении данного вопроса выяснилось: два соседствующих ламинарных потока начинают конкурировать между собой и в мертвом пространстве между ними начинают формироваться турбулентные вихри, которые подхватывают частицы с пола и поднимают их к потолку операционной, что категорически недопустимо.
Рисунок 3. «Конвеерный» способ трансплантации 
В операции по трансплантации одновременно участвуют два пациента, поэтому мы пришли к выводу, что ее следует выполнять «конвеерным» способом, не вынося трансплантат между изъятием у донора и пересадкой его реципиенту из единого объема ламинарного потока, где он будет немедленно обсеменен пылевой взвесью в основном объеме воздуха операционной.
Техника Операции
Есть два варианта выполнения операции трансплантации почки: выполняемая одной операционной бригадой и двумя. В случае с двумя бригадами, к моменту изъятия трансплантата у донора, реципиент уже готов к его приему, а именно: он находится в наркозе, осуществлен доступ к месту пересадки трансплантата, выделены аорта и каудальная полая вена, подготовлено ложе для трансплантата в области левого гипогастрия. При технике выполнения одной операционной бригадой, сначала забирается трансплантат у донора и после этого производится ушивание раны. Далее, в операционную поступает реципиент и начинается вторая часть операции. Все пересадки в «Ответе» были выполнены методом одной операционной бригады. Сейчас мы построили новый трансплантационный блок, где хотим попробовать начать делать пересадки двумя бригадами «конвеерным» способом, в едином ламинарном поле, описанном в разделе 5. «Конвеерный» метод в едином ламинарном поле - единственная причина из-за которой мы решили применить параллельную технику трансплантации. У нас есть сомнения о предпочтительности работы двух бригад одновременно. Кроме физического неудобства (в операционной должны присутствовать порядка 8 человек одновременно, два операционных стола, две анестезиологические стойки, и т. д.), существует следующий аспект: забирая трансплантат у донора и пересаживая его реципиенту, хирург-трансплантолог готовит почечную артерию и вену уже с прицелом на будущие анастомозы, расчитывая длины сосудистых ножек и углы их входа в магистральные сосуды.
 |
Рисунок 4. Сосудистые анастомозы трансплантата
При схеме, когда один хирург почку забирает, а пересаживает другой - возможны проблемы, по крайней мере в первое время они будут однозначно, до тех пор, пока операция не станет рутинной. Операция по пересадке почки всегда начинается с изъятия почки у донора. Пересадке подлежит только левая почка, так как у нее длина сосудистой ножки позволяет сформировать сосудистые анастомозы у реципиента. Лигатуры на почечной вене, артерии и мочеточнике у донора накладываются нитью ПГА, а ушивание операционной раны — выполняется стандартными техниками. В литературе описаны случаи интеграции трансплантата в системный кровоток реципиента через подвздошные артерии и вены, но мы этот способ никогда не использовали. К системному кровотоку мы подключаем трансплантат посредством формирования анастомозов почечной артерии и вены с аортой и каудальной полой веной соответственно (Рис.4). Формирование мочеточниково-пузырного анастомоза (неоуретероцистоанастомоз) выполняется в последнюю очередь, после выполнения артериальных и венозных анастомозов, так как в трансплантате восстановление кровотока должно произойти как можно скорее после его изъятия. Сосудистые анастомозы: почечная артерия анастомозируется конец в бок под 30-40 градусов c аортой, а почечная вена анастомозируется конец в бок с каудальной полой веной с такими же углами входа. Очень важно соблюдать геометрию входа и выхода из магистральных сосудов, так как на границе перехода аорты в почечную артерию и почечной вены в каудальную полую вену развиваются турбулентные потоки крови, которые при увеличении углов входа-выхода начинают угрожающе усиливаться (Рис. 5 и 7) и раздражать интиму сосудов в области анастомозов. Это может привести к хроническому васкулиту, а в дальнейшем к обструкции почечных сосудов и даже к несостоятельности шва, так как анастомозы реципиента с аллографтом несостоятельны по своей сути и пожизненно держатся за счет нерассасывающегося шовного материала, ввиду отсутствия полной гистосовместимости, которая не дает наступить полноценному сращению тканей. Все трансплантации мы проводим под увеличением 30-50 крат с помощью хирургического микроскопа. Почечную артерию с аортой мы шьем нейлоном 10-0 двумя непрерывными швами: один на медиальной стороне, а другой - на латеральной стороне артерии. Почечную вену с каудальной полой веной шьем аналогично.
Рисунок 5. Турбулентный поток Рисунок 6. Выделение мочи из мочеточника . трансплантата . . Мочеточниково-пузырный анастомоз формируется после завершения сосудистых анастомозов, перед этим следует убедиться что из мочеточника начинает выделяться моча (Рис.6).
 |  | ||
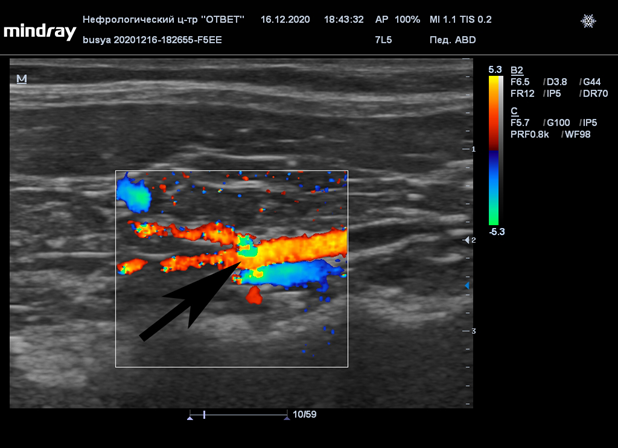 |
Рисунок 7. Турбулентный поток в анастомозе почечная артерия - аорта
В стенке мочевого пузыря делается разрез, конец мочеточника захватывается и вводится через него непосредственно в полость мочевого пузыря. На противоположной от разреза стенке тела мочевого пузыря формируется окно, через которое производится работа по формированию анастомоза с внутренней поверхности МП. Периуретеральный жир удаляется, а конец мочеточника с помощью микрососудистых ножниц разрезается примерно на 5 мм. Мочеточник мы подшиваем к стенке мочевого пузыря нейлоном 8-0, простым узловатым швом. Необходимо убедиться в отсутствии периуретерального жира в зоне коаптации тканей, поскольку это может привести к образованию спаек и гранулем, которые могут впоследствии обтурировать неоуретероцистоанастомоз. Проходимость анастомоза мы оцениваем путем его катетеризации, после чего рабочее окно на теле мочевого пузыря зашивается. После формирования всех трех анастомозов, хирург проводит ревизию брюшной полости на предмет герметичности сосудистых швов, а потом закрывает брюшную полость стандартным способом.
Послеоперационный Период
В ранний послеоперационный период мы проводим ежедневный мониторинг артериального давления, темпа диуреза, температуры тела, биохимии, клиники крови и КЩС крови. Ежедневное ультразвуковое исследование трансплантата, в том числе доплерометрия почечных сосудов и сосудистых анастомозов, является важным методом динамического наблюдения за состоянием трансплантата и своевременного выявления посттрансплантационной нефропатии. (Рис.8-9) Особое внимание в первые дни наблюдения следует уделять размерам трансплантата, эхогенности окружающих тканей, наличию свободной жидкости по периферии трансплантата, размеру лоханки, мочеточника, состоянию стенки и окружающих тканей по периферии мочевого пузыря в области неоуретероцистоанастомоза.
Рисунок 8. На третий день после пересадки доплерометрически наблюдается выраженное снижение диастолической андеградной составляющей артериального кровотока трансплантата, что является ожидаемой реакцией сосудов в ранний посттрансплантационный период 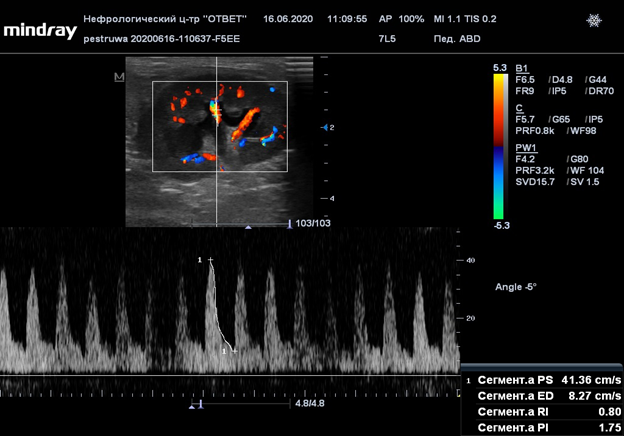
Очень важным в ранний посттрансплантационный период является контроль стресса, болевого статуса и артериального давления у реципиента, ввиду существующей опасности разрушения сосудистых анастомозов вследствии скачков артериального давления. Даже кратковременная гипертензия должна быть полностью исключена. В то же время, необходимо обеспечить оптимальную перфузию трансплантированной почки с целью восстановления послеоперационного диуреза путем поддержания ОЦК соответствующему гемодинамическому статусу реципиента. Артериальное давление мы держим в пределах 120-140мм.рт.ст,. При применении циклоспорина, для снижения артериального давления мы используем внутривенно спазмолитические средства и производные фенотиазина, так как применение препаратов ингибиторов активности АПФ противопоказано ввиду возможного развития гиперкалиемии. На вторые сутки после операции у реципиента мы контролируем уровень циклоспорина в крови, так как недостаточная концентрация может привести к отторжению трансплантата. Если функция трансплантата значимо ухудшается (начинает расти концентрация креатинина и мочевины в крови, падает концентрирующая способность трансплантата), он увеличивается в размере, доплерографически появляются признаки ишемии трансплантата, то в этом случае немедленно следует пересмотреть протокол иммуносупрессии — это признаки криза отторжения, пример которого будет описан ниже, в разделе «Посттрансплантационные осложнения»..
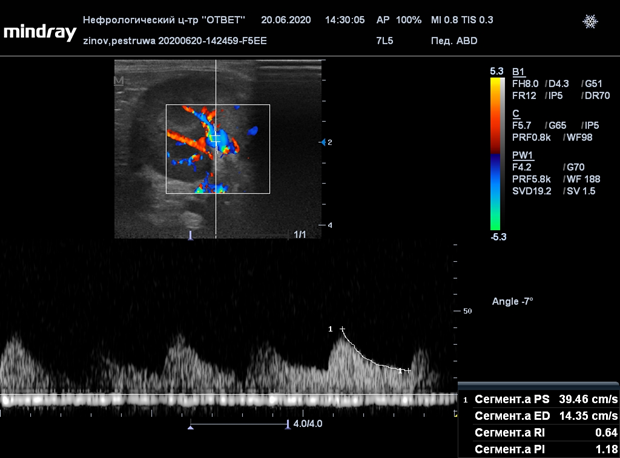 |
Рисунок 9. Нормализация внутрипочечного кровотока трансплантанта на 7-й день после трансплантации
8. Посттрансплантационные осложнения
После трансплантации донорской почки, реципиенту до конца жизни необходимо принимать иммуносупрессивные препараты для предотвращения отторжения и гибели трансплантата. Пожизненная иммуносупрессия имеет ряд возможных нежелательных побочных эффектов со стороны ЖКТ, эндокринной, сердечно-сосудистой, имунной систем и пр. Любой воспалительный процесс на фоне иммуносупрессивной терапии протекает в более тяжелой форме. В раннем послеоперационном периоде наибольшего внимания требуют кризы отторжения. Этиология и симптоматика отторжения трансплантата разнообразна, а ранняя диагностика затруднена. Стоит отметить: непрерывное обследование реципиента необходимо только в раннем посттрансплантационном периоде. В дальнейшем, интервал между диспансеризациями можно увеличить до 2х месяцев, что является приемлемым для обеспечения пациента хорошим качеством жизни.
КЛИНИЧЕСКИЕ СЛУЧАИ
Маруся:
Семилетней кошке Марусе, была проведена аллографтная трансплантация почки, спустя несколько дней после трансплантации, на УЗИ наблюдается умеренная пиелоэктазия. Посттрансплантационная пиелоэктазия — это ожидаемая реакция в ранний посттрансплантационный период, она проходит самостоятельно без специальной терапии в течении нескольких дней. (Рис.10 ). Спустя два года на УЗИ визуализируется нарушение геометрии трансплантата. Процесс нарушения геометрии, источения коры и понижения фильтрационной функции трансплантата со временем - называется хронической трансплантационной нефропатией (ХТН) и этот процесс является неизбежным при трансплантации почек (Рис.11).
Рисунок 10. Пиелоэктазия трансплантата в ранний посттрансплантационный период
 |
Рисунок 11. Нарушение геометрии трансплантата спустя 22 месяца после операции
 |
«Первоначально термин ХТН был предложен как морфологическое понятие, объединяющее различную патологию трансплантата, основным проявлением которой является нефросклероз, в развитии которого принимают участие как антиген-зависимые, так и неспецифические факторы. В дальнейшем, по мере распространения этого термина в клинической трансплантологии под ним все чаще стали понимать стойкую, медленно прогрессирующую дисфункцию трансплантата без уточнения ее морфологической картины. Тем не менее морфологическая верификация диагноза в таких случаях является единственной возможностью провести дифференциальную диагностику между целым рядом различных патологий, имеющих сходные клинические проявления, но принципиально различных по своей природе и требующих различных, зачастую противоположных, подходов к ведению пациентов». Поздняя дисфункция трансплантированной почки: причины, морфологическая характеристика, подходы к профилактике и лечению. Столяревич Е.С., Томилина Н.А. 2009.
Скорость развития ХТН завистит от многих факторов: качества подбора пары донор-реципиент, степени адекватности конкретному клиническому случаю иммуносупрессионного протокола, качества формирования анастомозов при трансплантации, наличия периодически возникающих инфекций в мочевыделительной системе в посттрансплантационный период. Каждый из выше перечисленных факторов является крайне важным для качества и продолжительности жизни пациента.
Буся:
У одинадцатилетней кошки Буси, породы британская короткошерстная, после формирования неоуретероцистостоанастомоза отек стенки мочевого пузыря развился интенсивнее обычного, благодаря чему образовался частичный блок мочи. (Рис.12). Отек спал на 6-й день и отток мочи от трансплантата нормализовался.
 |
Рисунок 12. Отек стенки мочевого пузыря в области неоуретероцистостоанастомоза и возникновение частичного блока мочи
Мы отказались от стентирования неоуретероанастомоза по причине необходимости повторной операции с целью его удаления. Так же, на протяжении 8 месяцев после трансплантации почки, у Буси наблюдались периодические эпизоды диареи. При ультразвуковом исследовании во всех эпизодах картина соответствовала энтероколиту, который был купирован применением антибиотика широкого спектра действия и диеты. На протяжении последних шести месяцев у Буси эпизодов диареи не омечалось.
Торт:
15-летний кот, по кличке Торт, наблюдался у нас в нефроцентре последние 4 года с предварительным диагнозом «интерстициальный нефрит» (биопсия не проводилась). В последние несколько месяцев перед операцией, у него существенно снизилась концентрирующая функция почек (ᶈ = 1,012), значения креатинина начали приближаться к 400 ммоль/л., а мочевины к 30 ммоль/л., владельцы были заранее готовы на пересадку, поэтому все гистохимические и прочие необходимые анализы были проведены заблаговременно. Когда дальнейшее медикаментозное ведение пациента стало нецелесообразным, мы провели ему операцию по поводу пересадки почки. Несмотря на преклонный возраст, постоперационное восстановление животного было быстрым, так как реципиент к операции был подготовлен заранее. На второй день у него появился аппетит, а через 4 дня после операции он был выписан домой с условием ежедневного мониторинга и назначением курса антибиотика широкого спектра в совокупности с комбинацией преднизолон + циклоспорин, в качестве иммуносупрессивного комплекса (рис.12 ).
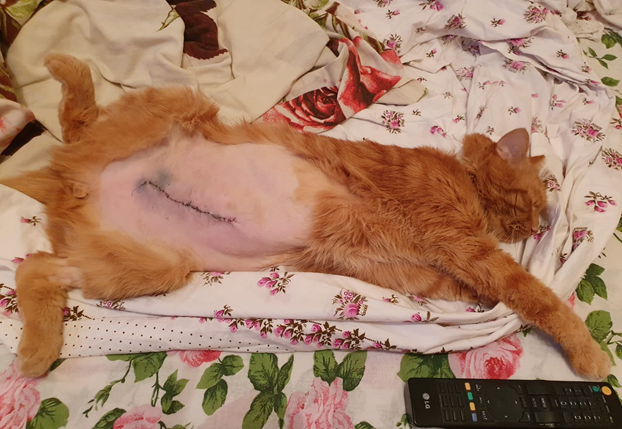
Рисунок 13. Торт на пятый день после трансплантации почки дома
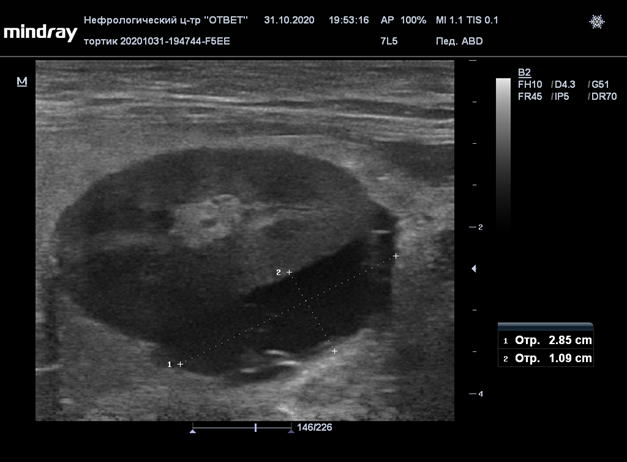
Рисунок 14. Анэхогенное кистободобное образование в воротах трансплантата у 15-летнего кота Торта спустя 2,5 месяца после трансплантации
Через 2,5 месяца после трансплантации почки у него появились признаки отторжения: общая апатия, повышение в сыворотке крови уровня креатинина (230 Мкмоль/л) и мочевины (16 Ммоль/л), увеличение трансплантата в размере, гипертермия, снижение плотности мочи (уд. вес 1,008). Так же, во время УЗИ у него было обнаружено эхонегативное образование медиальнее трансплантата, вероятнее всего являющееся лимфоцеле (Рис.14). Уровень циклоспорина в крови был в референсных значениях. После получения результатов исследований, протокол иммуносупрессивной терапии был пересмотрен — в него был добавлен азатиоприн, после этого показатели нормализовались, симптомы исчезли спустя 3 недели (Рис.15). Так же, с момента начала приема глюкокортикоидных препаратов, у Торта наблюдалась артериальная гипертензия – она была купирована добавлением в схему теразозина, а спустя 4 месяца приема глюкокортикоидов появились признаки развития ятрогенного сахарного диабета (уровень глюкозы крови повысился до 19,0 Ммол/л). На момент исследования, полиурии/полидипсии у реципиента не наблюдалось. Для предотвращения развития заболевания доза глюкокортикоидов была снижена на 25%, изменена диета и уровень глюкозы пришел в норму. На момент написания статьи, уровень мочевины и креатинина в референсе, кровоток трансплантата состоятелен, жалоб нет.
 |
Рисунок 15. Исчезновение анэхогенного образования в воротах трансплантата через 3 недели после корректировки иммуносупрессивного протокола
Пеструша.
У десятилетней кошки Пеструши, после начала приема глюкокортикоидных препаратов отмечен острый воспалительный процесс в ЖКТ (Рис. 16). Из всех пациентов, подвергшихся у нас трансплантации, она изначально имела наиболее плохие вводные данные: высокая степень уремии (мочевина 64 ммоль), обезвоживание 10%, кахексия, масса проблем с ЖКТ, вызванных уремией. Мы не были уверены в благоприятном исходе, но решили попробовать по следующим причинам: относительно небольшой возраст реципиента и анамнез: весь патологический симптомокомплекс развился довольно быстро, так же пациент подошел по всем требованиям на пересадку. Пеструшка провела у нас в стационаре 3 недели после операции, в течении которых мы боролись с актуализированным воспалением ЖКТ на фоне иммуносупрессии, что является крайне трудной задачей, так как иммуносупрессия реализуется путем применения ГКС и циклоспорина, каждый из которых своими побочными эффектами вызывает воспаление ЖКТ. Отменять их нельзя, так как это грозит отторжением. В итоге, путем множества проб, комбинаций препаратов и диет, проблема была решена, пациент был выписан домой с хорошим самочувствием, но всех этих проблем можно было избежать в случае своевременного обращения владельца в клинику. Сейчас, на момент написания статьи — проблем с ЖКТ у нее не наблюдаются. Через 2 месяца после пересадки, у Пеструши произошел эпизод инфекции верхних дыхательных и мочевыводящих путей. Инфекция была купирована курсом антибиотика широкого спектра действия. На недельном графике посттрансплантационной динамики уремии у Пеструши (Рис.17-18) наблюдается следующая картина: положительная динамика мочевины в интервал с первого на второй день, сменилась на резко отрицательную и рост за сутки составил 174% (с 31,8 до 55,6). В этот же период, график падения креатинина, наоборот - показал устойчивую положительную динамику. А на следующе сутки, график креатинина почти повторил график мочевины — продемонстрировав рост в 202%, только с задержкой на сутки. Как оказалось впоследствии, у Пеструши на фоне иммунносупрессии обострился энтероколит и первый скачок мочевины в крови имеет не почечное, а кишечное происхождение.

Рисунок 16. УЗИ признаки острого энтерита на фоне иммуносупрессии после трансплантации
Почки не обладают избирательной фильтрацией мочевины или креатинина, поэтому когда страдает их фильтрационная способность, значение этих показателей в крови увеличивается примерно в равных долях. В противовес этому, процентный перекос пары мочевина-креатинин в ту или иную сторону при уремии всегда указывает на наличие внеренального фактора. Характер постоперационных пиков уремии у Пеструши, следует интерпретировать следующим образом: через сутки после длительной операции, на фоне иммуносупрессии, актуализировался энтереколит. Предположительно, данная патология, в сочетании с интраоперационной травмой и стрессом, запустила сложный каскад реакций, вследствии которых через сутки развилась острая нефропатия трансплантата, функция которого еще не стабилизировалась после недавней интраоперационной ишемии. Какие именно патфакторы дали такую реакцию - медиаторы воспаления и стресса, лейкоцитоз, интраоперационная ишемия трансплантата, или их совокупность - мы не можем сказать точно, но это единственная логичная версия, которая укладывается в клиническую картину целиком. К сожалению, в «Ответ» почти все пациенты поступают со значительным опозданием, поэтому с набором статистического материала у нас появится возможность подробно изучить течение патпроцессов у пациентов в исходно высокой степени уремии (уремию в данном контексте следует понимать не как простое повышение уремических токсинов в крови, а как многофакторный патологический комплекс с уремическим поражением систем и органов) в ранний посттрансплантационный период.
Пеструша:
 |
Рисунок 17. Недельная динамика мочевины
десятилетней кошки Пеструши после трансплантации
 |
Рисунок 18. Недельная динамика креатинина у
десятилетней кошки Пеструши после трансплантации
 |
Тортик:
Рисунок 19. Недельная динамика мочевины у
15-летнего кота Тортика после трансплантации
 |
Рисунок 20. Недельная динамика креатинина у
15-летнего кота Тортика после трансплантации
Вывод:
Трансплантация почек у животных — это эффективный способ лечения некупируемых медикаментозно нефрологических заболеваний. Наш двухлетний клинический опыт пересадки почки однозначен — при устойчивом нарастании уремии, операцию следует делать как можно быстрее, не дожидаясь развития комплекса сопутствующих патологий, вызванных уремией. Около 70% пациентам согласных на пересадку, мы отказываем в операции ввиду несоразмерности рисков, исключительно по причине позднего обращения.
К моменту публикации данной статьи, в «Ответ» поступила кошка Багира, 9 лет:
Левосторонний выраженный гидронефроз с развитием тотальной нефродеструкции (пионефроз?), вследствие хронической обструкции левого мочеточника множественными конкрементами. Правосторониий нефросклероз (атрофия почки?). На момент поступления: Креатинин 721 мкмоль/л, Мочевина 61 ммоль /л, выраженные клинические проявления уремии. Ввиду нецелесообразности оперативного вмешательства было принято решение о трансплантации почки. Пациент был стабилизирован в условиях ОРиИТ, за двое суток до назначенного дня трансплантации была начата иммуносупрессивая терапия (к этому моменту были получены отрицательные результаты сданных инфекций). На вторые сутки иммуносупрессии у кошки появился выпот в грудной полости в умеренном кол-ве (субъективно по УЗИ до 30-40 мл, гемодинамика сердца не нарушена, ЧДД в норме). Так как время для дальнейшего диагностического маневра было исчерпано (степень уремии не низилась до приемлемых показателей ), и осознавая возможность ложноотрицательного результата на Feline coronavirus enteritis мы решили не переносить назначенный день трансплантации (по данным цитологии, на основании лаб.исследований крови мы в большей степени склонялись к этиологии выпота как следствию длительной высокой уремии). В день операции основные физиологические параметры были в пределах допустимых значений, следовое кол-во свободной жидкости в грудной полости (в динамике не нарастало, ЧДД 19-20). Операция прошла успешно, моча от трансплантата получена интраоперационно (трансплантат дал мочу). В первые три дня после операции у животного сохранялся аппетит, наблюдалось снижение почечных показателей. Креатинин на 4-е сутки снизился до 403 мколь/л, мочевина до 45 ммоль/л. На вторые сутки после трансплантации у животного появилась свободная жидкость в брюшной полости, а количество свободной жидкости в грудной полости стремительно нарастало день ото дня. Анализ выпота спустя два дня после операции показал отрицательный результат на Feline Infectious Peritonitis. На седьмые сутки после трансплантации животное погибло. На вскрытии выявлена картина, сходная с FIP: в брюшной полости на серозных оболочках обнаружено умеренное кол-во розово-желтого цвета опалесцирующей свободной жидкости, а так же локально распространенные включения /наложения на серозных оболочках белесоватого цвета, плотной структуры в виде бляшек, узелков. Серозная оболочка большой кривизны желудка в виде мелкозернистых вкраплений, с тенденцией к умеренному увеличению их размеров в области кровеноснх сосудов стенки желудка. Сальник с признаками умеренного желтушного окрашивания. Поверхность брыжейки имеет очаговые зоны с наличием белесоватых бляшек и узелков. Образцы отправлены на гистологическое исследование (в том числе на FIP), результат будет получен в течении 12-14 дней.
Рис. 21 Левосторонний гидронефроз (пионефроз?) 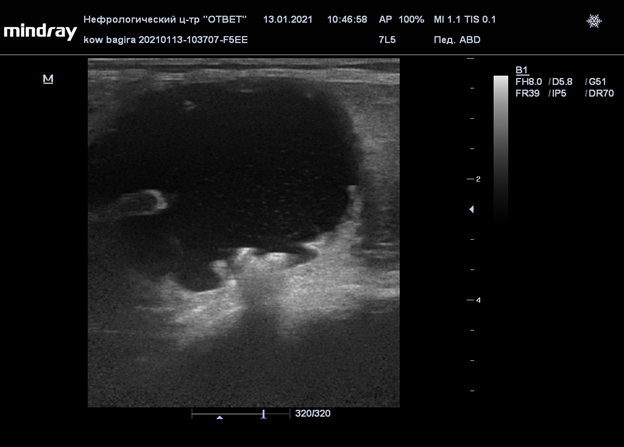
Рис. 22 Множественные конкременты в левом мочеточнике 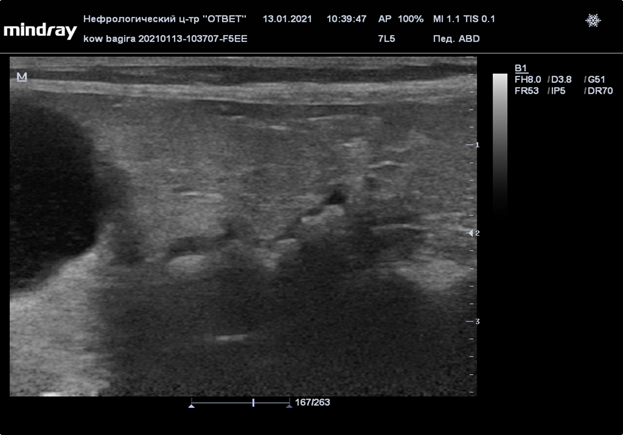
Рис. 23 Пиелоэктазия транспантата на третий день после пересадки 
Рис. 24 Доплерографические показатели артериального кровотока трансплантата на третий день после пересадки. Высокоскоростной высокорезистивный поток. 
Рис.25 Мочевой пузырь на третий день после пересадки
 |
Рис. 26 Мочевой пузырь на 5й день после пересадки 
 |
Рис. 27 Лоханка трансплантата на 7й день не расширена, трансплантат состоятелен, но Увы - Багире он не пригодился.
Пример кошки Багиры для нас стал поводом для пересмотра протокола предоперационной подготовки пациента в части диагностики Feline coronavirus enteritis. Несмотря на снижение уровня креатинина, мочевины и «запуск» трансплантата, все-таки кошка погибла. В выпоте во всем посттрансплантационном периоде, из имунных клеток были преимущественно нейтрофилы, лейкоциты единичные. На данный момент мы рассматриваем две гипотезы: асептический перитонит и FIP (ситуация неоднозначна, так как животное находилось на иммуносупрессии). Гипотеза, что гибель животного произошла ввиду носительства Feline coronavirus enteritis и мутирования его под воздействием иммуносупрессии в FIP более правдоподобна и укладывается полностью в историю болезни, но все же она является предварительной и будет подтверждена или опровергнута только по результатам гистологического исследования (золотым стандартом диагностики FIP является гистологическое исследование). Если у кого-то возникнут какие-то идеи на этот счет, пишите: Spb@vetotvet.com
Список литературы:
Введение в клиническую трансплантологию. Ред. Б.А. Константинова, С.Л. Дземешкевича. – М., 1993.
Габриэль М. Данович. Трансплантация почки. 2014г.
Демихов, В.П. Пересадка жизненно важных органов в эксперименте: опыты по пересадке сердца, легких, головы, почек и других органов / В.П. Демихов. 1960.
Демихов, В.П. Пересадка сердца и легких в эксперименте и способы предупреждения смерти во время операций на органах грудной клетки. 1955 г.
Поздняя дисфункция трансплантированной почки: причины, морфологическая
характеристика, подходы к профилактике и лечению. Столяревич Е.С., Томилина Н.А. 2009
Воронин Е.С., Петров А.М., Серых М.М., Девришов Д.А. Иммунология. 2002
Сочнев А.М., Алексеев Л.П., Тананов А.Т. Антигены системы HLA при различных заболеваниях и трансплантации . 1987.
Клиническая Ангиология. Руководство для врачей под ред. Акад. Покровского А.В. 2004
Ультрасонография и допплерография в диагностике заболеваний почек
Квятковский Е.А., Квятковская Т.А.
2005 г.
Руководство по сосудистой хирургии с атласом оперативной техники. 2-е издание. Белов Ю.В. 2011
Трансплантация сердца в эксперименте. В.В. Кованов, В.И. Бураковский, А.В. Покровский. 1968
Клиническая трансплантология. Б.А. Константинов. 2004.
Трансплантация органов и тканей в многопрофильном научном центре. М.Ш. Хубутия. 2011.
Оценка ишемического повреждения почечного трансплантата и его функции в раннем послеоперационном периоде по данным интраоперационной гемодинамики, дуплексной сонографии и почечной энзимурии. В.И. Садовников, В.А. Сандриков, О.С. Белорусов 1996.
Adin CA, Gregory CR, Kyles AE, et al: Diagnostic predictors and survival after renal transplantation in cats. Vet Surg 30:515, 2001.
Akalin E, Chandraker A, Russell ME, et al: CD28-B7 T cell costimulatory blockade by CTLA4-Ig in the rat renal allograft model. Transplantation 62:1942–1945, 1996.
Adin DB, Thomas WP, Adin CA, et al: Echocardiographic evaluation of cats with chronic renal failure [abstract]. ACVIM Proceedings, May 25, 2000, p 714.
Aronson LR: Retroperitoneal fibrosis in four cats following renal transplantation. J Am Vet Med Assoc 221:984, 2002.
Aronson LR, Drobatz K, Hunter C, et al: Effects of CD28 blockade on subsets of naïve T cells in cats. Am J Vet Res 66:483–491, 2005.
Aronson LR, Gregory CR: Possible hemolytic uremic syndrome in three cats after renal transplantation and cyclosporine therapy. Vet Surg 28:135, 1999.
Aronson LR, Kyles AE, Preston A, et al: Renal transplantation in cats diagnosed with calcium oxalate urolithiasis: 19 cases (1997–2004). J Am Vet Med Assoc 228:743, 2006.
Aronson LR, Preston A, Bhalereo DP, et al: Evaluation of erythropoiesis and changes in serum erythropoietin con- centration in cats after renal transplantation. Am J Vet Res 64:1248, 2003.
Aronson LR, Stomhoffer J, Drobatz K, et al: Effect of cyclosporine, dexamethasone, and human CTLA4-Ig on production of cytokines in lymphocytes of clinically normal cats and cats undergoing renal transplantation. Am J Vet Res, April 2011, in press.
Buback JL, Boothe HW, Carroll GL, et al: Comparison of three methods for relief of pain after ear canal ablation in dogs. 1996.
Cambridge AJ, Tobias KM, Newberry RC, et al: Subjective and objective measurements of postoperative pain in cats. 2000.
Cao L, Tanga FY, Deleo JA: The contributing role of CD14 in toll-like receptor 4 dependent neuropathic pain. 2009.
Clivatti J, Sakata RK, Issy AM: Review of the use of gabapentin in the control of postoperative pain. 2009.
Polymorphisms and tissue expression of the feline leukocyte antigen class I loci FLAI-E, FLAI-H, and FLAI-K Jennifer C Holmes 1, Savannah G Holmer, Peter Ross, Adam S Buntzman, Jeffrey A Frelinger, Paul R Hess. 2013.
Дата добавления: 2021-03-18; просмотров: 50; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
