Порядок выполнения практической работы
ЕН.01 Химия
Тема: Решение термохимических задач (тепловой эффект реакции, энтальпия и энтропия химической реакции)
Цель: Закрепить навык решения задач.
Теоретические основы
Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Например: Термохимическое уравнение разложения малахита
(CuOH)2 CO3 = 2CuO + H 2 O + CO 2 - 47 кДж
Мы видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества.
Решим задачи:
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mq + O2 = 2MqO + 1204 кДж
| Дано: m (Mg0) = 120г Найти: Q1 -? | Решение: 1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу. n = m / M n(MqO) = 120г/ 40 г/моль = 3 моль 2) Составляем пропорцию с учетом коэффициентов в уравнении реакции По уравнению 2 моля MqO - 1204 кДж По условию 3 моля MqO - Q1 |
Отсюда
| 3 моль* 1204кДж | |||
| Q1 | = | ----------------------- | = 1803 кДж |
| 2моль |
Ответ: При образовании 120г оксида магния выделится 1803 кДж энергии.
Задача 2. Сколько выделится теплоты при получении 1 кг железа по реакции
Fe2O3(к)+3СО(г)=2Fe(к)+3СО2(г), если энтальпии образования Fe2O3(к), СО(г) и СО2(г) соответственно равны (кДж/моль): -822,7; -110,6 и -394,0.
Решение
1.Вычисляем тепловой эффект реакции (DH), используя следствие из закона Гесса.

Так как энтальпия образования простого вещества принимается равной нулю то, 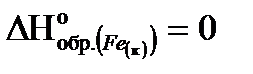 .
.
Тогда
 кДж
кДж
1. Проведем расчет по термохимическому уравнению:
если образуется 2×56г Fe, то выделяется 27,2 кДж;
если образуется 1000г Fe, то выделяется х кДж.
Решаем пропорцию и получаем
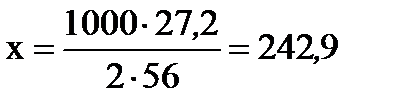 кДж, т.е.
кДж, т.е.
выделится 242,9 кДж теплоты.
Задача 3. Реакция горения этана выражается термохимическим уравнением
C2H6(г) + 3½O2 = 2 CO2(г) + 3H2O (ж); ΔHх.р. = -1559,87 кДж. Вычислите теплоту образования этана, если известны теплоты образования СО2(г) и Н2О(ж)
Решение.
Исходя из следующих данных:
а) С2Н6(г) + 3 ½О2(г) = 2СО2(г) + 3Н2О(ж); ΔН = -1559,87 кДж
б) С (графит) + О2(г) = СО2(г); ΔН = -393,51 кДж
в) Н2(г) + ½О2 = Н2О(ж); ΔН = -285,84 кДж
На основании закона Гесса
С2Н6 = 3 ½О2 – 2С – 2О2 – 3Н2 – 3/2О2 = 2СО2 + 3Н2О – 2СО2 – 3Н2О
ΔН = -1559,87 – 2(-393,51) – 3(-285,84) = +84,67 к Дж;
ΔН = -1559,87 + 787,02 + 857,52; С2Н2 = 2С + 3Н2;
ΔН = +84,67 кДж
Следовательно
∆Hобр С2Н6= -84,67 кДж
Порядок выполнения практической работы
Решите следующие задачи
1.Сколько выделится теплоты при сжигании 1 кг алюминия, если  кДж/моль.
кДж/моль.
2.Согласно термохимическому уравнению реакции
CH4+ 2O2 = CO2 +2H2O + 802 кДж
определите количество теплоты, выделившейся при сжигании 24 г метана.
3. По термохимическому уравнению H2+ Cl2 = 2HCl + 184,36 кДж рассчитайте, какой объем затрачен на образование хлороводорода (при н.у.), если при этом выделилось 921,8 кДж теплоты.
4. При взаимодействии 1 моль водорода и 1 моль хлора выделяется 184 кДж. Чему равна энтальпия образования хлористого водорода ?
Контрольные вопросы:
1. Что называется тепловым эффектом химической реакции (DH)?
2. Перечислите факторы, влияющие на тепловой эффект химической реакции (DH).
3. Какие реакции называются экзотермическими и эндотермическими? Приведите примеры.
4. Какой знак имеет тепловой эффект (DH) для экзотермических и эндотермических реакций?
5. Дайте определение стандартной энтальпии образования сложного вещества .
6. Дайте формулировку закона Гесса.
7. Сформулируйте следствия из закона Гесса.
Сформулируйте вывод по работе
Дата добавления: 2021-03-18; просмотров: 87; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
