РАСЧЕТ ДИПОЛЬНЫХ МОМЕНТОВ ИЗ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ
Федеральное агентство по образованию Российской Федерации
Тверской государственный технический университет
Кафедра «биотехнологии и химии»
Методическое указание к практикуму по физической химии
Лабораторная работа № 10
«Анализ бинарной смеси».
Тверь, 2006
СТРОЕНИЕ МОЛЕКУЛ, ЭЛЕКТРИЧЕСКИЕ И
ОПТИЧЕСКИЕ СВОЙСТВА.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Строение молекул определяет химические свойства веществ и их реакционную способность, а также силы межмолекулярного взаимодействия, от которых зависит ряд физических свойств веществ.
Для определения строения молекул важно знать их основные электрические и оптические характеристики - электрический дипольный момент µ и поляризуемость α.
ЭЛЕКТРИЧЕСКИЙ ДИПОЛЬНЫЙ МОМЕНТ И ПОЛЯРИЗУЕМОСТЬ
Любая молекула представляет собой совокупность положительно заряженных ядер и отрицательно заряженных электронов. В нейтральной молекуле при суммарном заряде всех ядер, равном + q, заряд всех электронов равен - q. Если распределение в пространстве ядер и электронов таково, что электрические центры тяжести положительных и отрицательных зарядов не совпадают, молекула обладает постоянным электрическим дипольным моментом
µ = ql
где l – длина диполя, l – расстояние между центрами тяжести электрических зарядов, вектор, направленный от отрицательного к положительному полюсу.
|
|
|
Такая молекула называется полярной. Мерой полярности служит электрический дипольный момент. Единицей его измерения в системе СИ является 1 Кл*м.
Дипольный момент - векторная величина. Направление момента избирается от отрицательного к положительному полюсу. Однако в химической литературе традиционно принимается противоположное направление.
У двухатомных молекул, построенных из одинаковых атомов, и у многоатомных молекул, обладающих высокой симметрией, центры тяжести разноименных электрических зарядов совпадают (l = 0). Такие молекулы не обладают постоянным дипольным моментом (µ = 0) и называются неполярными.
Если неполярную молекулу поместить в электрическое поле (создаваемое конденсатором или полярной молекулой, ионом и т. п.), то возникает явление поляризации, состоящее в смещении зарядов (деформационная поляризация). Электроны, обладающие незначительной массой, сильно сдвигаются в сторону положительной обкладки конденсатора, положительного иона и т. п., ядра же атомов, более тяжелые, несколько смещаются в противоположном направлении. Центры тяжести положительных и отрицательных зарядов теперь уже совпадать не будут, и возникает индуцированный электрический дипольный момент,
|
|
|
пропорциональный напряженности поля Е:

Под Е понимается макроскопическое поле, являющееся результатом суперпозиции поля, создаваемого внешними источниками, и поля зарядов, входящих в состав молекул.
Коэффициент пропорциональности αд называют деформационной поляризуемостью.
Электронная поляризуемость зависит от смещения электронов, атомная — от смещения атомных ядер и атомных групп. Чем более удалены внешние электроны молекулы (атома) от ядер, тем выше электронная поляризуемость. Смещение атомных ядер, тяжелых по сравнению с электронами, невелико, и αат составляет 5—10% от αэл. Поэтому приближенно αд = αэл.
Полярные молекулы в электрическом поле также испытывают деформационную поляризацию. Кроме того, под влиянием поля они ориентируются вдоль силовых линий поля, стремясь тем самым принять устойчивое положение, отвечающее минимуму потенциальной энергии. Это явление, называемое ориентационной поляризацией, дает макроскопический эффект, эквивалентный увеличению поляризуемости на величину αор, называемую ориентационной поляризуемостью:
|
|
|

тде κ — постоянная Больцмана; Т — температура, К.
Ориентационная поляризуемость обычно на порядок выше, чем αд. Из уравнения (3.4) следует, что αор уменьшается с ростом Т, так как тепловое движение препятствует ориентации молекул.
Полная поляризуемость α является суммой трех величин:
α = αэл+ αат+ αор
Как следует из уравнений (3.2) и (3.4), в обеих системах единицы поляризуемости α имеет размерность объема.
МОЛЯРНАЯ ПОЛЯРИЗАЦИЯ
В электрическом (электромагнитном) поле молекулы вещества поляризуются, и макроскопическое поле в веществе оказывается в е раз меньше, чем оно было бы в вакууме, если бы заряды на проводниках, создающие поле, и сами проводники остались неизмененными. Безразмерная величина е — диэлектрическая проницаемость вещества характеризует влияние среды на взаимодействие зарядов. Величина е входит в уравнение закона Кулона и может быть измерена сравнительно просто.
Диэлектрическая проницаемость связана с поляризуемостью молекул уравнением Клаузиуса — Мосотти:

|
|
|
где N — число молекул в единице объема.
Умножив обе части равенства на отношение молекулярной массы вещества М к его плотности р, получим

где Nа — постоянная Авогадро.
Функция П называется молярной поляризацией и имеет размерность объем/моль. Она характеризует поляризованность (интенсивность поляризации) Р в объеме 1 моль при напряженности поля Е, равной единице 
Получаем уравнение Дебая:

Полная поляризация наблюдается только в статическом поле и поле низкой частоты. В поле высокой частоты диполи не успевают ориентироваться. Поэтому, например, в поле инфракрасного излучения возникает электронная и атомная поляризация, а в поле видимого света —только электронная поляризация  так как благодаря высокой частоте колебаний поля смещаются только легкие частицы —электроны. Для неполярных веществ
так как благодаря высокой частоте колебаний поля смещаются только легкие частицы —электроны. Для неполярных веществ 
РЕФРАКЦИЯ
Электромагнитная теория Максвелла для прозрачных неполярных веществ приводит к соотношению
ε = n2
где n — показатель преломления.
Для полярных веществ ε >n2.
Подставив в уравнение  величину n2 вместо ε и αэл вместо α[при выводе уравнения ε = n2 учитывается только αэл], получим:
величину n2 вместо ε и αэл вместо α[при выводе уравнения ε = n2 учитывается только αэл], получим:
 (1)
(1)
Величину R=(n2-1/n2+2) М/р называют молярной рефракцией.
Из уравнения (1) следует, что величина R, определяемая через показатель преломления вещества, служит мерой электронной поляризуемости его молекул.
В физико-химических исследованиях пользуются также удельной рефракцией.

|
|
Удельная рефракция имеет размерность объема, отнесенного к массе вещества (см3/г), а молярная — объема, отнесенного к количеству вещества (см3/моль). Обычно, для простоты указывают см3, помня, однако, что речь идет об удельной или молярной рефракции. Весьма приближенно можно рассматривать молекулу как сферу радиуса гм с проводящей поверхностью. Можно показать, что в этом случае

 (*)
(*)
| Тогда из уравнения (1) получим: |
Таким образом, молярная рефракция равна собственному объему молекул 1 моль вещества.
Для неполярных веществ R~П, для полярных R меньше П на величину ориентационной поляризации.
Как следует из уравнения (1), величина молярной рефракции определяется только поляризуемостью и поэтому не зависит от температуры и агрегатного состояния вещества. Таким образом, рефракция является характеристической константой вещества.
Аддитивность рефракции. Рефракция - мера поляризуемости молекулярной электронной оболочки.
Можно предположить, что поляризуемость молекулы приближенно равна сумме поляризуемостей составляющих ее атомов или ионов и, соответственно, молярная рефракция равна сумме атомных или ионных рефракций. Рассчитывая рефракцию молекулы через рефракции составляющих ее частиц, следует учитывать также валентные состояния атомов и особенности их расположения, для чего вводят слагаемые — инкременты двойной связи —С=С—, тройной связи —С=С— и др., а также поправки на особое положение отдельных атомов и групп в молекуле:
R=Σ Ra + ΣRi (2)
|
|
где Ra и Ri — соответственно атомные рефракции и инкременты связей. Значения Ra и Ri приведены в справочнике Равделя.
Уравнение (2) выражает правило аддитивности молярной рефракции. Физически более обоснован способ расчета рефракции как суммы рефракций не атомов, а связей (С—Н, О—Н, N—Н, С=О и т. д.), поскольку поляризуются светом именно валентные электроны, образующие связь. Оба метода приводят практически к одинаковым результатам.
Молярную рефракцию соединений, построенных из ионов, рассчитывают как сумму ионных рефракций.
Правило аддитивности (2) может быть использовано для установления строения молекул: сравнивают R, найденную из данных опыта, с рассчитанной по уравнению (2) для предполагаемой молекулярной структуры. Совпадение значений служит подтверждением предполагаемого строения. Расхождения до 0,2—0,4 см3 относят за счет возможных погрешностей опыта и неточности самих аддитивных констант. У ионных соединений небольшие отклонения от аддитивности связаны с взаимной поляризацией ионов.
Наблюдаемое в ряде случаев явление экзальтации рефракции состоит в значительном превышении экспериментального значения R по сравнению с вычисленным по уравнению (2). Экзальтация указывает на наличие в молекуле сопряженных кратных связей, например:
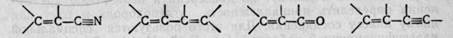
В молекулах с такими связями π-электроны могут свободно перемещаться вдоль этой системы сопряженных связей. Они легко смещаются под действием поля, благодаря чему молекула обладает повышенной поляризуемостью, и наблюдается экзальтация рефракции. Если экспериментальное значение оказывается меньше рассчитанного по аддитивности, то либо неверна брутто-формула вещества, либо допущены погрешности при измерении.
Рефракция растворов. Аддитивность имеет место и для рефракции жидких смесей (растворов). Рефракция смеси равна сумме рефракций компонентов, отнесенных к их долям в смеси.
Для молярной рефракции бинарной смеси можно написать:

аналогично для удельной рефракции:
 (3)
(3)
аналогично для удельной рефракции:
 (4)
(4)
где индексы 1 и 2 относятся к компонентам; х1 и g1 — доли первого
компонента, молярная в уравнении (3) и массовая в уравнении (4) соответственно.
Формулы (3) и (4) используются для определения состава смесей и рефракции компонентов.
Рефракция и размеры молекул. Рефракцию можно использовать
для вычисления средней электронной поляризуемости молекулы или иона
[см. уравнение (1)] и эффективного радиуса частицы [см. уравнение (*)].
Следует помнить, что полученное значение гм верно лишь как первое приближение.
Дисперсия молярной рефракции. Дисперсией называется зависимость рефракции или показателя преломления света от длины волны. При нормальной дисперсии показатель преломления п возрастает с уменьшением длины волны. Дисперсию можно характеризовать разностью значений рефракции (Rα —
Rβ) при двух различных длинах волн αиβ. Однако чаще мерой дисперсии служит безразмерная величина — относительная дисперсия

где nр, nс и n0 — показатели преломления, измеренные для линий F (λ=
=486,1 нм) и С (λ=656,3 нм) водорода и линии D натрия (λ=589,3 нм).
Относительная дисперсия wFCD очень чувствительна к присутствию и п
оложению кратных связей в молекуле, например для парафинов wFCD ~17,
а для ароматических соединений wFCD =30. Это позволяет по дисперсии
и показателю преломления определить принадлежность углеводорода к тому или иному классу соединений. Для этого пользуются специальной классификационной таблицей (см. Б. В. Иоффе. Рефрактометрические методы в химии. Л., Химия, 1983).
РАСЧЕТ ДИПОЛЬНЫХ МОМЕНТОВ ИЗ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ
Для определения дипольных моментов молекул используют уравнение Дебая :
 (5)
(5)
Первый метод определения сводится к измерению диэлектрической проницаемости е и показателя преломления по при постоянной температуре. Измерив ε, рассчитывают стоящую в левой части равенства полную поляризацию. Величину деформационной поляризации заменяют на практически равную ей Rd — рефракцию.
Дипольный момент рассчитывают по уравнению, полученному
из равенства (5) при замене Пд на Rd:
 (6)
(6)
Вычислить дипольный момент по уравнению (6) можно, когда исследуемое вещество находится в состоянии газа или разбавленного раствора в неполярном растворителе. (В последнем случае расчет будет менее точен.) Для чистых полярных жидкостей этот способ расчета неприменим, поскольку не учитывается электростатическое взаимодействие полярных молекул и их ассоциация.
Молекулы полярных веществ, находящиеся в состоянии разбавленных растворов в неполярных растворителях, удалены друг от друга и ассоциированы в очень малой степени. Вследствие этого поляризацию раствора можно принять равной сумме поляризаций растворителя и растворенного вещества.
Связь между поляризацией оаствора П и поляризациями растворителя П1 и растворенного вещества П2 выражается уравнением:

где х1 и х2 — соответственно молярные доли растворителя и растворенного вещества.
Измеряют диэлектрические проницаемости и плотности раствора и чистого растворителя. Тогда

Найдя П и П1, рассчитывают П2. Аналогично определяют рефракцию, и по формуле (6) находят µ.
Менее точно можно рассчитать дипольные моменты молекул по величинам диэлектрической проницаемости и показателям преломления чистых жидкостей.
Хорошие результаты для чистых полярных жидкостей дают уравнения, выведенные с учетом взаимодействия диполей, например уравнение Онзагера:

или уравнение Сыркина:

Обе формулы неприменимы к жидкостям, в которых имеется ассоциация за счет водородных связей (например, вода, спирт).
Второй, более точный метод определения µ состоит в измерении диэлектрической проницаемости диэлектрика в газообразном состоянии или в разбавленном растворе при нескольких температурах.
Уравнение Дебая (5) можно представить в виде уравнения прямой П=А+В/Т, где А = ПД и В=4/9πNАµ2/k — константы, не зависящие от температуры.
Измерив ε при нескольких температурах, строят график П = f(1/T). Прямая отсекает на оси абсцисс отрезок A = ПД. Тангенс угла наклона равен В. Отсюда находят дипольный момент (в Д)

Из A = ПД рассчитывают деформационную поляризуемость αд. Если известна R∞=4/3πNАαэл, то отсюда определяют αат=αд - αэл»
Дипольные моменты многоатомных молекул приближенно равны геометрической сумме моментов отдельных связей и атомных групп в молекуле. Сравнивая экспериментальное значение дипольного момента с рассчитанным по правилу векторной суммы, можно судить о справедливости предполагаемого расположения групп в молекуле, величине валентных углов и т. п.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
РЕФРАКТОМЕТРИЯ
Экспериментальное определение рефракции вещества сводится к измерению его показателя преломления и плотности.

Рис. 1. Преломление луча на границе двух прозрачных сред.

Рис..2. Схема направления лучей при полном внутреннем отражении:
а00b0 — ход лучей при предельном угле; а'Оb' — ход лучей при полном внутреннем отражении.
Измерение показателя преломления. Когда свет пересекает границу раздела двух прозрачных сред X и В (рис. 1), между углом падения х и углом преломления β имеет место соотношение (закон преломления света)

Здесь nвх— величина постоянная, называемая относительным показателем преломления среды В по отношению к среде X; если в качестве среды X выбран вакуум, то показатель преломления nвх называют абсолютным показателем преломления и обозначают nв. Среда с большим показателем преломления называется оптически более плотной. Допустим, что nв>nх. Тогда

Если луч будет идти из среды В по направлению к среде X, то при некотором угле β=β0 угол х примет значение х0=900. При этом луч, дойдя до поверхности раздела, далее пойдет вдоль этой поверхности:

Если направить луч в среде В под углом β'>β0 , то он вообще не попадает в среду X, отразившись от поверхности раздела (рис.2). Это явление называется полным внутренним отражением. Угол βо носит название предельного угла.
На измерении предельного угла основано действие рефрактометров— приборов, применяемых для измерения показателя преломления жидкостей и твердых тел. В лабораторном практикуме обычно применяются рефрактометры двух типов: рефрактометр типа Аббе и рефрактометр Пульфриха.
Лабораторная работа № 10
Анализ бинарной смеси
Цель работы: определение количественного состава смеси по рефракции.
Дата добавления: 2021-02-10; просмотров: 874; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

