Проверка закона Бугера – Беера.
Федеральное агентство по образованию Российской Федерации
Тверской государственный технический университет
Кафедра «биотехнологии и химии»
Методическое указание к практикуму по физической химии
Лабораторная работа № 14
«Проверка закона Бугера – Беера».
Тверь, 2006
СПЕКТРОФОТОМЕТРИЯ
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Сущность спектрофотометрии
Спектрофотометрия – метод исследования и анализа, основанный на измерении спектров поглощения в оптической области электромагнитного излучения.
Спектрофотометрия широко применяется для исследования органических и неорганических веществ, для качественного и количественного определения различных веществ, для контроля технологических процессов и окружающей среды.
По типам изучаемых систем спектрофотометрию обычно делят на атомную и молекулярную. Спектры возникают при переходе системы из одного стационарного состояния в другое. При этом система поглощает или испускает энергию в виде кванта, величина которого равна разности энергии двух состояний:
hν = E2 – E1
где h – постоянная Планка; ν – частота кванта света.
Вместо частоты ν используют волновое число ω = ν/с = 1/λ, где с – скорость света; λ – длина волны. Волновое число ω также называют частотой. Тогда частота спектральных линий определяется по формуле:
|
|
|
ω = (Е2 – Е1)/сh
В свою очередь, энергетическое состояние определяется свойствами электронных оболочек атомов и молекул, колебаниями атомных ядер в молекулах и вращением молекул. Различают спектроскопию в инфракрасной (ИК), видимой и ультрафиолетовой (УФ) областях спектра.
Съёмка молекулярных спектров основывается на следующем законе: молекула поглощает электромагнитное излучение только таких длин волн, какие она может излучать. При пропускании пучка лучей, имеющего сплошной спектр, сквозь слой определяемого вещества последнее поглощает лучи определённых длин волн. По спектральному составу света, поглощаемого молекулами данного вещества, можно судить о природе этих молекул. На этом основаны качественная и структурная спектроскопия. Применение спектроскопии в УФ и видимой областях спектра основано на поглощении электромагнитного излучения соединениями, содержащими хромофорные и ауксохромные группы.
Количественный спектральный анализ основана на том, что количество поглощаемой энергии зависит от числа молекул, принимающих участие в этих процессах. Основным законом, на котором основан количественный спектрофотометрических анализ, является закон Бугера-Ламберта-Бера.
|
|
|
Закон Бугера-Ламберта-Бера : каждая молекула (ион) растворённого вещества поглощает одинаковую часть монохроматического излучения; интенсивность излучения после прохождения слоя раствора уменьшается экспоненциально с увеличением концентрации растворённого вещества, а оптическая плотность линейно увеличивается с ростом концентрации. Этот закон объединяет два более простых закона: закон Бугера-Ламберта и закон Бера.
Закон Бугера-Ламберта: говорит о том, что каждый слой однородного вещества поглощает равную долю падающего на него монохроматического излучения.
Закон Бера: устанавливает связь между поглощением и концентрацией: поглощение монохроматического излучения прямо пропорционально концентрации поглощающего вещества.
Вывод закона Бугера-Ламберта-Бера: В толще раствора мысленно выделим элементарный слой сечением 1 см2 и толщиной dx см. Объём этого слоя равен dx см3. Если концентрацию раствора выразить через число молекул (ионов) растворённого вещества в 1 см3, то их количество в элементарном слое равно Ndx. Направим на элементарный слой, перпендикулярно к нему поток излучения с длиной волны лямбда и интенсивностью I (интенсивность равна энергии излучения, падающего на единицу поверхности в единицу времени). Предположим, что монохроматическое излучение с длиной волны лямбда поглощается только молекулами растворённого вещества и притом в равных количествах. Тогда уменьшение интенсивности излучения при прохождении через элементарный слой будет пропорционально числу поглощающих молекул и интенсивности падающего излучения:
|
|
|
-dI = εNIdx
Принимая во внимание, что  представим полученное выражение в виде:
представим полученное выражение в виде:
d ln I = -εNdx (1)
Проинтегрируем уравнение (1) от начальной интенсивности I0 (х=0) до его конечного значения I (х=l):
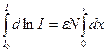 (2)
(2)
или
 (3)
(3)
|
|
|
Коэффициент пропорциональности ε-молекулярный коэффициент поглощения. Он равен поглощению излучения с данной длиной волны лямбда, приходящемуся на одну поглощающую частицу (молекулу или ион).
Выразим концентрацию числом грамм-молекул растворённого вещества в 1 л раствора, т.е. через молярность- с.
N = NAc/1000
Подставив полученную величину в уравнение (3) и перейдя к десятичным логарифмам, получим

Объединим постоянные, обозначив их символом К:
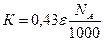 (4)
(4)
Коэффициент К получил название молярного коэффициента поглощения.
Перепишем уравнение (3) с учётом зависимости (4)
 (5)
(5)
D = Kcl (6)
Величину D назовём оптической плотностью. Оптическая плотность является мерой измерения интенсивности монохроматического излучения в результате взаимодействия излучения с растворённым веществом.
Уравнения (5) и (6) являются математическими формулировками двух законов поглощения монохроматического излучения. Уравнение(5) - закон Бугера-Ламберта,а уравнение (6) - закон Бера.
В обобщенном виде:  - закон Бугера-Ламберта-Бера.
- закон Бугера-Ламберта-Бера.
Закон Ламберта справедлив при любой толщине слоя, если свет является монохроматичным, т.е. характеризуется только одной определённом частотой колебаний. Несоблюдение условия монохроматичиности света приводит к нарушению этого закона, так как коэффициент поглощения зависит от длины волны.
Область применения закона Бера является значительно более узкой, так как он предполагает независимость коэффициента поглощения от концентрации. Однако в растворах небольших концентрации коэффициент поглощения изменяется с ростом концентрации, так как при этом изменяется состояние вещества в растворе (вследствие ассоциации, диссоциации, полимеризации и т.д.).
Отношение  называется пропусканием, изменяется от 0 до 1 (или от 0 до 100%).
называется пропусканием, изменяется от 0 до 1 (или от 0 до 100%).
Чаще пользуются величиной оптической плотности D:
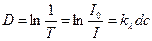
Величина оптической плотности может принимать любые значения - от 0 до бесконечности. Однако при количественных измерениях точные результаты получаются при величине оптической плотности от 0,2 до 0,8.
Если поглощение излучения раствором подчиняется закону Бугера-Ламберта-Беера, то зависимость оптической плотности раствора от его концентрации прямолинейна, при отклонении от этого закона прямолинейная зависимость D = f(c) нарушается.
Спектр поглощения любого вещества представляет собой график, где на оси абсцисс отложены длины волн, а на оси ординат – оптические плотности D или пропускание T.
Работа №14
Проверка закона Бугера – Беера.
Цель работы: Изучение и применение закона поглощения света.
Приборы и реактивы: фотоколориметр, набор кювет, конические колбы ёмкостью 50 мл, мерные колбы ёмкостью 50 мл, пипетка ёмкостью 10 мл, раствор 0,3 М CuSO4 в 0,05 н. H2SO4, раствор 0,05 н. H2SO4.
Порядок выполнения работы:
Готовят серию растворов CuSO4 в 0,05 н. H2SO4 (0,3; 0,15; 0,075 и 0,01875М). Измеряют оптическую плотность приготовленных растворов при одной и той же длине волны, отвечающей максимуму поглощения. Для измерений используют кювету длиной 1 см.
Из каждого значения оптической плотности рассчитывают молярный коэффициент поглощения. Результаты опыта заносят в таблицу:
Длина кюветы …. Длина волны ….
| Концентрация раствора с | Оптическая плотность D | Молярный коэффициент поглощения К |
Исследовав зависимость D от с, переходят ко второй части работы: измеряют оптическую плотность растворов одной определённой концентрации, применяя кюветы разной длины. Вычисляют молярный коэффициент поглощения по результатам каждого измерения
Полученные данные заносят в таблицу:
Концентрация раствора …. Длина волны ….
| Длина кюветы l, см | Оптическая плотность D | Молярный коэффициент поглощения К |
По данным обеих таблиц строят графики D = f (c) и D = f (l). Из графиков находят среднее значение молярного коэффициента поглощения.
На основе эксперимента делают вывод о том, соблюдается ли закон Бугера – Беера.
Выбор светофильтра:
Для выбора светофильтра готовят два раствора, отличающееся на 10 – 15% по концентрации, измеряют их оптические плотности, применяя по очереди все имеющиеся светофильтры. Светофильтры, при работе с которыми разность оптической плотности двух растворов максимальна, избирают в качестве рабочего.
Можно использовать таблицу цветов видимого излучения.
| Приблизительная область длин волн, нм | Цвет | Дополнительный цвет |
| 400 - 450 | Фиолетовый | Жёлто-зелёный |
| 450 - 480 | Синий | Жёлтый |
| 480 - 490 | Зелёно-синий | Оранжевый |
| 490 - 500 | Сине-зелёный | Красный |
| 500 - 560 | Зелёный | Пурпурный |
| 560 - 575 | Жёлто-зелёный | Фиолетовый |
| 575 - 590 | Жёлтый | Синий |
| 590 - 625 | Оранжевый | Зелёно-синий |
| 625 - 750 | Красный | Сине-зелёный |
Дата добавления: 2021-02-10; просмотров: 401; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
