Схема анализа смеси катионов первой аналитической группы
Практическая работа №1
Тема: Составление схемы анализа смеси катионов первой аналитической
группы
Цель работы: изучить качественные реакции катионов первой
аналитической группы
Методические рекомендации
Общая характеристика катионов первой аналитической группы
К первой аналитической группе анионов относятся Li+,Na+,K+,NH4+, (Mg2+) и некоторые другие катионы. Все эти катионы не имеют общего группового реактива и поэтому они одновременно не могут быть осаждены каким-либо реактивом. Это отличает I группу катионов от всех остальных групп, имеющих групповые реактивы. Отличительной чертой катионов I аналитической группы является то, что большинство их солей хорошо растворимы в воде. Наиболее растворимыми являются соединения натрия и калия. Так, например, хорошо растворяются в воде хлориды, фториды, карбонаты, сульфаты, фосфаты, сульфиды, гидроксиды и многие другие соединения натрия и калия. Катионы I аналитической группы бесцветны, поэтому их соли образуют бесцветные растворы. Окрашенными соединениями являются хроматы (желтые), бихроматы (оранжевые), манганаты (зеленые), перманганаты (малиново-красные), гексацианоферраты (II) (желтые), гексацианоферраты (III) (красные), гексанитрокобальтаты (III) (желтые и красные). Окраску этих соединений обусловливают соответствующие анионы. Все катионы I аналитической группы, кроме ионов аммония, устойчивы к действию окислителей и восстановителей.
|
|
|
1. NH4+–ионы можно открыть в присутствии всех остальных катионов I аналитической группы при помощи едкого натра или едкого калия.
2. Mg2+–ионы, если они будут присутствовать в этой группе, можно открыть в присутствии всех остальных катионов I аналитической группы при помощи гидрофосфата натрия в присутствии NH4OH.
3. Na+–ионы можно открыть в присутствии остальных катионов I аналитической группы при помощи ацетата уранила и, еще лучше, при помощи ацетата цинк-уранила.
4. К+–ионы невозможно открыть в присутствии остальных катионов I аналиттической группы, так как NH4+–ионы реагируют аналогичным образом со всеми рективами, образующими осадки с К+–ионами.
5. Открытие К+–ионов можно проводить реактивами – NaHC4H4O6 и Na3[Co(NO3)6] в присутствии Na+ и Mg2+–ионов.
6. Так как открытию К+– ионов мешают NH4+-ионы, то при обнаружении К+–ионов необходимо предварительно удалять соли аммония.
7. Для удаления солей аммония с целью открытия ионов калия, можно воспользоваться реакцией с NaOH или Na2CO3. При длительном кипячении указанных реактивов со смесью катионов первой аналитической группы соли аммония разлагаются с выделением аммиака, а соли магния образуют осадок гидроксида магния или гидроксикарбоната магния.
|
|
|
1. РЕАКЦИИ КАТИОНОВ ПЕРВОЙ АНАЛИТИЧЕСКОЙ ГРУППЫ
1.1. Р е а к ц и и к а т и о н а К+
1) Гидротартрат натрия NaHC4H4O6 дает с растворами солей калия белый кристаллический осадок:
KCl + NaHC4H4O6 → KHC4H4O6 ↓ + NaCl
2) Гексанитрокобальтат(III) натрия Na3[Co(NO2)6] дает с катионом К+ желтый осадок комплексной соли гексанитрокобальтата(III) калия-натрия, растворимый в сильных кислотах:
2KCl + Na3[Co(NO2)6]→ 2NaCl + K2Na[Co(NO2)6]↓
3) Микрокристаллоскопическая реакция.
Гексанитрокупрат(II) натрия свинца Na2Pb[Cu(NO2)6] c катионами К+ образует кубические кристаллы черного или коричневого цвета состава К2Pb[Cu(NO2)6]:
Na2Pb[Cu(NO2)6] + 2KCl → К2Pb[Cu(NO2)6]↓ + 2NaCl
1.2. Р е а к ц и и к а т и о н а Na+
1) Дигидроантимонат калия KH2SbO4 образует с катионами Na+ белый кристаллический осадок дигидроантимоната натрия:
NaCl + KH2SbO4 → NaH2SbO4↓ + KCl
2) Микрокристаллоскопическая реакция.
Образование правильной тетраэдрической или октаэдрической формы кристаллы натрийуранилацетата CH3COONa⋅UO2(CH3COO)2. При подкислении уксусной кислотой UO2(CH3COO)2.
1.3. Р е а к ц и и к а т и о н а NH4 +
1) Щелочи разлагают соли аммония с выделением газообразного аммиака:
NH4Cl + NaOH → NH3↑ + NaCl + H2O
|
|
|
2) Реактив Несслера (смесь комплексной соли K2[HgI4] и КОН) образует с катионом аммония красно-бурый осадок. Следует иметь в виду, что получаемый осадок растворим в солях аммония, поэтому реактив Несслера нужно брать в избытке. Кроме того, обнаружению катиона аммония мешают катионы Fe3+, Cr3+, Co2+, Ni2+:
NH4+ + 2[HgI4]2- + 4OH- → [OHg2NH2]I↓ + 7I- + 3H2O
Таблица 3 - Действие реактивов на катионы первой аналитической группы
| Реактивы | Катионы | ||
| Na+ | K+ | NH4+ | |
| NaOH, KOH | – | – | Выделяется NH3 (при кипячении) |
| Na2CO3, K2CO3 (при нагревании) | – | – | Выделяется NH3 (при кипячении) |
| Na2HPO4 | – | – | Выделяется NH3(при кипячении) |
| KH2SbO4 | Образуется белый кристаллический осадок NaH2SbO4, который растворяется в воде при нагреваниии, в щелочах на холоду | – | Образуется белый аморфный осадок HSbO3, который растворяется в соляной кислоте и щелочах |
| NaHC4H4O6 | – | Образуется кристаллический осадок KHC4H4O6, который растворяется в воде при нагревании, в щелочах и кислотах на холоду | Образуется белый кристаллический осадок NH4HC4H4O6, который растворяется в щелочах и кислотах |
| Na3[Co(NO2)6] | – | Образуется желтый кристаллический осадок K2Na[Co(NO2)6 Растворяется в минеральных кислотах | Образуется желтый кристаллический осадок (NH4)2Na[Co(NO2)6], который растворяется в минеральных кислотах |
| UO2(CH3COO)2 или (Zn(UO2)3(CH3COO)8 | Образуется зеленовато-желтый кристаллический осадок CH3COONa× (CH3COO)2UO или лимонно-желтый NaZn(UO2)3(CH3COO)9 | – | – |
| Реакция окрашивания пламени | Пламя окрашивается в желтый цвет | Пламя окрашивается в фиолетовый цвет | |
| Реактив Несслера K2HgJ4 | – | – | [OHg2NH2]J Оранжевый осадок |
| Формалин | – | – | Образуется уротропин |
К первой аналитической группе катионов относятся катионы K+,Na+,NH4+,Li+. Группового реагента данные катионы не имеют. Ионы аммония и калия образуют малорастворимые гексанитрокобальтаты, перхлораты, хлорплатинаты, а также малорастворимые соединения с некоторыми крупными органическими анионами, например, дипикриламином, тетрафенилборатом, гидротартратом и др. Водные растворы солей катионов I группы, за исключением солей, образованных окрашенными анионами, бесцветны.
|
|
|
Гидратированные ионы K+,Na+,Li+ являются очень слабыми кислотами, более выражены кислотные свойства у NH4+(рКa= 9,24). Несклонны к реакциям комплексообразования. В окислительно-восстановительных реакциях ионыK+,Na+,Li+ не участвуют, так как имеют постоянную и устойчивую степень окисления, ионы NH4+обладают восстановительными свойствами.
Обнаружение катионов I аналитической группы проводят по следующей схеме
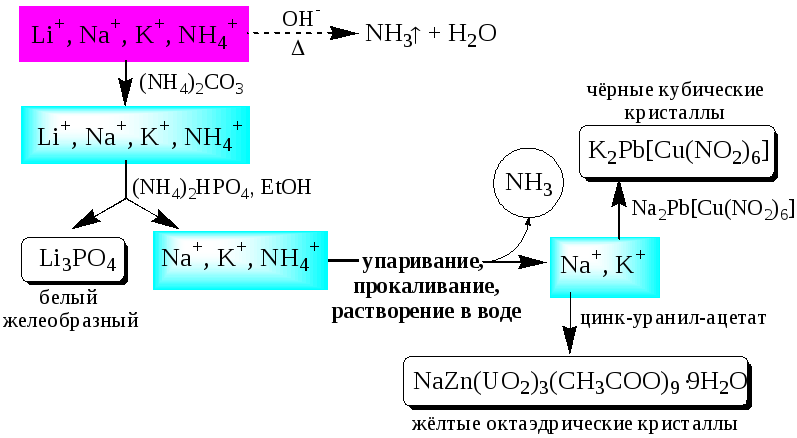
Задание
1. Изучить методические рекомендации
2. Составить схему анализа смеси катионов первой аналитической группы
схема анализа смеси катионов первой аналитической группы
| обнаружение | Группового реагента | реактив | наблюдения | состав | Уравнение реакции |
| Na+ | |||||
| K+ | |||||
| NH4+ |
3. Сделать вывод
Практическая работа № 2
Тема: Составление схемы анализа смеси анионов первой аналитической
группы
Цель работы: изучить качественные реакции анионов первой
аналитической группы
Задание
Изучить материал учебника на странице 175-180 составить схемы анализа смеси анионов первой аналитической группы, используя предложенные таблицы.
| Групповой реагент | анионы | Уравнение реакции с солью, содержащую ион | Реакция осадка на раствор аммиака |
| AgNO3 | Cl- | ||
| Br- | |||
| I- | |||
| S2- |
| реактив | анионы | |||
| Cl- | Br- | I- | S2- | |
| AgNO3 в присутствии НNO3 | ||||
| Сильные окислители | ||||
| Хлорная вода в присутствии бензола | ||||
| Nа NO2 или КNO2 | ||||
Сделать вывод по работе
Практическая работа № 3
Тема: Составление уравнений реакций при окислительно-восстановительном
титровании.
Цель работы: научиться составлять уравнения реакции при окислительно-
восстановительном титровании.
Задание
Дата добавления: 2021-02-10; просмотров: 632; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
