V блок заданий. «Реакции ионного обмена»
Класс. Контрольная работа по теме «Химические реакции»
I блок заданий. Тема «Классификация химических реакций в неорганической и органической химии»
1. К реакциям обмена относится
1) 2Al + Fe2O3 = 2Fe + Al2O3
2) 2NaHCO3 = Na2CO3 + CO2 + H2O
3) 2FeCl2 + Cl2 = 2FeCl3
4) CrCl3 + 3NaOH = Cr(OH)3 + 3NaCl
2. При добавлении к раствору хлорида меди (II) порошка цинка при комнатной температуре протекает реакция
1) Присоединения
2) обмена
3) замещения
4) нейтрализации
3. Реакциями замещения и присоединения соответственно являются
Свет
1) CH4 + Cl2® и C2H2 + Cl2®кат.
2) CH3COONa + HCl®иC6H6 + Br2®
3) H2SO4 + Zn ®и H2SO4 + CuO®
tсвет
4) C8H16 + H2 ® и C2H6 + Cl2®
4. Взаимодействие кальция и соляной кислоты относится к реакциям
1) соединения, экзотермическая
2) замещения, экзотермическая
3) обмена, экзотермическая
4) замещения, эндотермическая
t, p, Fe
5. Реакция получения аммиака N2 + 3H2« 2NH3относится к реакциям
1) замещения и каталитическим
2) обмена и некаталитическим
3) соединения и каталитическим
4) замещения и некаталитическим
II блок заданий. «Скорость химических реакций, её зависимость от различных факторов»
1. Причины увеличения скорости реакции при повышении концентрации веществ является увеличение
1) числа столкновений молекул
2) энергии активации процесса
3) энергии молекул
4) массы или объема вещества
2. При обычных условиях с наименьшей скоростью происходит взаимодействие между
1) Fe и O2
|
|
|
2) Cu и O2
3) Mg иHCl(10% р-р)
4) Zn иHCl(10% р-р)
3. С наибольшей скоростью с кислородом при комнатной температуре реагирует
1) Sn 2) Al 3) Ca 4) Mn
4. При изменении температуры от 10 до 30°С скорость реакции, температурный коэффициент которой g=3,
1) возрастает в 3 раза
2) уменьшается в 3 раза
3) возрастает в 9 раз
4) уменьшается в 9 раз
5. На скорость химической реакции 2NH3(Г) «N2(Г) + 3H2(Г)не влияет изменение
1) концентрация аммиака
2) концентрация водорода
3) давление
4) температура
III блок заданий. «Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов»
1. Укажите условия необратимости химического превращения
1) перемешивание веществ
2) проведение реакции в специальном реакторе
3) выделение газообразных продуктов реакции
4) ослабление окраски раствора
2. Химическое равновесие в системе Cl2 + H2O«HCl + HClO сместится в сторону образования продуктов при добавлении
1) хлорида натрия
2) раствора хлороводородной кислоты
3) раствора хлорноватистой кислоты
4) дистиллированной воды
3. Не влияет на выход продукта реакции изменение давления в системе
1) 2H2(Г) + O2(Г)« 2H2O(Г)
2) N2(Г) + 3H2(Г)« 2NH3(Г)
3) Fe2O3(ТВ) + 3CO(Г)« 2Fe(ТВ) + 3CO2(Г)
|
|
|
4) 2H2S(Г) + 3O2(Г) « 2H2O(Ж) + 2SO2(Г)
4. В системе 2SO2(Г) + O2(Г)« 2SO3(Г) + Q смещение химического равновесия вправо произойдет при
1) добавлении катализатора
2) повышении давления
3) повышении температуры
4) увеличении концентрации оксида серы (VI)
5. В какой системе одновременное увеличение давления и понижение температуры смещает химическое равновесие в сторону продуктов реакции
1) 4NH3(Г)+ 5O2(Г)« 4NO(Г) + 6H2O(Г)+ Q
2) 2SO2(Г) + O2(Г)« 2SO3(Г) + Q
3) N2O(Г)«NO(Г) + NO2(Г) - Q
4) C(ТВ) + 2N2O(Г)«CO2(Г) + 2N2(Г) + Q
IV блок заданий. «Электролитическая диссоциация водных растворов. Сильные и слабые электролиты»
1. Слабым электролитом является раствор
1) соляной кислоты
2) хлорида натрия
3) уксусной кислоты
4) гидроксида натрия
2. Электролитом является каждое из двух веществ
1) глюкоза и этиловый спирт
2) уксусная кислота и бензол
3) сахароза и хлорид натрия
4) ацетат натрия и гидроксид натрия
3. Ионы 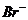 образуются при диссоциации
образуются при диссоциации
1) KBrO3 2) KBr 3) CH3CH2Br 4) NaBrO4
4. Наибольшее число ионов образуется при полной диссоциации 1 моль
1) Na2SO4 2) CuSO4 3) AlCl3 4) CCl4
5. Какие из утверждений об электролитах верны
А. При растворении в воде электролиты диссоциируют на ионы.
Б. Ионы отличаются от атомов по строению и свойствам.
|
|
|
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
V блок заданий. «Реакции ионного обмена»
1. Сокращенному ионному уравнению Cu2+ + Zn = Cu + Zn2+соответствует взаимодействие
1) меди с раствором хлорида цинка
2) гидроксида меди (II) с цинком
3) раствора хлорида меди (II) с цинком
4) оксида меди (I) с цинком
2. Молекулярному уравнению реакции
CuO + 2HNO3®Cu(NO3)2 + H2O
соответствует сокращенное ионное уравнение
1) 
2) 
3) 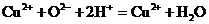
4) 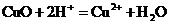
3. Число ионов в сокращенном ионном уравнении реакции взаимодействия между серной кислотой и оксидом магния равно
1) 3 2) 9 3) 5 4) 4
4. При сливании растворов карбоната калия и соляной кислоты в химической реакции участвуют ионы
1) 
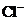
2) 
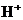
3) 
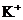
4) 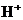 и
и 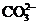
5. Одновременно не могут находиться в растворе все ионы ряда
1) 
2) 
3) 
4) 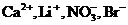
Дата добавления: 2021-01-20; просмотров: 129; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
