Давление газа не зависит от его природы, а определяется только концентрацией молекул и температурой газа.
Урок физики № 22
ТЕМА: Идеальный газ. Давление газа. Основное уравнение молекулярно-кинетической теории газов. Абсолютный нуль температуры. Термодинамическая шкала температуры. Уравнение состояния идеального газа. Молярная газовая постоянная
Делаем краткий конспект и выполняем задания (выделено красным)
Задачи урока:
1. сформировать представление о структуре и содержании новой физической теории;
2. организовать усвоение основных положений МКТ;
3. формирование умений описывать тепловые явления на молекулярно кинетических представлениях о строении вещества;
4. формировать мотивацию постановкой проблем и познавательных задач, раскрытием связи опыта и теории;
5. формировать умение анализировать факты при наблюдении явлений;
6. способствовать воспитанию познавательного интереса к физике, материалистического мировоззрения учащихся.
Организационный момент урока.
Постановка цели урока.
Мы с вами продолжаем изучение основ молекулярно - кинетической теории. На предыдущем уроке мы рассмотрели основные положения МКТ. Сегодня на уроке необходимо на основе МКТ установить количественную зависимость давления газа от массы одной молекулы и среднего квадрата скорости ее движения. Поэтому тема урока: «Идеальный газ. Основное уравнение МКТ»
Записать тетради на оценку ответы на опросы :
1. Что такое молекулярно-кинетическая теория?
|
|
|
2. Сформулируйте основные положения МКТ.
3. Какие наблюдения и эксперименты подтверждают основные положения молекулярно-кинетической теории?
4. Что называют броуновским движением? Каковы его особенности?
5. О чем свидетельствует броуновское движение?
6. Что называют диффузией? Приведите примеры диффузии в газах, жидкостях и твердых телах.
7. От чего зависит скорость диффузии? О чем свидетельствует явление диффузии?
Изучение нового материала.
1. Макроскопические параметры. Идеальный газ.
Состояние газа (так же как жидкости и твердого тела) может быть описано и без рассмотрения молекулярного строения вещества. Это делают с помощью макроскопических величин, совокупность которых однозначно определяет состояние системы. Такие величины называют параметрами состояния (или термодинамическими параметрами).
Параметрами состояния любой системы являются ее объем, давление и температура. Если в каком-либо процессе изменяется хотя бы один из параметров состояния системы, то и само состояние системы становится другим.
Величины, характеризующие состояние макроскопических тел без учета их внутреннего строения называются макроскопическими параметрами.
Идеальный газ – это модель реального газа, которая обладает следующими свойствами:
|
|
|
1. Молекулы пренебрежимо малы по сравнению со средним расстоянием между ними.
2. Молекулы ведут себя подобно маленьким твердым шарикам: они упруго сталкиваются между собой и со стенками сосуда, никаких других взаимодействий между ними нет.
3. Молекулы находятся в непрекращающемся хаотическом движении.
Все газы при не слишком высоких давлениях и при не слишком низких температурах близки по своим свойствам к идеальному газу. При высоких давлениях молекулы газа настолько сближаются, что пренебрегать их собственными размерами нельзя. При понижении температуры кинетическая энергия молекул уменьшается и становится сравнимой с их потенциальной энергией, следовательно, при низких температурах пренебрегать потенциальной энергией нельзя.
При высоких давлениях и низких температурах газ не может считаться идеальным. Такой газ называют реальным . (Поведение реального газа описывается законами, отличающимися от законов идеального газа.)
2. Давление газа. Основное уравнение МКТ газа.
Давление газа определяется столкновением молекул газа со стенками сосуда.
В СИ за единицу давления принимают 1 Па.
|
|
|
Давление, при котором на площадь 1 м2 действует сила давления в 1 Н, называется Паскалем.
1мм.рт.ст. = 133 Па
101атм = 15 Па
Одной из основных задач молекулярно-кинетической теории газа является установление количественных соотношений между макроскопическими параметрами, характеризующими состояние газа (давлением, температурой), и величинами, характеризующими хаотическое тепловое движение молекул газа (скоростью молекул, их кинетической энергией). Одним из таких соотношений является зависимость между давлением идеального газа и средней кинетической энергией поступательного движения его молекул. Эту зависимость называют основным уравнением молекулярно-кинетической теории идеального газа:
 или
или 
где р — давление газа; n — концентрация молекул газа (число его молекул в единичном объеме): m0 — масса молекулы газа,  — средняя квадратичная скорость движения газовых молекул;
— средняя квадратичная скорость движения газовых молекул; 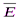 —средняя квадратичная энергия поступательного движения молекул идеального газа.
—средняя квадратичная энергия поступательного движения молекул идеального газа.
Давление идеального газа пропорционально средней кинетической энергии поступательного движения молекул и концентрации молекул.
Это давление тем больше, чем больше средняя кинетическая энергия поступательного движения молекул.
|
|
|
Средней квадратической скоростью называют величину, равную корню квадратному из среднего арифметического значения квадратов скоростей N молекул газа:
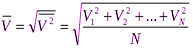
Средней кинетической энергией поступательного движения молекул идеального газа называют величину
 С учетом основного уравнения МКТ имеем:
С учетом основного уравнения МКТ имеем: 
Из этой формулы видно, что средняя кинетическая энергия поступательного движения молекул газа пропорциональна абсолютной температуре.
10В этой формуле k=1,38-23 Дж/К – постоянная Больцмана.
Давление газа зависит от концентрации молекул. Эта зависимость выражается формулой: 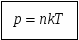
Давление газа не зависит от его природы, а определяется только концентрацией молекул и температурой газа.
Численное значение средней квадратичной скорости получим из формулы
 , т.к.
, т.к.  , то
, то 
При одинаковых давлениях и температурах концентрация молекул всех газов одинакова. В частности, при нормальных условиях
n= Nл 10= 2,725 м-3.
Величину Nл называют числом Лошмидта, оно равно количеству молекул идеального газа, содержащихся в 1 м3 газа при нормальных условиях.
6. Выполняем в тетради (ответы)
1. Что такое макроскопические параметры?
2. Какой газ называют идеальным?
3. Что является моделью идеального газа?
4. При каких условиях газ по своим свойствам близок к идеальному?
5. При каких условиях и почему газ не может считаться идеальным?
6. Что называют абсолютным нулем температуры? Каков физический смысл этого понятия с точки зрения молекулярно-кинетической теории?
7. Чему равно давление идеального газа на стенки камеры при абсолютном нуле температуры?
8. Решение количественных задач:
Задача №1.
Найти концентрацию молекул кислорода, если его давление 0,2 МПа, а средняя квадратичная скорость молекул равна 700 м/с.
Дано: Решение:
 υ=700 м/с
υ=700 м/с
M =32·10 -3 кг/моль n=р/κТ
р =0,2 МПа
n=?
Ответ:
Дата добавления: 2020-12-22; просмотров: 178; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
