Глава 3 Эмбриональные стволовые клетки

|
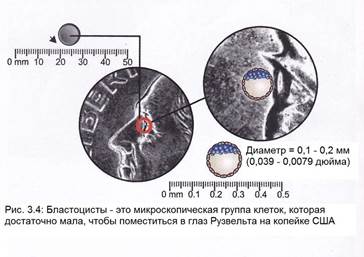
Бластоциста (BLAST-оh-sist) - предимплантационной эмбрион, который развивается через пять дней после оплодотворения яйцеклетки сперматозоидом. Он содержит все материалы, необходимые для развития полноценного человека (рис.3.4 и 3.5).
1. Бластоциста включает три структуры:
2. 1.Трофобласт (наружная масса клеток) представляет собой слой клеток, который окружает бластоцисту.
3. 2.Бластоцель представляет собой полую полость внутри бластоцисты.
4. 3. Внутренняя клеточная масса (эмбриобласт) состоит примерно из 30-34 клеток на одном конце бластоцеля. Ученые называют клетки эмбриобласта плюрипотентными (Lat.: pluris - много, potentis - сила), потому что они могут дифференцироваться во все типы клеток организма.
В общем использовании, термин "эмбрион" относится не ко всем этапам развития, а к этапам от оплодотворения до образования плода. Такие термины, как "морула» и «бластоциста" используются учеными для обозначения точных, конкретных этапов предимплантационного развития (рис. 3.6). Чтобы быть точными, в данной книге используется научные термины при описании научныех понятий, а термин «эмбрион» используется там, где большей точности в этапах развития не нужно, чтобы не запутать.
Во время нормального развития, бластоциста имплантировалась бы в эндометрии матки, чтобы стать зародышем и продолжать развиваться в зрелый организм. В то время как трофобласт начнет формировать плаценту, внутренняя клеточная масса (эмбриобласт) начнет дифференцироваться в более специализированные клетки тела.
Свойство эмбриональных стволовых (ЭС) клеток - плюрипотентность, то есть способность дифференцироваться во все производные трех первичных зародышевых листков:
1. Эктодерма;
2. Энтодерма;
3. Мезодерма.



Эти производные включают не менее 220 типов клеток во взрослом организме. ЭС клетки можно отличить от мультипотентных клеток-предшественников с помощью плюрипотентности. Из мультипотентных клеток-предшественников, найденных у взрослых, образуется лишь ограниченное число типов клеток. ЭС клетки сохраняют плюрипотентность через несколько клеточных делений, если нет стимулов для дифференциации (т.е. при выращивании в пробирке). Хотя наличие взрослых плюрипотентных стволовых клеток остается предметом научных споров, исследования продемонстрировали, что плюрипотентные стволовые клетки могут непосредственно генерироваться из взрослых культур фибробластов.
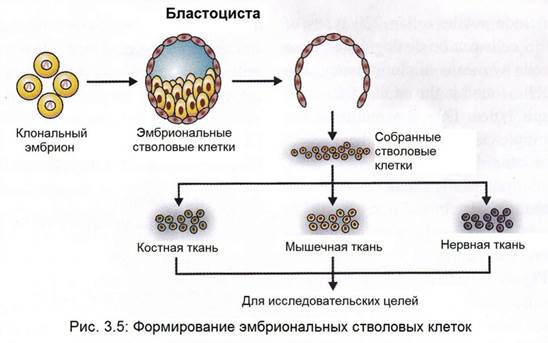
 Как показано на рисунке 3.7, когда бластоциста используется для исследования стволовых клеток, ученые сначала удаляют внутреннюю клеточную массу. Затем они помещают эти клетки в чашку с питательной средой, что, в свою очередь, приводит к размножению эмбриональных стволовых клеток. Эмбриональные стволовые клетки, более гибкие, чем стволовые клетки, находящиеся во взрослом организме (взрослые стволовые клетки), потому что они имеют потенциал к воспроизведению всех видов клеток в организме человека. Их легче собирать, очищать и поддерживать в лаборатории, чем взрослые стволовые клетки. Ученые могут размножать эти эмбриональные стволовые клетки в недифференцированном состоянии в течение очень длительного времени до стимуляции их дифференцировки в специализированные клетки. Это означает, что всего несколько эмбриональных стволовых клеток могут произвести большой банк стволовых клеток для использования в экспериментах. Однако такие недифференцированные стволовые клетки не могут быть непосредственно использованы для трансплантации тканей, поскольку их неконтролируемое деление может вызвать рост опухоли под названием тератома. Эмбриональные стволовые клетки сначала должен быть дифференцированы в специализированные клеточные типы, прежде чем они будут использованы для лечения.
Как показано на рисунке 3.7, когда бластоциста используется для исследования стволовых клеток, ученые сначала удаляют внутреннюю клеточную массу. Затем они помещают эти клетки в чашку с питательной средой, что, в свою очередь, приводит к размножению эмбриональных стволовых клеток. Эмбриональные стволовые клетки, более гибкие, чем стволовые клетки, находящиеся во взрослом организме (взрослые стволовые клетки), потому что они имеют потенциал к воспроизведению всех видов клеток в организме человека. Их легче собирать, очищать и поддерживать в лаборатории, чем взрослые стволовые клетки. Ученые могут размножать эти эмбриональные стволовые клетки в недифференцированном состоянии в течение очень длительного времени до стимуляции их дифференцировки в специализированные клетки. Это означает, что всего несколько эмбриональных стволовых клеток могут произвести большой банк стволовых клеток для использования в экспериментах. Однако такие недифференцированные стволовые клетки не могут быть непосредственно использованы для трансплантации тканей, поскольку их неконтролируемое деление может вызвать рост опухоли под названием тератома. Эмбриональные стволовые клетки сначала должен быть дифференцированы в специализированные клеточные типы, прежде чем они будут использованы для лечения.
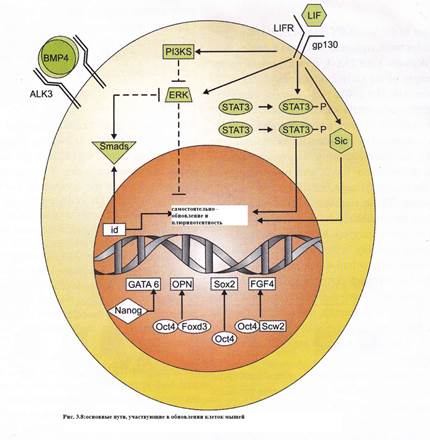
ФАКТОРЫ, ВЛИЯЮЩИЕ НА САМООБНОВЛЕНИЕ И ПЛЮРИПОТЕНТНОСТЬ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК
A. Внешние факторы:
1. LIF (лейкоз ингибирующий фактор)
2. ВMP4
3. bFGF
4. Другие предполагаемые факторы
B. Внутренние факторы:
1. Oct4
2. Sox2
3. Foxd3
4. Nanog
5. miRNA
Внешние факторы, регулирующие поддержание недифференцированного состояния эмбриональных стволовых клеток
Лейкоз ингибирующий фактор (LIF)
LIF принадлежит к семейству интерлейкина-6 (ИЛ-6) цитокинов. Цитокины типа IL-6 стимулируют клетки через рецептор gp130. Gp130 работает в виде гетеродимера вместе с лиганд специфическим рецептором (например, LIF-R). В то время как gp130 экспрессируется во всех клетках организма, специфические субъединицы экспрессируются в клеточно-специфическом образе (СМ). После открытия LIF в качестве активного фактора в СМ, было показано, что онкостатин М (OSM) и цилиарный нейротрофический фактор (CNF) (Conover соавт. 1993), который также принадлежит к семейству IL-6 цитокинов, может заменить потребность в CM. Их сходный эффект, связан с их общими нижестоящими эффекторами.
Активация gpl30 → активация Джануссвязанной тирозинкиназы (JAK), преобразователя сигнала и активатора транскрипции (STAT) → их транслокация в ядро → связывание с ДНК → последующая активация транскрипции.
Было показано, что способность LIF предотвращать дифференцировку MESCs зависит от активации STAT3. Одновременно с этим, активации STAT3 достаточно, даже в отсутствие LIF, для того, чтобы начать размножение клеток. Помимо активации STAT3, которая участвует в поддержании недифференцированного состояния, LIF индуцирует также использование дополнительных сигналов, в том числе активизацией ERKs (внеклеточный рецептор киназы). Активация ERKs способствует дифференциации. Таким образом, баланс между активацией STAT3 и активацией ERK сигналов определяет судьбу делящихся недифференцированных ЭС клеток. Поэтому сигналы, которые контролируют активизацию ERKs также играют важную роль в поддержании недифференцированного состояния.
В последнее время было установлено, что ингибирование PI3K (фосфоинозитид-3-киназы) приводит к дифференциации MESC. Путь сигнализации PI3K также индуцируется LIF, и дифференцирование наблюдается при ингибировании PI3K, что является результатом увеличенных уровней активированных ERKs.
Дополнительный доклад указывает на еще один путь, активируемый LIF в MESC. Этот путь включает в себя активацию семейства безрецепторных тирозинкиназ Src, в частности cYes. Ингибирование этого семейства уменьшает рост и экспрессию ЭС клеточных маркеров, как и в MESC так и в HESC. Активность cYes в MESC регулируется LIF в сыворотке, и она подавляется при дифференцировании. Тем не менее, кажется, что cYes не имеет центральную функцию в живом организме, так как мыши мутировавшие в cYes жизнеспособны и плодородные (табл. 3.1).
| Таблица 3.1: Цитокины, необходимые для самообновления ЭС | |||
| Протеин | Мутантные мыши | Роль в MESC | Роль в обеспечении HESC |
| LIF | Развита до срока, плодовитая, имеет большое значение для | Заменяет необходимость питания клеток. (Smith и др. 1998; Williams и др. | Нет очевидной роль в самообновлении (Daheron и др. 2004) |
| BMP4 | Не переходит за стадию цилиндра яйца. Неспособность к гаструляции и | Заменяет необходимость использования сыворотки (Ying и др. 2003) | Управляет HESC в дифференциации трофэктодермы (Xu и др. 2004) |
| bFGF | Менее жизнеспособны с дефектами в развитии нервной системы (Dono и др., 1998) | Не требуется для размножения MESC | Требуется для замены распространения сывороточных |
Человеческие ЭС клетки (HESC) также требуют совместного культивирования с питательными веществани, но в клетках человека данное требование не может быть заменено добавлением LIF (человеческого или мышиного происхождения). Мышиная LIF не действует на клетки человека, и, следовательно, белок не может секретироваться из MEF клеток, которые поддерживают плюрипотентность HESC. В HESC, как и в MESC, совместное культивирование с питательными веществами может быть замещен добавлением СМ, а длительное время без питательных веществ культуру можно поддерживать в присутствии определенных внеклеточных матриц (например, матригель или ламинин) вместе с СМ.
При исследовании причины отсутствия ответа HESC к LIF, впервые предположили, что это было результатом низкой или отсутствующей экспрессии LIF-R. Однако, когда эта гипотеза была рассмотрена, было отмечено, что различные уровни экспрессии LIF-R могут быть найдены при различных уровнях HESC, в пределах от низких или отсутствующих до значительных уровней экспрессии. Кроме того, недавние работы показали, что причиной отсутствия влияния LIF на HESC - не неспособность клеток отвечать на сигнализации LIF, а активация STAT3 в HESC, которая в MESC является достаточной для самообновления, и не мешает дифференциации HESC. Кроме того, в недифференцированном состоянии HESC, путь STAT3 не активен. В то время как в недифференцированных MESC можно найти высокий уровень фосфорилированного STAT3 (который является активной формой), эту активную форму не увидеть в недифференцированных HESC.
BMP4
BMP4 является членом суперсемейства TGF-бета полипептидных сигнальных молекул, а также, в последнее время было предложено, что он принимает участие в предотвращении дифференциации MESC. LIF достаточно для предотвращения дифференциации MESC в присутствии сыворотки, когда же сыворотка удаляется происходит нейронная дифференциация, даже в присутствии LIF. Поскольку в сыворотке содержится много неизвестных факторов, возможно, что, по крайней мере некоторые из них могут предотвратить дифференциацию ЭС клеток. Добавление BMP4 в среду позволит использовать бессывороточную культуру. Это возможно только в присутствии LIF, поскольку в противном случае происходит дифференциация не нейронных линий. Изъятие как и BMP4 так и LIF приводит к нервной дифференциации. Таким образом, LIF необходим для поддержания недифференцированной емкости ВМР4, которая в отсутствие LIF фактически приводит к дифференциации клетки. Так, кажется, что в то время как BMP4 предотвращает дифференциацию нейронных линий, LIF тормозит дифференциацию не нейронных линий.
BMP4 поддерживает самообновление MESC через активацию Smad белков. Которые активируют Id гены - негативные bHLH факторы. MESC с Id генами могут расти в бессывороточной культуры в отсутствие BMP4. Сыворотка также индуцирует экспрессию гена Id разными путями, и MESC, выращенные в присутствии сыворотки (без дополнения BMP4) показывают экспрессию генов Id.
Добавление же в HESC фактора BMP4 в не увеличивает самообновление клеток, как это наблюдалось при добавлении в MESC. На самом деле BMP4 управляет дифференцировкой в клетках трофобласта. В отличие от MESC, которые не имеют возможности дифференцироваться в этом типе клеток. Эта разница в способностях по созданию трофобласт дала понять, что HESC и MESC могут быть получены на разных стадиях развития, и, следовательно, на их самообновление могут влиять различные факторы.
bFGF
Присутствие bFGF показало, что в постоянной культуре HESC требуется замена сыворотки. В бессывороточной среды не замещенной bFGF, клетки дифференцируются, а дополнение bFGF приводит к длительному недифференцированию культуры. Кроме того, bFGF повышает эффективность клонирования клеток. В то время как добавление bFGF не требуется для размножения MESC, было показано, что добавление bFGF важно для различных плюрипотентных клеток, эмбриональных зародышевых(EG) клеток, как у человека так и у мыши. bFGF необходимы для преобразования переходных пролиферирующих колоний примордиальных зародышевых клеток в бесконечно пролиферирующие колонии EG клеток. Однако, в случае с EG клетками мыши после того, как культура EG клеток создана, bFGF больше не нужен для их постоянной культуры.
Исследователи, изучавшие экспрессию различных элементов путей в сигнализации HESC, доказали присутствие элементов FGF-сигнализации. В том числе всех четырех рецепторов FGF и некоторых компонентов их последующего каскада, которых много в недифференцированных HESC по сравнению с их дифференцированными производными. bFGF экспрессируется в HESC, но, видимо, его уровеня не достаточно, чтобы предотвратить дифференциацию.
Другие предпологаемые факторы
Поскольку ни LIF, ни BMP4 не поддерживают самообновления HESC, продолжается поиск других факторов, которые могут заменить CM в HESC. Даже в MESC есть свидетельства самообновления путей, независимых от активации LIF или STAT3. В связи с этим, вполне вероятно, что еще один физиологический путь имеет основополагающее значение для плюрипотентности человека и мыши.
 Есть отчет о причастности пути Wnt, который в состоянии поддерживать самообновление HESC в течение короткого периода времени (рис.3.8). В другом отчете предположили, что TGFб1, в сочетании с фибронектином и LIF достаточно для потания и без CM культуры. Однако ни один из этих протоколов не используется для регулярно выращивать HESCs в культуре без питательных веществ.
Есть отчет о причастности пути Wnt, который в состоянии поддерживать самообновление HESC в течение короткого периода времени (рис.3.8). В другом отчете предположили, что TGFб1, в сочетании с фибронектином и LIF достаточно для потания и без CM культуры. Однако ни один из этих протоколов не используется для регулярно выращивать HESCs в культуре без питательных веществ.
Внутренние факторы, регулирующие поддержание недифференцированного состояния эмбриональных стволовых клеток Oct4
Oct4 является фактором транскрипции, принадлежащим к семейству факторов транскрипции POU, обладающим последовательностью узнавания октамер, 8-парное основание найденное у промоутеров и усилителей многих повсеместно выраженных и клеточно-спецефических генов. Одной из уникальных особенностей Oct4 является его паттерн экспрессии, который, кажется, ограничивается в плюрипотентных рядах, хотя его реактивации при некоторых видов рака не поступало. Это выражается в ранних 4- и 8-клеточных стадиях эмбриона мыши, пока эпибласт не начнет дифференцироваться, с экспрессией сохраняющейся в половых клетках. Эмбрионы мыши с мутантным Oct4 умирают после имплантации в связи с отсутствием ICM. Роль Oct4 в поддержании плюрипотентности HESC соответствует с его ролью в MESC.
Целевыми генами Oct4 деятельности и регуляторы его работы не полностью определены, но эта информация близка к разгадке, особенно в отношении MESCs. На основе различных доказательств, были предложены различные гены-мишени. Идентифицированные гены включают Fgf4, транскрипционный ко-фактор UTF-1, белок цинковых пальцев Rex-, тромбоцитарный фактор роста рецепторов, остеопонтин (OPN), Fbxl5, и другие. Сообщалось также что Oct4 способен подавить несколько генов, экспрессираванных в трофобласте, такие как хорионический гонадотропин человека А в клетках хориокарциномы человека. То, каким образом активация Oct4 генов-мишеней устанавливает и поддерживает плюрипотентность до сих пор неизвестно, отчасти потому, что не все цели известны или изучены, и отчасти потому, что гены-мишени, которые были изучены до сих пор, не допускают создание в ICM.
Комбинируя Oct4 с различными ко-факторами, он может действовать и как активатор транскрипции и, как ее репрессор. Oct4 имеет несколько известных ко-факторов, в том числе аденовирус El А, Sry-связанных фактор Sox-2, Foxd3 и HMG-1. Ко-факторы Oct4 экспрессируются в различных паттернах экспрессии в плюрипотентных клетках (табл. 3.2)
Sox2
Sox2 является членом Сокс (SRY связанных коробка ГМГ) семейство генов, который кодирует факторы транскрипции с одного ГМГ ДНК - связывающего домена. Как Oct- 4, это выражается в плюрипотентных линий раннего эмбриона мыши, в ICM, эпибласта и половых клетках. Но в отличие от Oct4, он также выразил в мультипотентных клеток внеэмбриональной эктодермы и также было показано, чтобы отметить нервные клетки-предшественники из центральной нервной системы и иметь важное значение для поддержания своей идентичности. Его подавление коррелирует с обязательством дифференцировать. Sox2 -нулевые мышиные эмбрионы кажутся нормальными на стадии бластоцисты, но не в состоянии выжить вскоре после имплантации. Эти эмбрионы не хватает яиц структуры цилиндров и не имеют эпителиальные клетки, характерные для эпибласте. При культивировании в лабораторных производить клеточных линий ES, Sox2 нулевые бластоцисты прогресс обычно в первые дни, но потом не показывают нормальную дифференциацию в ICM, и единственные клетки наблюдаемые трофэктодермы и теменные энтодермальные клетки. Поэтому, хотя в естественных условиях роль Sox2 проявляется нокаутом только после имплантации, у него есть роль в поддержании плюрипотентных популяцию клеток на ранних эмбриональных стадиях, от которого ES клетки получают, а именно ICM и эпибласта.
Ранних эмбрионов имеют существенные уровни материнской Sox2 белка, который в отличие от большинства материнских генных продуктов сохраняется до имплантации. Даже в Sox2 -нулевых эмбрионов, материнская белок Sox2 сохраняется до стадии бластоцисты. Таким образом, причина того, что мутантные эмбрионы не выживают до имплантации может быть достаточные уровни материнской белка Sox2 до этой стадии. Таким образом, может оказаться, что Sox2 действительно имеет роль в поддержании или создании плюрипотентности на ранних стадиях, но эта роль не может быть обнаружен в простых экспериментов с нокаутом из-за присутствия материнского белка. Кроме того, Sox2 также играет определенную роль в поддержании стволовых клеток трофобласта, и в отсутствие Sox2 эти клетки не могут быть получены.
Таблица 3.2: Основные факторы транскрипции, участвующие в ES себя – обновление
| ген | мутантные мыши | Роль в MESCs | Экспрессия в ЭСК и роли в самообновления |
| Oct4 | Смерть после имплантации из-за отсутствия ICM | Требуется, чтобы предотвратить дифференциацию в трофобласта. Избыточная приводит к дифференциации в внеэмбриональной энтодерму и эктодермы | Выраженный в нескольких клеточных линий ES. Роль в самообновления, как было показано, чтобы быть как InThe MESCs |
| Nanog | Состоял только из неорганизованных экстра-эмбриональных тканей, не эпибласта или внеэмбриональной эктодермы | Требуется, чтобы предотвратить дифференциацию к примитивному энтодерме Избыточная позволяет LIF самостоятельный рост | Выраженный в нескольких клеточных линий ES |
| Sox2 | Неудачная попытка выжить вскоре после имплантации. Разработка нормальную ICM, но позже не хватает яиц структуру цилиндра и не в состоянии поддерживать их эпибласта | MESCs от нулевых эмбрионов не может быть установлена Первоначально их выросты кажется нормальным, но потом производить только трофэктодерме и теменной эндодермы клетки | Выраженный в нескольких клеточных линий ES |
| Foxd3 | Смерть вскоре после имплантации. Размер их эпибласта уменьшается, а первичная полоска отсутствует | MESCs от нулевых эмбрионов не может быть установлена, хотя изначально их выросты кажется нормальным. Есть расширение внеэмбриональной эктодермы | Выраженный только в некоторых клеточных линий ES и поэтому кажется необязательной |
Foxd3
 Foxd3 (первоначально назывался генеза) принадлежит вилки генов глава семьи. Это не выражается в неоплодотворенных яйцеклеток или одноэтапный клеток оплодотворенных эмбрионов, но его транскрипты обнаружены в бластоцисты эмбрионов на стадии. Foxd3-нулевые эмбрионы погибают примерно в то время гаструляции с потерей эпибласте и расширением внеэмбриональной эктодермы и энтодермы. Тем не менее, в бластоцисты стадии их ICM кажется нормальным, с нормальным выражением ICM маркеров (рис. 3.9). При культивировании в лабораторных условиях, Foxd3-нулевые бластоцисты кажутся нормальными на начальном этапе, но позже их ICM не может расширяться. Химерические спасательные эксперименты показали, что Foxd3-нулевые клетки способны дифференцироваться во многие типы клеток. Таким образом, кажется, что Foxd3 может потребоваться для регулирования либо секретируется фактора или молекулы клеточной поверхности сигнализации.
Foxd3 (первоначально назывался генеза) принадлежит вилки генов глава семьи. Это не выражается в неоплодотворенных яйцеклеток или одноэтапный клеток оплодотворенных эмбрионов, но его транскрипты обнаружены в бластоцисты эмбрионов на стадии. Foxd3-нулевые эмбрионы погибают примерно в то время гаструляции с потерей эпибласте и расширением внеэмбриональной эктодермы и энтодермы. Тем не менее, в бластоцисты стадии их ICM кажется нормальным, с нормальным выражением ICM маркеров (рис. 3.9). При культивировании в лабораторных условиях, Foxd3-нулевые бластоцисты кажутся нормальными на начальном этапе, но позже их ICM не может расширяться. Химерические спасательные эксперименты показали, что Foxd3-нулевые клетки способны дифференцироваться во многие типы клеток. Таким образом, кажется, что Foxd3 может потребоваться для регулирования либо секретируется фактора или молекулы клеточной поверхности сигнализации.
Nanog
Дополнительный ген недавно описан как участие в самообновления ЭС клеток является Nanog. Nanog является фактором транскрипции гомеобокс, который не принадлежит ни к одной известной группы генов гомеобоксных. Это выражается в мыши во внутренних клетках уплотненного морулы и бластоцисты, ранние половые клетки, ЭС клеток, зародышевых половых клеток (ЭТУ) и эмбриональных клеток карциномы (ECS), и отсутствует дифференцированных клеток. Nanog был назван в честь мифологической кельтской землевечно молодой, Тир Nanog, так как за выражение Nanog в MESCs оказывает клетки зависит от поставок LIF. Хотя клетки самообновлению и остаются плюрипотентных в отсутствие LIF, их самообновление производительность снижается. Поэтому Nanog избыточная экспрессия не полностью освобождает клетки от LIF зависимости, но когда эти два фактора сочетаются, они работают вместе синергически.
Избыточная экспрессия эффект Nanog не опосредовано через активацию STAT3, и наоборот, и, следовательно, STAT3 и Nanog пути, казалось бы действовать независимо друг от друга. Nanog сверхэкспрессирующие клетки также могут распространяться в сыворотки среде в отсутствие BMP, и кажется, что избыточная экспрессия Nanog поддерживает существенное учредительный уровень экспрессии Id. Тем не менее, Nanog избыточная экспрессия не преодолевает необходимость Oct4 деятельности, и оба Nanog и Oct4 необходимы для МЕСК самообновления. Nanog нарушения в MESCs приводит к дифференциации в внезародышевых энтодермы линий.
Поэтому Nanog имеет важное значение для поддержания плюрипотентности МКД на одной сцене позднее начальной потребности в Oct4. Следовательно, если Oct4 работает ингибировать дифференцировку ЭС клеток трофобласта, Nanog работает, чтобы препятствовать переходу клеток к примитивной энтодермы, которая является следующее решение судьба клеток в эмбрионе. Тем не менее, в отличие от Oct4, основная роль заключается в предотвращении дифференциации (в трофэктодерме), Nanog не только предотвращает дифференциацию (в внеэмбриональной энтодермы), но и активно работает, чтобы поддерживать плюрипотентности. Целевые гены, которые Nanog работает, чтобы включить или подавить до сих пор неизвестны. Тем не менее, последовательность ДНК, что он связывается была определена с помощью SELEX, и гены-мишени были предложены на основании наличия этой последовательности перед их сайта инициации транскрипции.
Один из таких генов является Gata6, и, кажется, что Nanog может подавить свое выражение, так как принудительного выражение Gata6 достаточно для дифференциации в внеэмбриональной энтодермы, FBE же фенотип наблюдается в Nanog-нулевых клеток. Тем не менее, Nanog также содержит два домена, способные активировать транскрипцию (PAN и PEI 2004) и, следовательно, также может позитивно регулируют ES специфические гены, на вершине подавляя внеэмбриональной гены эндодермы. Человека Nanog выражается в ЭСК, ЕС и, например, клеток, зародышевых клеток, а в некоторых опухолей. Когда человеку Nanog закончилось выразил м MESCs, частичное освобождение от LIF зависимости не наблюдалось. Это может означать, что путь Nanog в функциональном гомологии человека и доля мышь, но этот вопрос до сих пор не рассмотрены.
МикроРНК
Микро РНК (микроРНК) дополнительные регуляторы предложили принять участие в поддержании идентичности ES клеток. Эти короткие молекулы ENA, как известно, участвует в регуляции поступательного, главным образом, подавляя перевод и в некоторых случаях, направляя микроРНК к деградации.
Дата добавления: 2020-12-12; просмотров: 130; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
