Сущность окислительно-восстановительных процессов
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
ВОСТОЧНОУКРАИНСКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ
Имени ВЛАДИМИРА ДАЛЯ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
И КОНТРОЛЬНЫЕ ЗАДАНИЯ
К ИЗУЧЕНИЮ ТЕМЫ «ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ»
ЛУГАНСК 2003
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
ВОСТОЧНОУКРАИНСКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ
Имени ВЛАДИМИРА ДАЛЯ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
И КОНТРОЛЬНЫЕ ЗАДАНИЯ
К ИЗУЧЕНИЮ ТЕМЫ
«ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ»
(для студентов всех специальностей)
УТВЕРЖДЕНО
на заседании кафедры химии
протокол №5 от 1.04.03.
ЛУГАНСК 2003
УДК 541.12(07)
Методические указания и контрольные задания к изучению темы «Окислительно-восстановительные реакции» (для студентов всех специальностей), 2-е изд. стереотипное. / Сост.: А.А.Григорьева, Е.К.Кузнецова, Г.Ф.Литовченко. Луганск: ВНУ им. В. Даля, 2003. – 26 с.
Содержит описание сущности окислительно-восстановительных реакций, методику составления уравнений и 29 вариантов контрольного задания по этой теме.
Будут полезны студентам, при их самостоятельной работе, и преподавателям для контроля знаний студентов I-го курса по данному разделу химии.
Составители: А.А.Григорьева, доц.
Е.К.Кузнецова, ст.преп.
|
|
|
Г.Ф.Литовченко, ассист.
Ответственная А.А.Григорьева
за выпуск
Рецензент С.П. Бугрим
Тема «Окислительно-востановительные реакции» относится к важнейшим темам курса общей химии, т.к. многие жизненные (дыхание, гниение, обмен веществ) и технологические процессы (получение металлов, ряда органических и неорганических продуктов, очистка веществ) связаны с ними. Эта тема важна также с точки зрения иллюстрации таких философских законов, как взаимосвязь и взаимообусловленность явлений; единство и борьба противоположностей. В курсе общей химии непосредственно этой теме уделено 2 лекционных часа и 2 часа лабораторного практикума. Кроме того, рассматриваемая тема является фундаментальной для изучения таких разделов, как электрохимия, общие свойства металлов, свойства легких и тяжелых конструкционных металлов.
Изучив эту тему, студент должен уметь отличить окислительно-восстановительные реакции от других типов реакций. Пользуясь периодической системой Д. И. Менделеева, он должен правильно оценить степень окисления элементов, определить окислитель и восстановитель, понять суть процесса окисления-восстановления. Необходимо знать 2 метода составления окислительно-восстановительных реакций: метод электронного баланса, основанный на операциях со степенями окисления элементов, и метод полуреакций (ионно-электронный метод). С помощью этих методов он должен уметь расставить коэффициенты в любом окислительно-восстановительном уравнении реакции.
|
|
|
Следует запомнить, что практически осуществляются только те окислительно-восстановительные реакции, ЭДС которых больше нуля. Пользуясь стандартными окислительно-восстановительными потенциалами, приведёнными в таблицах, он должен уметь вычислить ЭДС реакции и оценить возможность и направление её протекания.
С учётом этих требований были составлены 28 билетов контрольной работы по данной теме. В каждом билете содержится 5 стандартизированных вопросов. В первом требуется с помощью метода электронного баланса расставить коэффициенты в приведённом уравнении реакции. Во втором вопросе проверяется умение студента найти окислитель (восстановитель) и составить уравнение электронно-ионным методом. В третьем – перед студентом ставится задача вычисления стандартной ЭДС реакции взаимодействия металла с кислотой и составления полного уравнения этой реакции. В четвёртом проверяется умение студента выбрать наиболее сильный окислитель (восстановитель) на основании величин стандартных окислительно-восстановительных потенциалов.
|
|
|
В ответе на пятый вопрос студенту необходимо на основании периодической системы Д. И. Менделеева и значений стандартных электродных потенциалов определить, какими свойствами (окислителя или восстановителя обладает данный химический элемент или ион. Кафедра рекомендует использовать подготовленные билеты для контроля знаний студентов по теме «Окислительно-восстановительные реакции».
Сущность окислительно-восстановительных процессов
Окислительно-восстановительные процессы играют огромную роль в жизни и технике. Это горение, гниение, дыхание, некоторые реакции обмена веществ и усвоения пищи; это и ряд технологических процессов: восстановление металлов из руд, электролиз растворов и расплавов, коррозионные явления; реакции, лежащие в основе работы химических источников тока и т. д.
Химические процессы, при которых атомы или ионы, участвующие в реакции изменяют свои степени окисления, называются реакциями окисления-восстановления. Они сопровождаются переходом электронов от одних атомов или ионов к другим и являются электронно-динамическими.
|
|
|
Окисление – это отдача электронов веществом, т. е. повышение степени окисления элемента:

Вещества, отдающие электроны в процессе реакции, называются восстановителями. Например: металлы,  ,
,  ,
,  ,
, 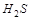 ,
, 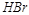 ,
,  и т. д.
и т. д.
Восстановление – это присоединение электронов к веществу, т.е. понижение степени окисления элементов:

Вещества, присоединяющие электроны, называются окислителями. Например, 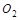 , галогены,
, галогены,  ,
, 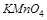 ,
,  ,
, 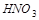 ,
,  и др.
и др.
Атомы в промежуточной степени окисления обладают двойственными свойствами:
 или
или 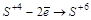 ;
;
 или
или  .
.
Они могут быть и окислителями, и восстановителями. Такими веществами являются  ,
,  ,
,  ,
,  и др.
и др.
Элементы в высших степенях окисления могут только присоединять электроны и являются окислителями. Так,  ,
, 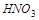 ,
,  ,
,  ,
, 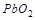 проявляют только окислительные свойства, т. к. содержат в своём составе элементы в высших степенях окисления.
проявляют только окислительные свойства, т. к. содержат в своём составе элементы в высших степенях окисления.
Элементы в низших степенях окисления могут только отдавать электроны и проявлять только восстановительные свойства. Соединения  ,
,  ,
,  ,
,  ,
, 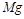 и другие металлы,
и другие металлы, 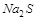 могут быть только восстановителями.
могут быть только восстановителями.
Мерой восстановительных свойств элементов является потенциал ионизации (I). Чем он меньше, тем сильнее восстановитель. Потенциалы ионизации увеличиваются слева направо в каждом периоде периодической системы элементов Д. И. Менделеева, и уменьшаются в группах сверху вниз. Поэтому вдоль по периоду восстановительные свойства уменьшаются, а в группах сверху вниз они растут.
Окислительно-восстановительные свойства проявляются только в химических реакциях. Поэтому число электронов, отдаваемых восстановителем, всегда равно числу электронов, присоединяемых окислителем. На примере этих реакций иллюстрируется один из важнейших законов диалектики – закон единства и борьбы противоположностей. В едином процессе связаны окислитель и восстановитель, вещества, обладающие разной способностью удерживать электроны. В результате реакции образуются вещества, имеющие более слабые окислительные и восстановительные свойства.
Часто окислительные и восстановительные свойства проявляются в определённой среде: кислой, нейтральной или щёлочной. В таких случаях подбор коэффициентов проводят одним из двух методов: методом электронного баланса или ионно-электронным методом.
Метод 1. Метод электронного баланса.
1.Необходимо написать уравнение реакции и определить элементы, изменившие степени окисления.

окислитель восстановитель
2.Необходимо составить вспомогательную электронную схему для нахождения коэффициентов:

|

|

Множители 2 и 5 уравнивают число потерянных и принятых электронов (по наименьшему общему кратному).
3. Далее надо перенести коэффициенты в уравнение реакции:
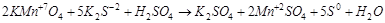
4. Теперь можно подобрать коэффициенты к другим молекулам, участвующим в реакции (сначала к катионам, а затем к анионам).

Признаком правильности расстановки коэффициентов является равенство числа атомов каждого элемента в обеих частях уравнения.
Метод 2. Ионно-электронный метод (метод полуреакций)
1. Составляем ионно-молекулярную схему реакции, выписав ионы и молекулы, изменяющиеся в процессе реакции:
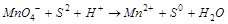
2. Составляем уравнения процессов окисления и восстановления, учитывая, что в водном растворе могут участвовать в реакции  ,
,  ,
,  . В данной реакции для связывания четырёх атомов кислорода, входящих в состав
. В данной реакции для связывания четырёх атомов кислорода, входящих в состав  , необходимы
, необходимы  , и тогда образуется четыре молекулы
, и тогда образуется четыре молекулы  . Сложный ион
. Сложный ион  переходит в
переходит в  , присоединяя
, присоединяя  :
:
|

|

3. Суммируем оба уравнения, учитывая подобранные коэффициенты:


4. Для перехода к молекулярному уравнению нужно добавить недостающие ионы.


Для реакций в растворах стремление к переходу электронов от одних атомов и ионов к другим характеризуется их стандартными окислительно-восстановительными потенциалами ( 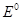 ). Чем больше значение
). Чем больше значение 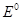 атома или иона, тем сильнее его окислительные свойства (т.е. стремление к приёму электронов) и, наоборот, чем меньше значение
атома или иона, тем сильнее его окислительные свойства (т.е. стремление к приёму электронов) и, наоборот, чем меньше значение 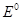 атома или иона, тем сильнее восстановительные свойства (стремление к отдаче электронов). Например, для процессов:
атома или иона, тем сильнее восстановительные свойства (стремление к отдаче электронов). Например, для процессов:


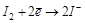

 является более сильным окислителем, т. к. ему соответствует больший стандартный окислительно-восстановительный потенциал.
является более сильным окислителем, т. к. ему соответствует больший стандартный окислительно-восстановительный потенциал.
В другой паре реакций:
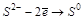



лучший восстановитель 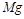 , т. к. у него меньший потенциал (
, т. к. у него меньший потенциал (  ).
).
Потенциал окислителя всегда больше потенциала восстановителя (  >
>  ).
).
Зная значения стандартных окислительно-восстановительных потенциалов (  ), можно предвидеть, в каком направлении пойдёт окислительно-восстановительный процесс. Реакция протекает в выбранном направлении, если разность потенциалов окислителя и восстановителя имеет положительное значение:
), можно предвидеть, в каком направлении пойдёт окислительно-восстановительный процесс. Реакция протекает в выбранном направлении, если разность потенциалов окислителя и восстановителя имеет положительное значение:
 ,
,  , реакция идёт;
, реакция идёт;
причём, если ЭДС находится в пределах 0-0.2В, она протекает медленно, если ЭДС > 0.2В, реакция идёт с заметной скоростью. Поэтому для определения возможности протекания окислительно-восстановительного процесса необходимо рассчитать ЭДС:


ЭДС=1.51-(-0.48)=1.99 В, значит, реакция идёт очень быстро.
Если реакция протекает не в стандартных условиях (Т=298°К, концентрации веществ не равны 1моль/л), Электродные потенциалы вычисляются по уравнению Нернста:
 ,
,
в котором 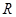 – универсальная газовая постоянная,
– универсальная газовая постоянная,
равная 8,314 Дж моль-1·К-1;
 – число Фарадея, равное 96500 Кл;
– число Фарадея, равное 96500 Кл;
 – концентрация;
– концентрация;
 –число участвующих электронов.
–число участвующих электронов.
Для полуреакции при Т=298ºК
 .
.
Вариант 1
1. Методом электронного баланса расставить коэффициенты в уравнении реакции, указать окислитель:
 .
.
2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:
 .
.
3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Может ли перманганат калия 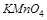 окислить сульфид калия
окислить сульфид калия  в кислой среде? Ответ подтвердите расчетом ЭДС.
в кислой среде? Ответ подтвердите расчетом ЭДС.
5. Может ли ион 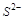 проявлять свойства окислителя? Объясните почему?
проявлять свойства окислителя? Объясните почему?
Вариант 2
1. Методом электронного баланса расставить коэффициенты в уравнении реакции, указать восстановитель:
 .
.
2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать окислитель:
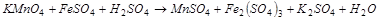 3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:
3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Может ли ион хлора  восстановить
восстановить  до
до  в кислой среде? Ответ подтвердите расчётом ЭДС (см. табл).
в кислой среде? Ответ подтвердите расчётом ЭДС (см. табл).
5. Может ли  проявлять свойства восстановителя? Почему?
проявлять свойства восстановителя? Почему?
Вариант 3
1. Методом электронного баланса расставить коэффициенты в уравнении реакции, указать окислитель:

2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:
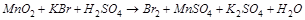
3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Может ли перманганат калия  в кислой среде окислить
в кислой среде окислить  до
до  ? Ответ подтвердите расчётом ЭДС(см. табл).
? Ответ подтвердите расчётом ЭДС(см. табл).
5. Какой из ионов  или
или  проявляет большие окислительные свойства? Почему?
проявляет большие окислительные свойства? Почему?
Вариант 4
1. Методом электронного баланса расставить коэффициенты в уравнении реакции, указать восстановитель:
 .
.
2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать окислитель:
 .
.
3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4.Какой из окислителей 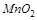 ,
, 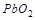 или
или  в кислой среде будет лучше окислять
в кислой среде будет лучше окислять  до
до 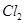 ? Ответ подтвердите расчётом ЭДС.
? Ответ подтвердите расчётом ЭДС.
5. Какие свойства: окислителя или восстановителя может проявлять 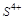 ? Почему?
? Почему?
Вариант 5
1. Методом электронного баланса расставить коэффициенты в уравнении реакции, указать окислитель:
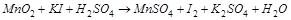 .
.
2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:
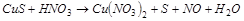 .
.
3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Можно ли использовать  в качестве окислителя в следующем процессе при стандартных условиях:
в качестве окислителя в следующем процессе при стандартных условиях:
 ;
;  .
.
Ответ подтвердите расчётом ЭДС (см. табл).
5. Какими свойствами (окислителя или восстановителя) обладает 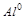 ? Почему?
? Почему?
Вариант 6
1. Методом электронного баланса расставить коэффициенты в уравнении реакции, указать восстановитель:
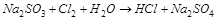 .
.
2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать окислитель:
 .
.
3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Можно ли использовать  в качестве окислителя в следующем процессе:
в качестве окислителя в следующем процессе:
 ?
?
Ответ подтвердите расчётом ЭДС.
5. Какими свойствами (окислительными или восстановительными) обладает  ? Почему?
? Почему?
Вариант 7
1. Методом электронного баланса расставить коэффициенты в уравнении реакции, указать окислитель:
 .
.
2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:
 .
.
3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Можно ли использовать  в качестве окислителя при реакции с
в качестве окислителя при реакции с  в кислой среде? Ответ подтвердите расчётом ЭДС.
в кислой среде? Ответ подтвердите расчётом ЭДС.
5. Какими свойствами (окислителя или восстановителя) обладает  ? Ответ объясните.
? Ответ объясните.
Вариант 8
1. Методом электронного баланса расставить коэффициенты в уравнении реакции, указать восстановитель:
 .
.
2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать окислитель:
 .
.
3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Какой из окислителей  ,
, 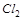 или
или  будет лучше окислять
будет лучше окислять  до
до 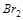 в кислой среде? Ответ подтвердите расчётом ЭДС.
в кислой среде? Ответ подтвердите расчётом ЭДС.
5. Какими свойствами (окислителя или восстановителя) обладает  ? Ответ объясните.
? Ответ объясните.
Вариант 9
1. Методом электронного баланса расставить коэффициенты в уравнении реакции, указать окислитель:
 .
.
2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:
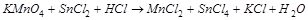 .
.
3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Можно ли в водном растворе восстановить ион  до иона
до иона  а) бромидом калия; б) йодидом калия?
а) бромидом калия; б) йодидом калия?
5. Какой из элементов 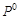 или
или  обладает большими окислительными свойствами? Почему?
обладает большими окислительными свойствами? Почему?
Вариант 10.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать окислитель:

2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. В каком направлении будет протекать реакция:

Ответ подтвердите расчётом ЭДС.
5. Какой из ионов  ,
,  или
или  будет лучшим восстановителем? Почему?
будет лучшим восстановителем? Почему?
Вариант 11.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать окислитель:
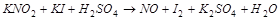
2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Может ли  окислить сульфид натрия
окислить сульфид натрия 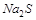 до
до  в сернокислой среде? Ответ подтвердите расчётом ЭДС.
в сернокислой среде? Ответ подтвердите расчётом ЭДС.
5. Может ли ион  проявлять окислительные свойства? Почему?
проявлять окислительные свойства? Почему?
Вариант 12.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать восстановитель:

2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать окислитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Может ли  восстановить
восстановить  до
до  ? Ответ подтвердите расчётом ЭДС.
? Ответ подтвердите расчётом ЭДС.
5. Может ли  проявлять свойства окислителя? Почему?
проявлять свойства окислителя? Почему?
Вариант 13.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать окислитель:

2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Может ли  в кислой среде окислить
в кислой среде окислить 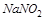 ? Ответ подтвердите расчётом ЭДС.
? Ответ подтвердите расчётом ЭДС.
5. Какая из частиц 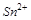 или
или  проявляет большие окислительные свойства? Почему?
проявляет большие окислительные свойства? Почему?
Вариант 14.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать окислитель:
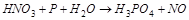
2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Какой из окислителей: 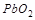 или
или  будет лучше окислять
будет лучше окислять  до
до  в кислой среде? Ответ подтвердите расчётом.
в кислой среде? Ответ подтвердите расчётом.
5. Какие свойства (окислителя или восстановителя) может проявлять 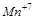 ? Почему?
? Почему?
Вариант 15.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать восстановитель:

2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать окислитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:
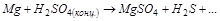
4. Можно ли использовать  в качестве окислителя в следующем процессе при стандартных условиях?
в качестве окислителя в следующем процессе при стандартных условиях?

Ответ подтвердите расчётом ЭДС.
5. Какими свойствами (окислителя или восстановителя) обладает  ? Почему?
? Почему?
Вариант 16.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать восстановитель:

2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать окислитель:
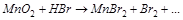
3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Можно ли использовать  в качестве окислителя в следующем процессе:
в качестве окислителя в следующем процессе:
 ;
;  ?
?
5. Какими свойствами (окислителя или восстановителя) обладает  ? Почему?
? Почему?
Вариант 17.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать окислитель:

2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Можно ли использовать  при реакции с
при реакции с 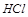 , чтобы получит
, чтобы получит  ?
?
5.Какими свойствами (окислителя или восстановителя) обладает 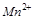 ? Почему?
? Почему?
Вариант 18.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать восстановитель:

2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать окислитель:
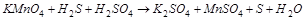
3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:
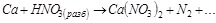
4. Какой из окислителей  или
или  будет лучше окислять
будет лучше окислять  до
до  в кислой среде? Ответ подтвердите расчётом ЭДС.
в кислой среде? Ответ подтвердите расчётом ЭДС.
5. Какими свойствами: окислителя или восстановителя обладает  ? Ответ объясните.
? Ответ объясните.
Вариант 19.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать окислитель:

2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать окислитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Можно ли в водном растворе восстановить соль железа (III) до соли железа (II): а) бромидом калия KBr; б) иодидом калия KI? Ответ подтвердите расчётом ЭДС.
5.Какой из элементов 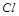 или
или 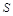 обладает большими окислительными свойствами? Почему?
обладает большими окислительными свойствами? Почему?
Вариант 20.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать окислитель:

2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:
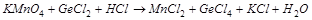
3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. В каком направлении будет протекать реакция:
 ?
?
5. Какой из ионов  ,
, 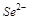 или
или  будет лучшим восстановителем? Объясните с точки зрения строения атома.
будет лучшим восстановителем? Объясните с точки зрения строения атома.
Вариант 21.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать окислитель:

2. С помощью ионно-электронного метода закончить уравнение реакции, расставить в нём коэффициенты и указать окислитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:
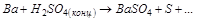
4. В каком направлении будет протекать реакция? Ответ подтвердите расчётом.

5. В какой роли (окислителя или восстановителя) может выступать ион  ? Ответ объясните.
? Ответ объясните.
Вариант 22.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать восстановитель:

2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Можно ли с помощью дихлорида олова  восстановить
восстановить  до
до  в кислой среде? Ответ подтвердите расчётом.
в кислой среде? Ответ подтвердите расчётом.
5. Объясните, какой из ионов 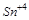 или
или  будет обладать только окислительными свойствами?
будет обладать только окислительными свойствами?
Вариант 23.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать восстановитель:

2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать окислитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. С помощью расчёта определить, будет ли протекать реакция взаимодействия?

5. Объясните какой из ионов может быть только окислителем 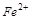 ,
,  ,
,  ,
,  ? Почему?
? Почему?
Вариант 24.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать окислитель:

2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:
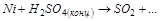
4. Какой из восстановителей:  или
или  будет легче восстанавливать
будет легче восстанавливать  до
до 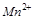 в кислой среде? Ответ подтвердите расчётом.
в кислой среде? Ответ подтвердите расчётом.
5. Какая из частиц:  ,
,  или
или  может быть окислителем? Почему?
может быть окислителем? Почему?
Вариант 25.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать восстановитель:

2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать окислитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:
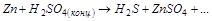
4. С помощью расчёта определить, возможна ли реакция:
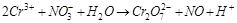
5. Объясните, какая из частиц 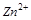 ,
, 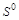 или
или  может выступать только в качестве восстановителя? Почему?
может выступать только в качестве восстановителя? Почему?
Вариант 26.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать окислитель:
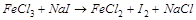
Указать коэффициент перед молекулой  .
.
2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Может ли  окислить
окислить  в кислой среде? Ответ подтвердите расчётом.
в кислой среде? Ответ подтвердите расчётом.
5. Закончить составление полуреакции и указать ёё потенциал:

Вариант 27.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать восстановитель:

2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать окислитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Может ли  восстановить
восстановить  до
до  ? Ответ подтвердите расчётом.
? Ответ подтвердите расчётом.
5. Объясните, какой из соединений азота может быть только окислителем:  ,
, 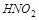 ,
,  .
.
Вариант 28.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать окислитель:
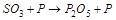
2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:

3. Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты:

4. Возможна ли реакция между дихроматом и 1М раствором соляной кислоты:
 ?
?
5. Объясните в какой роли (окислителя или восстановителя) могут выступать частицы  ,
, 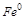 ,
,  и
и 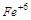 ?
?
Вариант 29.
1. Методом электронного баланса расставить коэффициента в уравнении реакции, указать окислитель:
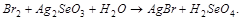
2. С помощью ионно-электронного метода расставить коэффициенты в уравнении реакции и указать восстановитель:
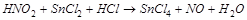
3. Составьте уравнение взаимодействия кальция с концентрированной серной кислотой, учитывая максимальное восстановление последней. Вычислите ЭДС реакции.
4. С помощью расчёта определите, возможна ли реакция в стандартных условиях:
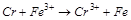 .
.
5. Объясните, какое из перечисленных соединений серы может быть только восстановителем: 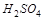 ,
,  ,
, 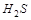 ?
?
Таблица
Дата добавления: 2020-11-29; просмотров: 147; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
