Практически любые функции состояния и переменные можно выразить через саму характеристическую функцию или через ее частные производные по естественным для функции переменным.







Для термомеханической системы имеются 4 связанные между собой функции U, H, F, G, которые являются характеристическими, только будучи функциями соответствующих независимых переменных – потенциалов (T и p) и координат состояния (S и V).
В системе, в которой могут протекать химические или фазовые превращения, каждая характеристическая функция является функцией не только двух термомеханических параметров, но и параметров, выражающих состав состояния такой системы
7.





Парциальные молярные свойства
Любое экстенсивное свойство Z (V, U, H, G, S, Cp) может быть представлено как Z=f (p, T, n1, n2,… ), следовательно:
 |
Частная производная
называется парциальным молярным свойством системы в отношении составляющей i
 |
При p, T = const:
Природа экстенсивного свойства такова, что при увеличении всей массы сложной системы в n раз, значение свойства возрастает в той же степени при условии, что давление, температура и состав остаются неизменными (однородная функция первого порядка)
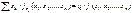 Теорема Эйлера – всякая однородная функция с порядком q может быть представлена в виде:
Теорема Эйлера – всякая однородная функция с порядком q может быть представлена в виде:
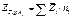 |
следовательно при постоянстве состава, температуры и давления любое экстенсивное свойство может быть выражено как:
Так как:
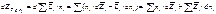 | |||
 | |||
при постоянных температуре и давлении для системы определенного состава справедливо уравнение
|
|
|
 Парциальное молярное свойство чистого вещества представляет собой свойство, отнесенное к единице количества вещества, т.е. удельное свойство
Парциальное молярное свойство чистого вещества представляет собой свойство, отнесенное к единице количества вещества, т.е. удельное свойство
 |
Физический смысл парциального молярного свойства: оно физически выражает изменение соответствующего экстенсивного свойства в результате добавления при постоянных температуре и давлении 1 моль вещества к столь большому количеству, что состав системы фактически остается неизменным
Химический потенциал – это парциальная молярная энергия Гиббса

 Уравнение Гиббса-Дюгема. При p,T=const:
Уравнение Гиббса-Дюгема. При p,T=const:
где xi – мольнодолевая концентрация i-го компонента
8. Уравнения Гиббса-Гельмгольца
Уравнения Гиббса-Гельмгольца позволяют установить связь между максимальной работой равновесного процесса и теплотой того же процесса, протекающего неравновесно.
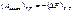 | |||
 |

Так как QV=ΔU и Qp=ΔH, получим:


Эти уравнения позволяют вычислять работы немеханических сил по экспериментальным данным: теплоте или тепловому эффекту реакции (при постоянном давлении или объеме) и температурному коэффициенту работы
Например, для электрохимических процессов:
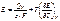
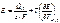
где Ε – электродвижущая сила
|
|
|
Интегрирование уравнений Гиббса-Гельмгольца
Интегрирование уравнений Гиббса-Гельмгольца используется в экспериментальных целях, в частности для термодинамического анализа (определение константы равновесия):
 | |||||
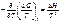 |  | ||||
где I – постоянная интегрирования (постоянную интегрирования можно определить, если известна величина ΔG при какой-либо одной температуре Т)
9. Химическое равновесие
Химическая реакция в зависимости от условий может протекать самопроизвольно в прямом и обратном направлении, такая реакция считается обратимой с точки зрения термодинамики
Химическое равновесие - состояние химической системы, которое характеризуется неизменностью состава и где обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре «прямая - обратная реакция» равны между собой
Химическое равновесие является динамическим и подвижным, изменение внешних условий смещает это равновесие в ту или другую сторону
В изолированной системе о направленности самопроизвольного процесса судят по изменению энтропии в системе, а в закрытой – по величине полезной работы (работы немеханических сил)
|
|
|
Максимальная полезная работа химической реакции – это немеханическая работа, которую силы, заставляющие вещества взаимодействовать, способны произвести, в условиях равновесного процесса
На самом деле большинство химических реакций протекают неравновесно, и работа не производится
Максимальная полезная работа равна:
 | |||
 | |||
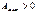 Условие самопроизвольного процесса в замкнутой (закрытой) системе:
Условие самопроизвольного процесса в замкнутой (закрытой) системе:
Следовательно, при самопроизвольном протекании физико-химического процесса в закрытой системе характеристические функции ΔU, ΔH, ΔF, ΔG должны уменьшаться, а в состоянии равновесия будут равны нулю (при постоянстве соответствующих параметров).
Так как большинство процессов протекает при постоянных температуре и давлении, то критерием протекания самопроизвольного процесса будет:
(ΔG)p,T<0
а равновесия: (ΔG)p,T=0
Для практического осуществления химической реакции необходимо располагать данными не только о ΔG (T), но и о скорости ее протекания. Если скорость химической реакции является очень малой, то термодинамическая возможность (ΔG <0) не реализуется
 На основе термодинамических и кинетических данных определяется устойчивость индивидуальных веществ: если ΔGfT<0, то оно будет термодинамически устойчиво, если ΔGfT>0, то оно – неустойчиво. Если скорость распада неустойчивого соединения мала, то говорят, что индивидуальное вещество является кинетически устойчивым
На основе термодинамических и кинетических данных определяется устойчивость индивидуальных веществ: если ΔGfT<0, то оно будет термодинамически устойчиво, если ΔGfT>0, то оно – неустойчиво. Если скорость распада неустойчивого соединения мала, то говорят, что индивидуальное вещество является кинетически устойчивым
|
|
|
В химической реакции
 изменения числа молей dnі, участвующих в реакции веществ пропорциональны стехиометрическим коэффициентам уравнения реакции, взятым со знаком минус для исчезающих веществ и со знаком плюс – для образующихся:
изменения числа молей dnі, участвующих в реакции веществ пропорциональны стехиометрическим коэффициентам уравнения реакции, взятым со знаком минус для исчезающих веществ и со знаком плюс – для образующихся:
Для всех участников реакции отношения dnі/νі одинаковы и могут быть представлены в форме дифференциала некоторой величины ξ (кси), которую называют химической переменной (степенью протекания реакции, числом пробегов реакции)
Изменение энергии Гиббса является функцией переменных T, p и ξ :
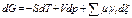 |
При p, T = const справедливо
 |
Если реакция протекает самопроизвольно, то dG < 0 и, следовательно, ∑μіνі < 0.

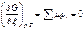 В состоянии равновесия:
В состоянии равновесия:
Закон действующих масс
Если реакция протекает в газовой фазе, то химические потенциалы реагирующих веществ можно выразить через их парциальные давления (для идеальных газов):
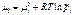 |
 Тогда в состоянии равновесия справедливо:
Тогда в состоянии равновесия справедливо:
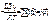 |
Откуда получаем:
т.е. Sn і∙lnpі зависит только от температуры
 Заменив сумму логарифмов логарифмом произведения парциальных давлений, а f(T) – логарифмом некоторой функции Kр0(T), стандартной константы равновесия, получим:
Заменив сумму логарифмов логарифмом произведения парциальных давлений, а f(T) – логарифмом некоторой функции Kр0(T), стандартной константы равновесия, получим:
или закон действующих масс:
 |
Величина Kр0 (K0), выраженная через парциальные равновесные давления компонентов, зависит только от температуры и не зависит от суммарного давления и парциальных давлений компонентов в исходной смеси; при постоянной температуре K0 = const
Константу равновесия можно также выражать через мольные доли (мольнодолевые концентрации) хі или молярные концентрации Сі (моль/л) реагирующих веществ, исходя из связи между этими величинами и парциальными давлениями (p0 – общее давление,
V – общий объем системы):
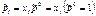 |
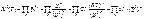 Подставляя эти значения в уравнение закона действующих масс, получим:
Подставляя эти значения в уравнение закона действующих масс, получим:
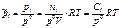 |
Только константа равновесия K0 (и Kx в случае p0=1) не имеет размерности и может быть вычислена через ΔGT (по уравнениям изотермы и нормального сродства)
Величины Kp и KC имеют размерность
Связь между константами равновесия, записанными в различных формах (Δν=ν3+ ν4- ν1- ν2)

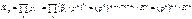
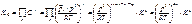
 | |||
 | |||
1. Δν<0 (ν3+ ν4- ν1- ν2<0). K0 увеличивается с ростом p0. Равновесие смещается в сторону продуктов реакции
2. Δν>0 (ν3+ ν4- ν1- ν2>0). K0 уменьшается с ростом p0. Равновесие смещается в сторону исходных веществ
3. Δν=0. На состав равновесной смеси изменение давления не влияет


10. Уравнение изотермы
В случае, если p,T=const и ξ=1, а относительные парциальные давления в реакционной смеси равны pi’ (неравновесная система) справедливо:
 | |||
 | |||
Уравнение изотермы:
Физический смысл величина (ΔG)p,T - это максимальная полезная работа химической реакции (ΔG = -Анемех), которая при p,T=const не зависит от способа проведения процесса (был ли он равновесен или нет)
 При , (ΔG)p,T <0, реакция
При , (ΔG)p,T <0, реакция
самопроизвольно протекает в сторону продуктов
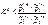 |
При , (ΔG)p,T >0, реакция
самопроизвольно протекает в сторону исходных веществ
В состоянии равновесия: (ΔG)p,T =0
Уравнение изобары (изохоры)
Следствие из уравнений Гиббса-Гельмгольца:
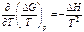 |

Уравнение нормального сродства: 
 |
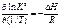 Комбинируя получаем уравнение изобары:
Комбинируя получаем уравнение изобары:
Аналогично можно получить уравнение изохоры:
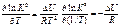 |
ΔH>0 (эндотермическая реакция, поглощение тепла): увеличение температуры (уменьшение 1/T) приводит к увеличению константы равновесия, равновесие смещается в сторону продуктов реакции
ΔH<0 (экзотермическая реакция, выделение тепла): увеличение температуры (уменьшение 1/T) приводит к уменьшению константы равновесия, равновесие смещается в сторону исходных веществ
Принцип Ле-Шателье-Брауна: если на систему, находящуюся в состоянии равновесия оказать какое-либо воздействие, то равновесие в системе сместится в том направлении, что оказанное воздействие уменьшится
11. Термодинамические свойства идеальных растворов
 Идеальным считается такой раствор, в котором для каждого компонента при всех значениях давления (p), температуры (T) и мольной доли (xi) справедливо выражение зависимости химического потенциала компонента в этом растворе следующего вида:
Идеальным считается такой раствор, в котором для каждого компонента при всех значениях давления (p), температуры (T) и мольной доли (xi) справедливо выражение зависимости химического потенциала компонента в этом растворе следующего вида:
 Выражая химические потенциалы как парциальные молярные энергии Гиббса, получим:
Выражая химические потенциалы как парциальные молярные энергии Гиббса, получим:
Для идеального раствора:
 | ||
 | ||
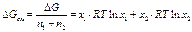 | ||
ΔGсм – энергия Гиббса смешения (ΔGсм=Δμ)
Так как х1 и х2 < 1, то ΔGсм=Δμ<0. Самопроизвольный процесс образования идеального раствора сопровождается убылью энергии Гиббса (химического потенциала)
Преобразуя, получим:
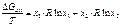 |
 Так в правой части уравнения стоят величины, не зависящие от температуры, поэтому
Так в правой части уравнения стоят величины, не зависящие от температуры, поэтому
В соответствии с уравнением Гиббса-Гельмгольца:
 |
Энтальпия образования 1 моль идеального раствора из компонентов равна нулю (ΔHсм=0)

 В идеальном растворе парциальная молярная энтальпия компонента равна молярной энтальпии чистого компонента
В идеальном растворе парциальная молярная энтальпия компонента равна молярной энтальпии чистого компонента
Так как ΔHсм=0, а
получим, что ΔСp, см=0

 Поскольку энергия Гиббса смешения (x1RTlnx1+ x2RTlnx2) не зависит от давления, справедливо:
Поскольку энергия Гиббса смешения (x1RTlnx1+ x2RTlnx2) не зависит от давления, справедливо:
Образование идеального раствора происходит без изменения объема (ΔVсм=0)
Образование идеального раствора происходит без изменения внутренней энергии:
ΔUсм= ΔHсм-p∙ ΔVсм
 Объем раствора, состоящего из n1 моль растворителя и n2 моль растворенного вещества, может быть выражен через парциальные мольные объемы:
Объем раствора, состоящего из n1 моль растворителя и n2 моль растворенного вещества, может быть выражен через парциальные мольные объемы:
 Объем исходной системы:
Объем исходной системы:
где V10, V20 – молярные объемы

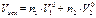 Для 1 моль раствора:
Для 1 моль раствора:
Изменение объема при образовании 1 моль раствора:
 | |||
 | |||
Парциальный молярный объем компонента в идеальном растворе равен молярному объему чистого компонента:
 Изменение энтропии при образовании раствора из n1 моль растворителя и n2 моль растворенного вещества равно:
Изменение энтропии при образовании раствора из n1 моль растворителя и n2 моль растворенного вещества равно:
Образование идеального раствора сопровождается возрастанием энтропии (ΔS>0, т.к. 0<x1<1, 0<x2<1)
Термодинамические характеристики образования идеального раствора показывают, что в этом процессе энергия Гиббса уменьшается, энтропия возрастает, а энтальпия, теплоемкость, внутренняя энергия и объем не меняются. Только при одновременном выполнении всех этих условий раствор является идеальным
Несмотря на практически полное отсутствие в природе идеальных растворов, на основе физико-химических представлений о них, оказалось возможным дать простую теоретическую модель образования
растворов
Используя данную модель, можно интерпретировать свойства реальных систем
Закон Рауля
Дата добавления: 2020-11-23; просмотров: 62; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
