Раздел №3. Взаимодействие материи ( 10 баллов)
8. Рассчитайте осмотическое давление раствора, содержащего 3.6 г/л глюкозы. Сделайте то же самое для 0.1М раствора сахарозы. Теперь предположим, что мы взяли стеклянный контейнер и поставили мембранную перегородку, способную пропускать только воду, прямо посередине. Затем мы одновременно налили предыдущие растворы глюкозы и сахарозы в разные отсеки контейнера. Что будет происходить в данном случае? Рассчитайте конечные концентрации двух растворов. (Все расчеты проводить для комнатной температуры).
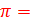 cRT
cRT
Глюкоза – G, сахароза – S.
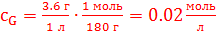 (0.5 баллов);
(0.5 баллов); 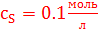
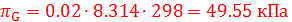 (1 балл);
(1 балл);
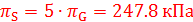 (0.5 баллов)
(0.5 баллов)
В контейнере вода из раствора глюкозы будет переходить в раствор сахарозы пока осмотическое давление в обоих растворах не будет равным. (0.5 баллов)
В итоге – 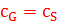
 ;
; 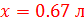 ;
;  (1.5 балла)
(1.5 балла)
9.Уравняйте следующие реакции с помощью окислительно-восстановительного баланса:
а) N2 + H2 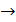 NH3
NH3
b) H2O + Al + NaOH 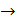 Na3[Al(OH)6] + H2
Na3[Al(OH)6] + H2
c) KMnO4 + HCl + H2SO4 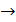 K2SO4 + MnSO4 + Cl2 + H2O
K2SO4 + MnSO4 + Cl2 + H2O
d) KMnO4 + HCl 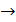 MnCl2 + Cl2 + H2O + KCl
MnCl2 + Cl2 + H2O + KCl
(0.5 баллов за правильное уравнение, 0.5 баллов за ОВР баланс,
Балла в общем)
а) 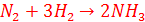


b) 


c) 
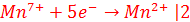
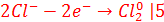
d) 
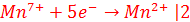
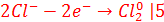
10.Для реакции в пункте (а) обычно используется катализатор в виде мелкодисперсного железа. Рассчитайте во сколько раз реакция в пункте (а) будет быстрее при 600 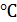 , чем при 500
, чем при 500 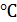 . Энергию активации данной реакции в присутсвии катализатора примите равной 31 ккал/моль. Рассчитайте во сколько раз упадет скорость той же реакции при 500
. Энергию активации данной реакции в присутсвии катализатора примите равной 31 ккал/моль. Рассчитайте во сколько раз упадет скорость той же реакции при 500 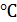 , если убрать катализатор. Энергию активации данной реакции без катализатора примите равной 52 ккал/моль. (1 ккал = 4.18 Дж)
, если убрать катализатор. Энергию активации данной реакции без катализатора примите равной 52 ккал/моль. (1 ккал = 4.18 Дж)
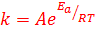
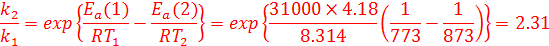
Реакция при большей температуре будет в 2.31 раза быстрее. (1 балл)
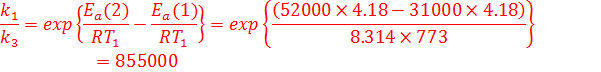
Реакция в отсутствие катализатора будет в 855000 раз медленнее. (1 балл)
Раздел №4. Общие задачи (10 баллов)
11.Рассчитайте тепловой эффект реакции (3 балла)
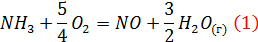
Если известные следующие данные:
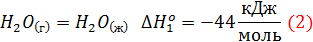
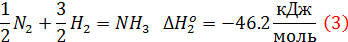
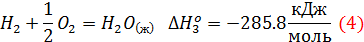
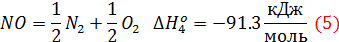
Пронумеруем реакции.
Заметим, что реакция (1) является суммой следующих реакций: (1 балл)
-(3)-(5)+1.5*(4)-1.5*(2)
Таким образом, тепловой эффект первой реакции также является суммой соответствующих значений тепловых эффектов. (1 балл)
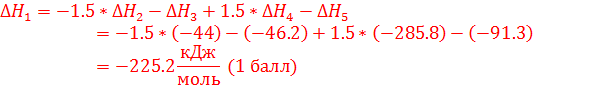
Итого 3 балла.
Одной из самых важных химических характеристик любых водоемов является количество Растворенного Кислорода (РК). Кислород может поступать в водоемы путем диффузии напрямую из атмосферы или вырабатываться местными продуцентами, обитающими на дне водоема. К таким продуцентам чаще всего относится фитопланктон. Уровень РК находится в здоровых для флоры и фауны пределах в нормальных условиях, однако, поступление большого количества удобрений в результате человеческой деятельности приводит к бурному росту растительности, в том числе водорослей. Отмирание и дальнейшее разложение водорослей потребляет большое количество кислорода и тем самым уровень РК понижается, что может приводить к гибели рыб.
Уровень РК в водном образце можно определить с помощью титрования по методике Винклера с добавлением азида натрия. Азид натрия добавляется для «нейтрализации» присутствующих нитрит ионов, которые могут мешать определению кислорода. Методика действий следующая:
К образцу воды с водоема добавляется 2 мл 2.15М раствора сульфата марганца. Затем, добавляется 2 мл щелочного раствора смеси азида и йодида. Колба с образцом закрывается и переворачивается несколько раз после каждого оседания осадка. Затем аккуратно вводятся 2 мл концентрированной серной кислоты, что приводит к растворению осадка. Раствор в дальнейшем титруется стандартизированным раствором тиосульфата натрия. Уравнения реакций представлены ниже:

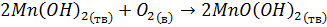

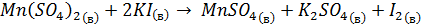
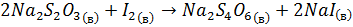
12. Напишите суммарное уравнение реакции в ионной форме (1 балл)
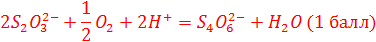
13. Объясните необходимость добавления сульфата марганца с последующим растворением при добавлении серной кислоты (1 балл)
Мы видим, что сульфат марганца реагирует с молекулой кислорода, а после добавления серной кислотый мы получаем сульфат марганца (+4) который далее реагирует с йодидом калия выступая в роли окислителя. При этом, известно, что кислород слабо растворим в воде. Таким образом, необходимость всех процедур обуславливается необходимостью зафиксировать точное количество кислорода в воде, а дабы избежать диффузии кислорода из раствора, его окислительный потенциал переводится к марганцу, который не пропадет из раствора. (1 балл за идею о том, что кислород плохо растворим в воде).
14. На титрование 200 мл водного образца обработанного согласно процедуре выше ушло 6.3 мл 0.02500М раствора 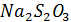 . Определите уровень РК в г/мл (2 балла)
. Определите уровень РК в г/мл (2 балла)
Из предыдущих пунктов известно, что на 1 моль кислорода тратится 4 моль тиосульфата. Таким образом
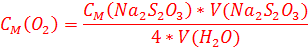
А концентрация в г/мл получается умножением на 32000
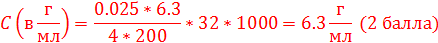
Дата добавления: 2020-04-08; просмотров: 77; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
