Применение альдегидов и кетонов
Формальдегид (метаналь, муравьиный альдегид) H2C=O: а) для получения фенолформальдегидных смол; б) получение мочевино-формальдегидных (карбамидных) смол; в) полиоксиметиленовые полимеры; г) синтез лекарственных средств (уротропин); д) дезинфицирующее средство; е) консервант биологических препаратов (благодаря способности свёртывать белок). Уксусный альдегид (этаналь, ацетальдегид) СН3СН=О: а) производство уксусной кислоты; б) органический синтез. Ацетон СН3-СО-СН3: а) растворитель лаков, красок, ацетатов целлюлозы; б) сырьё для синтеза различных органических веществ.
Карбоновые кислоты
Цель: изучить строение, способы получения, свойства карбоновых кислот и их производных.
План лекции
1. Строение карбоновых кислот
2. Способы получения
3. Химические свойства карбоновых кислот
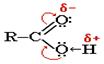
Карбоновыми кислотами называются органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом. По числу карбоксильных групп кислоты подразделяются на: одноосновные (монокарбоновые) СН3СООН (уксусная), многоосновные (дикарбоновые, трикарбоновые и т.д.) НООССН2СООН(малоновая). По характеру углеводородного радикала различают кислоты: предельные (например, CH3CH2CH2COOH); непредельные (CH2=CH-COOH); ароматические (C6H5COOH). Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова кислота: HCOOH - метановая (муравьиная) кислота, CH3COOH – этановая (уксусная) кислота. Для карбоновых кислот характерная структурная изомерия: а) изомерия скелета в углеводородном радикале (начиная с C4); б) межклассовая изомерия, начиная с C2. Возможна цис-транс изомерия в случае непредельных карбоновых кислот. Электронная плотность p-связи в карбонильной группе смещена в сторону атома кислорода. Вследствие этого у карбонильного углерода создается недостаток электронной плотности, и он притягивает к себе неподелённые пары атома кислорода гидроксильной группы, в результате чего электронная плотность связи О-Н смещается в сторону атома кислорода, водород становится подвижным и приобретает способность отщепляться в виде протона.
|
|
|
В водном растворе карбоновые кислоты диссоциируют на ионы:
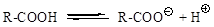
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей. С увеличением молекулярной массы растворимость кислот в воде уменьшается.
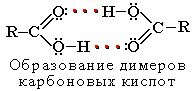
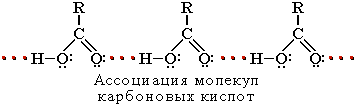
Способы получения
1. CH3-CCl3 + 3NaOH ® СH3-COOH + 3NaCl + H2O (гидролиз тригалогенопроизводных)
2. R-CHO +[O] ® R-COOH (окисление альдегидов и кетонов)
3. 2CH3CH2CH2CH3 + 5O2 ® 4CH3COOH + 2H2O (получение уксусной кислоты)
|
|
|
Химические свойства
Карбоновые кислоты проявляют высокую реакционную способность и вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные: сложные эфиры, соли.
I. а) 2СH3COOH + Fe ®(СH3COO)2Fe + H2 (образование солей)
б) 2CH3COOН + MgO ®(CH3COO)2Mg + H2O;
в) CH3COOH + KOH ®CH3COOK + H2O;
г) CH3COOH + NaHCO3 ®CH3COONa + CO2 + H2O
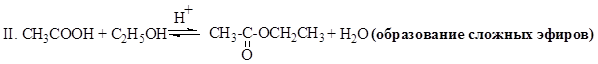
III. CH3-COOH + Cl2 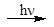 Cl-CH2-COOH + HCl (галогенирование в a-положение)
Cl-CH2-COOH + HCl (галогенирование в a-положение)
Применение
Муравьиная кислота – в фармацевтической и пищевой промышленности.
Уксусная кислота – для синтеза красителей, лекарств, сложных эфиров, ацетатного волокна, негорючей киноплёнки, оргстекла.
Карбоновые кислоты
Дата добавления: 2020-04-25; просмотров: 89; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
