Типы окислительно восстановительных систем, примеры.
2 вида редокс систем: 1) без участия ионов водорода: Fe+3/Fe+2
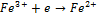 направление реакции зависит от того с чем соединяется платина. Если в начальный момент преобладает присоединение электронов, то на Pt возникает “+” заряд обусловленный недостатком электронов, и наоборот.
направление реакции зависит от того с чем соединяется платина. Если в начальный момент преобладает присоединение электронов, то на Pt возникает “+” заряд обусловленный недостатком электронов, и наоборот.
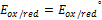 +
+ 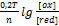
2)2й тип редокс системы с участием ионов водорода:
Например: 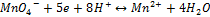
ox red
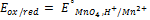 +
+ 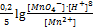
В данном случае – это потенциал системы, когда концентрация ox формы равна концентрации red формы, кроме иона 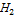 =1.
=1.
Так же как пример рассмотрим хингидронный электрод: он представляет - платиновая пластинка, погружённая в насыщенный раствор хингидрона.
Стандартные окислительно-восстановительные потенциалы. Как их значения характеризуют редокс- системы и определяют направление реакции?
Стандартный редокс потенциал- это потенциал в системе, когда концентрация окислительной и восстановительной форм равны.
Стандартный редокс потенциал приводят в справочнике, они характеризуют окислительно-восстановительные свойства.
Используя, стандартный электродный потенциал можно определить будет ли протекать ОВР и в каком направлении.
Пример: будет ли протекать реакция между FeCl3 и KI :
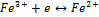
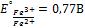

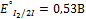
Правило: система обладающая большим 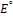 проявляет более сильные окис-e св-ва, то есть
проявляет более сильные окис-e св-ва, то есть  более сильный окислитель, чем I. Поэтому
более сильный окислитель, чем I. Поэтому 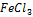 окисляет KI :
окисляет KI : 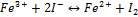
|
|
|
Уравнение Нернста – Петерса для различных типов редокс систем- анализ уравнений.
1) без участия ионов водорода: Fe+3/Fe+2
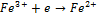 направление реакции зависит от того с чем соединяется платина. Если в начальный момент преобладает присоединение электронов, то на Pt возникает “+” заряд обусловленный недостатком электронов, и наоборот.
направление реакции зависит от того с чем соединяется платина. Если в начальный момент преобладает присоединение электронов, то на Pt возникает “+” заряд обусловленный недостатком электронов, и наоборот.
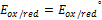 +
+ 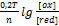
2)2й тип редокс системы с участием ионов водорода:
Например: 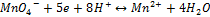
ox red
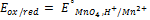 +
+ 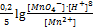
В данном случае – это потенциал системы, когда концентрация ox формы равна концентрации red формы, кроме иона 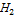 =1.
=1.
n- кол-во электронов,которые передаются от одной формы к другой.
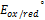 - потенциал окислительно-восстановительной системы, в которой соотношение окислительной и восстановительной форм равно 1.
- потенциал окислительно-восстановительной системы, в которой соотношение окислительной и восстановительной форм равно 1.
Биологическое значение редокс – потенциалов.
Важнейший процесс биологического окисления представляет собой цепь окслительно-восстановительных процессов. Каждое звено этой цепи соответсвует определенной редокс сис со своими потанцеалам и переход электронов от одной системы к другой происходит постепенно, а именно от системы с меньшим потенциалом - к системе с большим потенциалом. Постепенность имеет значение, заключающиеся в том что организм более полно регулировал поступление и использование белков. Это создает возможность контроля образования ве-в на каждый стадии, а значит и обратимость в случае нарушении метаболизма. В жив орг: сис аскорбиновой , фумаровой, янтарной кислот.
|
|
|
45.Механизм возникновение диффузионного потенциала. Как устраняют влияние диффузионного потанцеала на ЭДС.
Диффузионный потенциал – разность потенциалов, возникающая на границе раздела между 2мя неодинаковыми по составу или по конц-ции р-рами .
Диффузионный потенциал усредняет скорости движения ионов при сохранении скачка потенциала на границе раздела растворов разной концентрации. В результате движения ионов в электролитическом мостике возникает диффузионный потенциал направленный противоположно ЭДС гальванического электролита. Его влияние устраняет , включая между рарами электролитов насыщенный рр KCL и KNO3 т.к. подвижности ионов примерно одинаковы:
I(K)=64,4 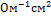 I(Cl)=65,5
I(Cl)=65,5 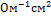
|

Дата добавления: 2020-04-25; просмотров: 1417; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
