Энтропия и второй закон термодинамики
Энтропия – параметр состояния, позволяющий дать количественную формулировку Второго закона термодинамики. Термодинамическая система может быть охарактеризована экстенсивным параметром состояния – энтропией S, дифференциал которой для обратимых процессов определяется соотношением
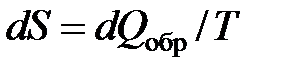 . (4.2)
. (4.2)
Воспользуемся Первым началом термодинамики, переписав выражение (4.2) в виде
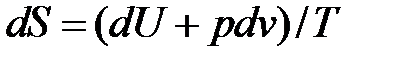 , (4.3)
, (4.3)
где Т – термодинамическая температура.
Энтропия объединенной системы, состоящей из подсистем А,В,С... равна, в соответствии со свойством аддитивности равна, сумме энтропий входящих в нее подсистем
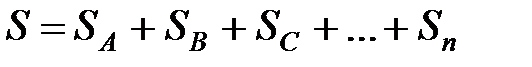 , (4.4)
, (4.4)
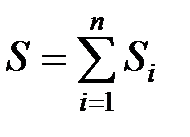 . (4.5)
. (4.5)
Энтропия адиабатной термодинамической системы не может уменьшаться
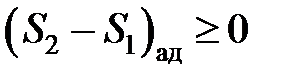 . (4.6)
. (4.6)
Размерность энтропии S [Дж/К], удельной энтропии s [Дж/кгК].
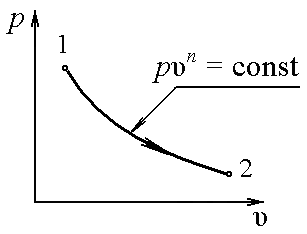
Для большинства систем в термодинамике энтропия зависит лишь от двух параметров
| Рисунок 4.1 Адиабатный процесс |
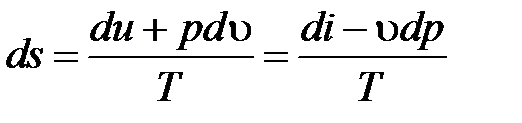 . (4.7)
. (4.7)
Интегральное изменение энтропии справедливо для любого квазистатического изменения состояния 1-2
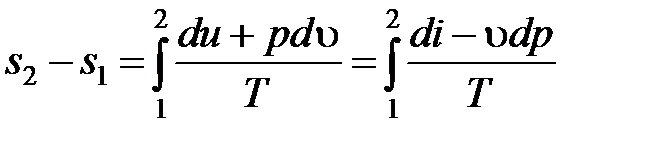 . (4.8)
. (4.8)
Значение разности энтропий 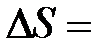 S2 – S1 не зависит при этом от пути интегрирования, а однозначно определяется состояниями 1 и 2. Это подчеркивается тем фактом, что энтропия является параметром состояния.
S2 – S1 не зависит при этом от пути интегрирования, а однозначно определяется состояниями 1 и 2. Это подчеркивается тем фактом, что энтропия является параметром состояния.
Формулировка Второго закона термодинамики особенно наглядна для адиабатной системы, энтропия которой либо возрастает, либо остается неизменной. Применяя Второй закон термодинамики к неадиабатной системе, следует помнить, что она в сочетании с другими системами, с которыми обменивается теплом, составляет совокупную адиабатную систему. Каждая неадиабатная подсистема в ходе термодинамического процесса испытывает свое определенное изменение энтропии
|
|
|
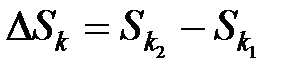 ,
, 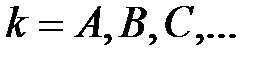
причем это изменение 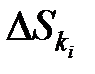 может быть положительным, отрицательным или равным нулю. Однако сумма всех приращений для каждой подсистемы в результате не может быть отрицательной. В этом и состоит суть Второго начала
может быть положительным, отрицательным или равным нулю. Однако сумма всех приращений для каждой подсистемы в результате не может быть отрицательной. В этом и состоит суть Второго начала
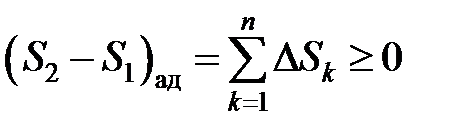 (4.9)
(4.9)
Применение Первого и Второго законов термодинамики
К изолированным системам
Процессы, протекающие в изолированных системах, в том числе и самопроизвольные, связанные с выравниванием параметров, должны удовлетворять условиям
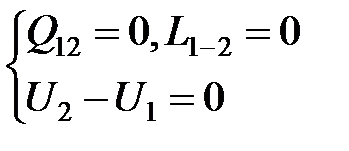 (4.10)
(4.10)
Но изолированная система адиабатна и поэтому в соответствии со Вторым законом термодинамики при отсутствии теплообмена энтропия остается неизменной либо возрастает
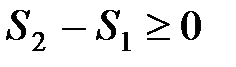 .
.
Все процессы в изолированных системах протекают таким образом, что внутренняя энергия ее остается неизменной, а энтропия возрастает вследствие необратимости протекающих процессов до некоторого максимума.
|
|
|
Состояние с максимально возможной энтропией соответствует равновесию изолированной системы.
Клаузиус выразил содержание уравнений 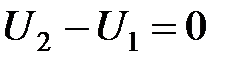 и
и 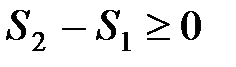 формулировкой: “Энергия мира постоянна, энтропия мира стремится к максимуму”. Эта формулировка привела к философским спекуляциям и к необоснованно пресловутому положению о неизбежности тепловой смерти. Однако выводы Первого и Второго начал были получены для систем конечных размеров и изолированных, поэтому отмеченные положения вряд ли разумно распространять на бесконечные системы, изолированность которых никак не доказана.
формулировкой: “Энергия мира постоянна, энтропия мира стремится к максимуму”. Эта формулировка привела к философским спекуляциям и к необоснованно пресловутому положению о неизбежности тепловой смерти. Однако выводы Первого и Второго начал были получены для систем конечных размеров и изолированных, поэтому отмеченные положения вряд ли разумно распространять на бесконечные системы, изолированность которых никак не доказана.
Дата добавления: 2020-04-25; просмотров: 121; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!