Уравнение Клапейрона-Менделеева для одного моля газа
Первый закон термодинамики для закрытой системы
Первый закон термодинамики является одним из двух основных законов, на которых базируется вся современная термодинамика.
Известно, что процесс изменения состояния термодинамического тела (системы) происходит при энергетическом взаимодействии его с внешней средой. Мерой этого взаимодействия является работа. Первый закон термодинамики представляет собой приложение к термодинамической системе общего закона сохранения энергии, согласно которому в замкнутой изолированной системе возможны взаимопревращения форм энергии, но сумма всех видов энергии является величиной постоянной.Аналитическое выражение этой формулировки будет соответствовать равенству энергии такой термодинамической системы в начале и конце процесса:
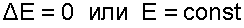
| (3.1) |
где Е- энергия термодинамической системы.
Для неизолированной термодинамической системы изменению энергии будет соответствовать сумма работ, произведенных в этой системе, поскольку работа есть мера энергетического взаимодействия. Для такой системы закон сохранения энергии будет представлен выражением:

| (3.2) |
где А1 - Аn - работы данной термодинамической системы.
Для получения выражения первого закона термодинамики необходимо установить взаимосвязь различных форм преобразования энергии с полученными в результате этих преобразований работами в теле или системе.
|
|
|
В данном разделе познакомимся с первым законом термодинамики для закрытых (без обмена веществом с окружающей средой) термодинамических систем. Для открытых систем первый закон термодинамики будет рассмотрен позднее, по мере необходимости изучения соответствующих процессов: истечения, дросселирования, смешения и т.п.
Для строгого математического формулирования этого закона необходимо дать понятия возможных форм энергии и работ, применительно к термодинамической системе.
δQ=dU+δL – количество теплоты подведённое к рабочему телу расходуется на изменение внутренней энергии(приращение,т.е. увелич. вн.эн.) и совершение работы против внешних сил
1)δQ=0 – адиабатный
δL=-dU – при расширении внутренняя энергия уменьш.
dU=-δL – при сжатии вн.эн. уменьш.
2)dU=0, T=const – изотермический
δQ=δL – кол-во теплоты идёт на совершение работы
3)δL=0, V=const – изохорный
δQ=dU – кол-во теплоты идёт на увели. Температуры
Основные параметры термодинамической системы и уравление Менеделеева-Клайперона
Термодинамическая система - совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами (внешней средой).
|
|
|
Состояние системы - совокупность физических величин (термодинамических параметров, параметров состояния), которые характеризуют свойства термодинамической системы: температура, давление, удельный объем.
Термодинамический процесс - любое изменение в термодинамической системе, приводящее к изменению хотя бы одного из ее термодинамических параметров.
Термодинамическое равновесие - такое состояние макроскопической системы, когда ее термодинамические параметры не изменяются с течением времени.
Равновесные процессы -процессы, которые протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало.
Изопроцессы - это равновесные процессы, при которых один из основных параметров состояния сохраняется постоянным.
Изобарный процесс - процесс, протекающий при постоянном давлении (в координатах V,t он изображается изобарой).
Изохорный процесс - процесс, протекающий при постоянном объеме (в координатах p,t он изображается изохорой).
Изотермический процесс - процесс, протекающий при постоянной температуре (в координатах p,V он изображается изотермой).
Адиабатический процесс - это процесс, при котором отсутствует теп Уравнение состояния идеального газа (уравнение Клапейрона-Менделеева)
|
|
|
Функциональная связь между давлением, объемом и температурой называется уравнением состояния. Для идеального газа, используя законы Бойля-Мариотта, Гей-Люссака и Авогадро, можно получить:
уравнение Клапейрона-Менделеева для одного моля газа
pVm = RT, (1a)
где R = 8.31 Дж/моль.К - газовая постоянная (она находится после подстановки в последнее уравнение нормальных условий)
Дата добавления: 2020-04-08; просмотров: 132; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
