Лазеры - оптические квантовые генераторы
В начале 60-х годов был создан квантовый генератор оптического диапазона - лазер “Light Amplification by Stimulated emission of Radiation” - усиления света путем индуцированного испускания излучения. Свойства лазерного излучения: высокая монохроматичность (предельно высокая световая частота), острая пространственная направленность, огромная спектральная яркость.
Согласно законам квантовой механики, энергия электрона в атоме не произвольна: она может иметь лишь определенный (дискретный) ряд значений Е1, Е2, Е3... Еn, называемых уровнями энергии. Значения эти различны для разных атомов. Набор дозволенных значений энергии носит название энергетического спектра атома. В нормальных условиях (при отсутствии внешних воздействий) большая часть электронов в атомах пребывает на самом низком возбужденном уровне Е1, т.е. атом обладает минимальным запасом внутренней энергии; остальные уровни Е2, Е3.....Еn соответствуют более высокой энергии атома и называются возбужденными.
При переходе электрона с одного уровня энергии на другой атом может испускать или поглощать электромагнитные волны, частота которых nmn = (Еm - Еn)h,
где h - постоянная Планка (h = 6.62 · 10-34 Дж·с);
Еn - конечный, Еm - начальный уровень.
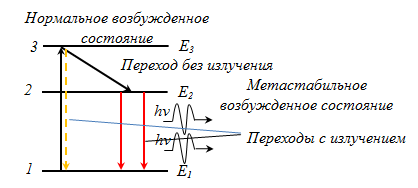
Возбужденный атом может отдать свою некоторую избыточную энергию, полученную от внешнего источника или приобретенную им в результате теплового движения электронов, двумя различными способами.
|
|
|
Всякое возбужденное состояние атома неустойчиво, и всегда существует вероятность его самопроизвольного перехода в более низкое энергетическое состояние с испусканием кванта электромагнитного излучения. Такой переход называют спонтанным (самопроизвольным). Он носит нерегулярный, хаотический характер. Все обычные источники дают свет в результате спонтанного испускания.
Таков первый механизм испускания (электромагнитного излучения). В рассмотренной двухуровневой схеме испускания света никакого усиления излучения добиться не удастся. Поглощенная энергия hn выделяется в виде кванта с той же энергией hn и можно говорить о термодинамическом равновесии: процессы возбуждения атомов в газе всегда уравновешены обратными процессами испукания.
39.
Одним из важнейших «объектов» изучения квантовой статистики, как и классической, является идеальный газ. Это связано с тем, что во многих случаях реальную систему можно в хорошем приближении считать идеальным газом. Состояние системы невзаимодействующих частиц задается с помощью так называемых чисел заполнения Ni — чисел, указывающих степень заполнения квантового состояния (характеризуется данным набором i квантовых чисел) частицами системы, состоящей из многих тождественных частиц. Для систем частиц, образованных бозонами — частицами с нулевым или целым спином, числа заполнения могут принимать любые целые значения: 0, 1, 2, ... . Для систем частиц, образованных фермионами — частицами с полуцелым спином, числа заполнения могут принимать лишь два значения: 0 для свободных состояний и 1 для занятых. Сумма всех чисел заполнения должна быть равна числу частиц системы. Квантовая статистика позволяет подсчитать среднее число частиц в данном квантовом состоянии, т. е. определить средние числа заполнения áNiñ.
|
|
|
Идеальный газ из бозонов — бозе-газ — описывается квантовой статистикой Бозе - Эйнштейна.* Распределение бозонов по энергиям вытекает из так называемого большого канонического распределения Гиббса (с переменным числом частиц) при условии, что число тождественных бозонов в данном квантовом состоянии может быть любым:
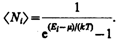 (235.1)
(235.1)
* Ш. Бозе (1894—1974) — индийский физик.
Это распределение называется распределением Бозе - Эйнштейна. Здесь áNiñ — среднее число бозонов в квантовом состоянии с энергией Ei , k —постоянная Больцмана, Т—термодинамическая температура, m —химический потенциал; m не зависит от энергии, а определяется только температурой и плотностью числа частиц. Химический потенциал находится обычно из условия, что сумма всех áNiñ равна полному числу частиц в системе. Здесь m £ 0, так как иначе среднее число частиц в данном квантовом состоянии отрицательно, что не имеет физического смысла. Он определяет изменение внутренней энергии системы при добавлении к ней одной частицы при условии, что все остальные величины, от которых зависит внутренняя энергия (энтропия, объем), фиксированы.
|
|
|
Идеальный газ из фермионов — ферми-газ — описывается квантовой статистикой Ферми - Дирака.* Распределение фермионов по энергиям имеет вид
 (235.2)
(235.2)
где áNiñ — среднее число фермионов в квантовом состоянии с энергией Е i , m — химический потенциал. В отличие от (235.1) m может иметь положительное значение (это не приводит к отрицательным значениям чисел áNiñ). Это распределение называется распределением Ферми - Дирака.
* Э. Ферми (1901—1954) — итальянский физик.
Если  >>1, то распределения Бозе - Эйнштейна (235.1) и Ферми - Дирака (235.2) переходят в классическое распределение Максвелла - Больцмана:
>>1, то распределения Бозе - Эйнштейна (235.1) и Ферми - Дирака (235.2) переходят в классическое распределение Максвелла - Больцмана:
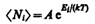 (235.3)
(235.3)
(ср. с выражением (44.4)), где
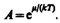 (235.4)
(235.4)
Таким образом, при высоких температурах оба «квантовых» газа ведут себя подобно классическому газу.
|
|
|
Система частиц называется вырожденной, если ее свойства существенным образом отличаются от свойств систем, подчиняющихся классической статистике. Поведение как бозе-газа, так и ферми-газа отличается от классического газа, они являются вырожденными газами. Вырождение газов становится существенным при весьма низких температурах и больших плотностях. Параметром вырождения называется величина А. При А<<1, т. е. при малой степени вырождения, распределения Бозе - Эйнштейна (235.1) и Ферми - Дирака (235.2) переходят в классическое распределение Максвелла - Больцмана (235.3).
Температурой вырождения Т0 называется температура, ниже которой отчетливо проявляются квантовые свойства идеального газа, обусловленные тождественностью частиц, т. е. Т0 — температура, при которой вырождение становится существенным. Если Т >> Т0, то поведение системы частиц (газа) описывается классическими законами.
40.
-
41.
-
42.
Согласно квантовой теории энергия электронов в атомах или молекулах квантуется, т. е. может принимать только некоторые дискретные значения, разделенные конечными промежутками. Эти значения называются уровнями энергии. Согласно принципу запрета Паули, на каждом энергетическом уровне может находиться не более двух электронов с противоположно направленными собственными моментами импульса (спинами).
Чтобы понять, как формируется электронная структура кристаллов, рассмотрим воображаемый процесс объединения атомов в кристалл (рис. 2). Пусть первоначально имеется N изолированных атомов какого-либо вещества. Пока атомы изолированы друг от друга, они имеют полностью совпадающие схемы энергетических уровней. Заполнение уровней электронами осуществляется в каждом атоме независимо от заполнения аналогичных уровней в других атомах. По мере сближения атомов между ними возникает все усиливающееся взаимодействие, которое приводит к изменению положения уровней. В результате вместо одного одинакового для всех N атомов уровня возникают N очень близких, но не совпадающих уровней. Таким образом, каждый уровень изолированного атома расщепляется в кристалле на N густо расположенных уровней, образующих энергетическую полосу или зону. Говорят, что энергетический уровень расщепляется в зону.
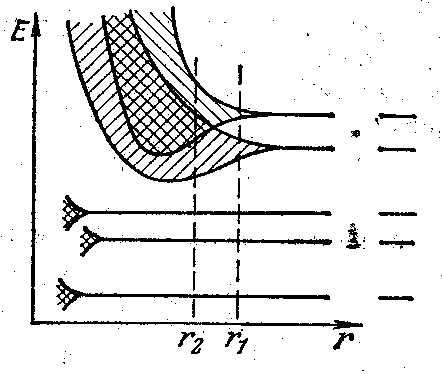
|
| Рис 2. Образование энергетических зон в кристаллах |
Заметно расщепляются лишь уровни, занимаемые валентными электронами. Такому же расщеплению подвергаются и более высокие уровни (возбужденные состояния), не занятые электронами в основном состоянии атома.
В зависимости от конкретных свойств атомов равновесное расстояние между соседними атомами в кристалле может быть либо типа r1, либо типа r2 (см. рис. 2). При расстоянии типа r1 между разрешенными зонами, возникшими из соседних уровней атома, имеется зона энергий, которые электроны не могут иметь. Эта зона называется запрещенная зона. При расстоянии типа r2 происходит перекрывание соседних зон. Число уровней в такой слившейся зоне равно сумме количеств уровней, на которые расщепляются оба уровня атома.
Итак, спектр возможных значений энергии валентных электронов в кристалле распадается на ряд разрешенных и запрещенных зон (рис. 3). Ширина зон не зависит от размеров кристалла. Таким образом, чем больше атомов содержит кристалл, тем теснее располагаются уровни в зоне. Ширина разрешенных зон имеет величину порядка нескольких электронвольт (1 эВ = 1,6∙10-19 Дж). Следовательно, если кристалл содержит 1023 атомов, расстояние между соседними уровнями в зоне составляет ~10-23 эВ.
В соответствии с принципом Паули электроны в зонах заполняют попарно энергетические уровни, начиная с уровня с наименьшей энергией.
Разрешенную зону, возникшую, из того уровня, на котором находятся валентные электроны в основном состоянии атома, мы будем называть валентной зоной. При абсолютном нуле валентные электроны заполняют последовательно попарно все нижние уровни валентной зоны. Более высокие разрешенные зоны будут от электронов свободны или заполнены частично.
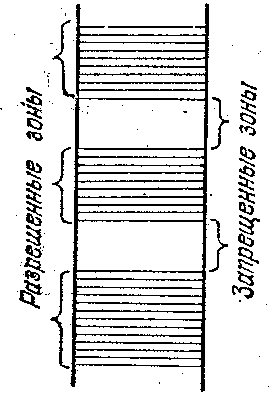
|
| Рис 3. Разрешённые и запрещённые зоны в кристаллах |
В зависимости от степени заполнения валентной зоны электронами и ширины запрещенной зоны возможны три случая ( рис. 4).
В случае а) электроны заполняют валентную зону не полностью. Поэтому достаточно сообщить электронам, находящимся на верхних уровнях, совсем небольшую энергию (~10-23 — 10-22 эВ) для того, чтобы перевести их на более высокие уровни. Энергия теплового движения (kТ) составляет при T =1 К величину порядка 10-4 эВ. Следовательно, при температурах отличных от абсолютного нуля, часть электронов переводится на более высокие уровни.
Дополнительная энергия, вызванная действием на электрон электрического поля, также оказывается достаточной для перевода электрона на более высокие уровни. Поэтому электроны могут ускоряться электрическим полем и приобретать дополнительную скорость в направлении, противоположном направлению поля. Таким образом, кристалл с подобной схемой энергетических уровней будет представлять собою металл.
Частичное заполнение валентной зоны (в случае металла ее называют также зоной проводимости) наблюдается в тех случаях, когда на последнем занятом уровне в атоме находится только один электрон или когда имеет место перекрывание зон (см. рис. 2, расстояние r2). В первом случае N электронов проводимости заполняют попарно только половину уровней валентной зоны. Во втором случае число уровней в зоне проводимости будет больше N, так что, даже если количество электронов проводимости равно 2N, они не смогут занять все уровни зоны.
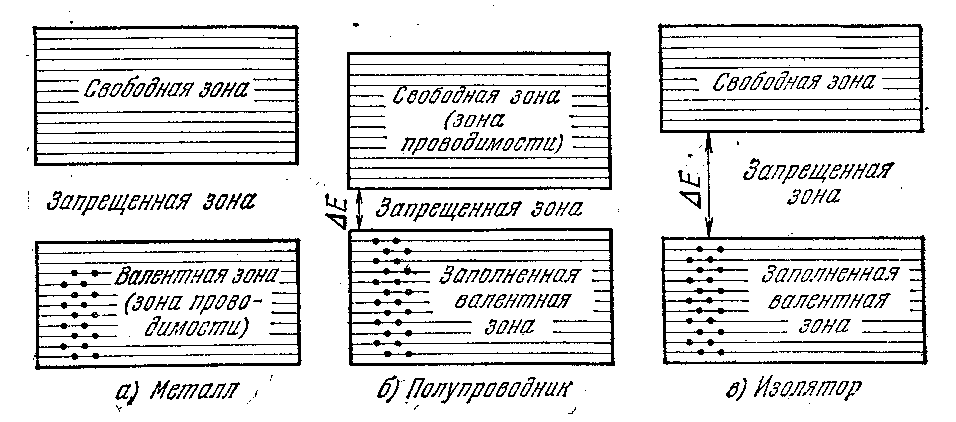
|
| Рис 4. Зонная структура металлов, полупроводников и диэлектриков |
При Т = 0 К полностью заполненными оказываются все энергетические уровни, расположенные ниже так называемого уровня Ферми, с энергией, называемой энергией Ферми 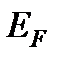 . Этот уровень разделяет полностью заполненные и полностью свободные (выше уровня Ферми) энергетические уровни.
. Этот уровень разделяет полностью заполненные и полностью свободные (выше уровня Ферми) энергетические уровни.
В представленном на рис. 4, б случае все уровни валентной зоны полностью заняты электронами — данная зона заполнена. Для того чтобы увеличить энергию электрона, необходимо сообщить ему количество энергии, не меньшее, чем ширина запрещенной зоны DEg. Электрическое поле (во всяком случае, такой напряженности, при которой не происходит электрический пробой кристалла) сообщить электрону такую энергию не в состоянии. При этих условиях электрические свойства кристалла определяются шириной запрещенной зоны DEg.
Если эта ширина невелика, энергия теплового движения оказывается достаточной для того, чтобы перевести часть электронов в верхнюю свободную зону. Эти электроны будут находиться в условиях, аналогичных тем, в которых находятся валентные электроны в металле. Свободная зона окажется для них зоной проводимости. Одновременно станет возможным переход электронов валентной зоны на освободившиеся верхние уровни этой же зоны. Под действием внешнего электрического поля начнется направленное движение электронов в зоне проводимости, как отрицательных зарядов. В валентной зоне свободные места (дырки) под действием электрического поля будут двигаться как положительные заряды. Такое вещество называется собственным полупроводником.
Если ширина запрещенной зоны DEg велика, тепловое движение, вплоть до температуры плавления кристалла, не сможет забросить в свободную зону заметное число электронов. В этом случае кристалл оказывается диэлектриком (рис. 4, в).
Вещества, у которых DEg < 3 эВ формально относят к полупроводникам, а к диэлектрикам – с DEg > 3 эВ.
Конкретный пример образования энергетических зон в алмазе приведен на рисунке 5.
При сближении атомов углерода до расстояния х0 происходит перекрытие зон, образованных из электронных состояний 2s и 2p в атомах углерода. Это явление называют s-p гибридизацией. Равновесное состояние кристалла алмаза достигается при расстоянии между атомами, равном а0, когда энергия электронов валентной зоны достигает минимума. В этих условиях ширина запрещённой зоны составляет 5,3 эВ.
Аналогичным образом образуются энергетические зоны в кристаллах кремния (из состояний 3s и 3p) и германия (из состояний 4s и 4p), у которых ширина запрещённой зоны при Т = 0 К составляет соответственно 1,165 и 0,746 эВ.
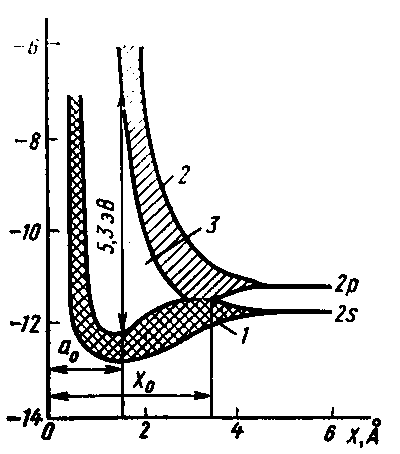
Рис. 5. Образование энергетических зон в алмазе.
43.
Состояние электронов в атоме с позиции квантово-механической модели оп-
ределяется плотностью вероятности обнаружения электрона в данной области про-
странства. Граничная поверхность, внутри которой сосредоточена область наи-
большей вероятности обнаружения электрона, называется атомной орбиталью
(АО) . Атомная орбиталь характеризуется набором трёх параметров, называемых
квантовыми числами.
Главное квантовое число n в основном опpеделяет энеpгию АО. Его зна-
чение равно номеру энергетического уровня, на котором находится электрон.
Оpбитальное квантовое число в основном опpеделяет фоpму АО и, в
некоторой степени, ее энеpгию. Значение определяет энергетический
подуровень (s-, p-, d- или f-), на котором находится электрон.
Магнитное квантовое число m опpеделяет пpостpанственную оpиентацию
данной АО.
Кpоме этих квантовых чисел, хаpактеpизующих АО, имеется еще одно
квантовое число − s (спиновое) , являющееся собственной хаpактеpистикой
электpона.
Электроны в атоме расположены на энергетических уровнях, которые со-
держат различные энергетические подуровни, состоящие, в свою очередь, из
определенного количества атомных орбиталей: s- подуровень состоит из одной,
р- подуровень ─ из трех, d- подуровень ─ из пяти и f- подуровень ─ из семи
орбиталей.
Условная запись, представляющая распределение электронов атома по энерге-
тическим уровням и подуровням (атомным орбиталям) , называется электронной
формулой атома. Для составления электронной формулы, в которой представ-
лено состояние каждого электрона (его энергия, форма орбитали, магнитные ха-
рактеристики) , необходимо знать:
− последовательность заполнения подуровней электронами (принцип наименьшей
энергии) ,
− максимальную емкость каждого подуровня.
При распределении электронов по квантовым ячейкам следует руководство-
ваться принципом Паули: в атоме не может быть двух электронов с одинаковым
набором значений всех квантовых чисел, т. е. атомная орбиталь не может содер-
жать более двух электронов, причем их спиновые моменты должны быть проти-
воположными
↑↓
Система обозначений в общем виде выглядит так:
nℓx,
где п − главное, ℓ − орбитальное квантовые числа; х − количество электронов,
находящихся в данном квантовом состоянии. Например, запись 4d3 может быть
истолкована следующим образом: три электрона занимают четвертый энергетиче-
ский уровень, d- подуровень.
Характер застройки энергетических подуровней определяет принадлежность
элемента к тому или иному электронному семейству.
В s-элементах происходит застройка внешнего s-подуровня, например,
11 Na 1s2 2s2 2p6 3s1
В р-элементах происходит застройка внешнего р-подуровня, например,
9 F 1s 2s2 2p5 .
К s- и p- семействам относятся элементы главных подгрупп периодической табли-
цы Д. И. Менделеева.
В d-элементах происходит застройка d-подуровня предпоследнего уровня,
например,
2 2 6 2 6 2 2
22Ti 1s 2s 2p 3s 3p 3d 4s .
К d-семейству относятся элементы побочных подгрупп. Валентными у этого се-
мейства являются s-электроны последнего энергетического уровня и d-электроны
предпоследнего уровня.
В f-элементах происходит застройка f-подуровня третьего наружного уровня,
например,
58Се 1s22s22p63s23p63d l04s24p64d l04f l5s25p65d16s2.
Представителями f-электронного семейства являются лантаноиды и актиноиды.
Дата добавления: 2020-04-08; просмотров: 149; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
