Обратите внимание в выражение для скорости простой реакции не входят концентрации продуктов реакции.
Классификация химических реакций
Простые реакции (элементарная стадия сложной реакции) является совокупностью однотипных элементарных химических актов, представляющих собой превращение реагентов в продукты за короткий отрезок времени (порядка 10−13 с для адиабатических и 10−15 с для неадиабатических реакций). Стехиометрическое уравнение реакции описывает реальное взаимодействие т.е. представляет собой механизм химической реакции.
Химические реакции в своем большинстве являются сложными, т. е., включают несколько элементарных (простых) стадий.
В этом случае механизм химической реакции – это совокупность элементарных стадий сложной реакции, связанных общими реагентами и промежуточными продуктами
• Химические реакции, протекающие в гомогенных системах (в их объеме), называются гомогенными, т.е. осуществляются в смеси газов, в жидком растворе, реже – в твердой среде
• Химические реакции, протекающие на границе раздела различных, называются гетерогенными, например:
- твердое тело – газ
- твердое тело – жидкость
- жидкость - газ
- жидкость - жидкость
• Существуют также гомогенно-гетерогенные реакции – это сложные химические реакции, в которых одни стадии являются гомогенными, а другие – гетерогенными.
Скорость реакции
Скорость реакции — это изменение количества вещества (исходного или продукта) в единицу времени в единице реакционного пространства (R), рассчитанное на единицу его стехиометрического коэффициента (закон действующих (действия ) масс , установленный Гульдбергом и Вааге 1879 г)::
|
|
|
ri = 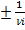 *
* 
Для гомогенных реакций, протекающих в объеме, реакционным пространством является объем (R ≡V ) и в закрытой системе
ri = 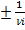
 =
= 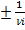

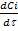 ; [моль/л*с]
; [моль/л*с]
Для реакции в газовой среде могут использоваться вместо концентрации их парциальные давления pi :
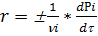
скорость такой химической реакции, измеряют в Па/с
Если реакция гетерогенная и протекает на границе фаз, то реакционным пространством является поверхность (R ≡ S).
ri = 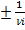
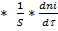 ; [моль/м2*с]
; [моль/м2*с]
В закрытых системах изменение количества вещества с течением времени происходит только за счет протекания в них химических реакций:
nАА + nВВ à nСС + nDD
Скорость реакции не зависит от выбора реагента, она всегда положительна
Пример: СOCl2 àCO + Cl2
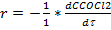 =
=  =
= 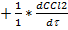
Кинетическое уравнение это зависимость скорости реакции от концентрации регантов. Для простых реакций или элементарных стадий сложных реакций справедлив закон действующих масс(действия масс), установленный Гульдбергом и Вааге 1879 г:
|
|
|
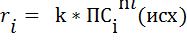 , где , где
|
k – коэффициент пропорциональности, называемый константой скорости реакции, или удельной скоростью реакции.
Величина k численно равна скорости реакции при концентрациях всех реагентов, равных единице. Она является величиной постоянной при данной температуре;
n i – порядок реакции по i-му реагенту
Общий порядок реакции n – сумма показателей степеней при концентрациях всех реагентов: n = S n i , где n = 1,2 и редко 3
Пример из экзаменационных билетов:
Для реакции образования аммиака 3Н2 + N2 à2NH3 cкорость по азоту составила 0,05 моль/л*мин. Запишите выражение для скорости реакции по каждому участнику реакции. Рассчитайте скорость реакции по водороду и аммиаку.
В кинетике химические реакции разделяют по признаку молекулярности реакции и по признаку порядка реакции.
• Молекулярность химической реакции – это число частиц-реагентов (молекул, атомов, радикалов), одновременно участвующих в элементарном химическом акте.
Различают мономолекулярные, бимолекулярные и тримолекулярные реакции.
С OCl 2 à CO + Cl 2 – мономолекулярная реакция
|
|
|
2 NO 2 à N 2 O 4 – бимолекулярная реакция
С2 H 4 + Cl 2 à С2 H 4 Cl 2 - бимолекулярная реакция
2 NO + Cl 2 à продукт - тримолекулярная реакция
Критерии простой реакции:
- порядок реакции по i-му реагенту имеет целочисленное значение n i = 0,1,2 и 3 (очень редко). Порядок реакции n i = 0 хотя формально рассматривается в формальной кинетики, но относится к сложным реакция.
- общий порядок n = S n i , где n = 1,2 и редко 3
Если порядок по любому компоненту имеет дробное или отрицательное значение это прямое доказательство, что реакция сложная.
- Молекулярность и порядок реакции совпадают n i = ni
- Энергия активации реакции положительна Еа > 0
Примеры из лекции:
СOCl2 àCO + Cl2 ; r = k*CСOCl2 ; n = 1 (реакция 1 порядка)
2NO2 à N2O4 ; r = k*C2NO2 ; n = 2 (реакция 2 порядка)
С2H4 + Cl2 à С2H4Cl2; r = k*CCl2 *CС2H4 ; n = 2 (реакция 2 порядка)
2NO + Cl2 à продукт ; r = k*CCl2 *C2NO; n = 3 (реакция 3 порядка)
Вывод: молекулярность простой реакции совпадает с ее общим порядком реакции.
Обратите внимание в выражение для скорости простой реакции не входят концентрации продуктов реакции.
Пример из экзаменационных билетов:
1. Определите общий порядок реакции и сделайте вывод о типе реакции (простая или сложная).
|
|
|
r = kCA 1/2 CB 3/2
Ответ: Общий порядок n = ½ + 3/2 =2. Реакция сложная, т.к. порядки реакции имеют дробное значение
2. Кинетика фотохимического хлорирования тетрахлорэтилена в растворе
описывается уравнением :

Ответ: Реакция сложная, т.к. порядок по Cl2 имеет дробное значение
Для простых реакций молекулярность и порядок реакции совпадают.
Несовпадение молекулярности и порядка реакции имеет место в трех основных случаях:
для сложных реакций,
для гетерогенных реакций и
для реакций с избытком одного из реагирующих веществ.
Кинетическая кривая - зависимость концентрации одного из реагентов или продуктов от времени.
С i = f ( t ) .
Вид этого уравнения зависит от порядка реакции. Кинетическую кривую можно получить путем интегрирования выражения для скорости реакции: Например
А à Пр, ni = ni =1 ; 
∫dCA/CA = -∫kt отсюда получим ln(CA) = ln(C0A ) -kt
Время полупревращения ( или полураспада ) t 1/2 - это время , за которое прореагирует половина взятого исходного вещества СА=С0А/2.
Например, для реакции первого порядка оно равно:
t 1/2 = 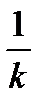
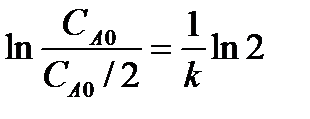 ,
,
т.е. для реакций первого порядка время полупревращения не зависит от начальной концентрации реагента. Зависимость времени полупревращения от начальной концентрации для реакций других порядков приведены в таблице.
Задачи химической кинетики
• Все задачи химической кинетики разделяются на прямые и обратные. Прямая задача химической кинетики — это расчет скорости протекания реакции на основе информации о ее механизме, константах скоростей отдельных стадий реакции и о ее начальных условиях.
• Обратная задача химической кинетики — это процедура определения механизма сложного процесса, констант скоростей отдельных стадий реакции на основе опытных данных.
Дальнейшая работа основана на таблице формальной кинетики.
Методы определения порядков реакции (обратная задача) – номер метода совпадает с номером столбца в таблице
Для реакции nAА+ nBВ --à Пр
1 – Метод Вант-Гоффа
2 - Метод подбора уравнений (колонки 2.1., 2.2. )
3 - Метод времен t1/2 (кол. 3):
Вспомогательные методы
4. Метод понижения порядка. (Метод понижения порядка или изолирования Оствальда)
r = kCAnaCBnb = k’CAna где k’ = kCBnb . Cправедливо, если CB0 / CA0 = 8-10 и более
Дальнейшая работа основана на таблице формальной кинетики.
| n | r= k* П Cin | Y=ax +b | График | t 1/2 | k | Примечание |
| n | r= k* П Cin | Y=ax +b | График | t 1/2 | k | Примечание |
| 0 | r = kCa0 =k | Ca=Ca0-kt | Ca=f(t) | Ca0/2k | моль/л*c | |
| 1 | r = kCa1 | lnCa=lnCa0-kt | lnCa= f(t) | ln2/k | 1/ c | |
| 2 | r = kCa2 | 1/Ca = 1/Ca0 +kt | 1/Ca = f(t) | 1/Ca0 k | л/моль*с | Ca = Cb |
| 2 | r = kCaCb | lnCa/Cb= lnCa0/Cb0 + (Ca0-Cb0) kt | lnCa/Cb= f(t) | л/моль*с | Ca ¹ Cb | |
| 3 | r = kCa3 | 1/Ca2 = 1/(Ca0)2 +2kt | 1/Ca2 = f(t) | 3/2*1/(Ca0)2 k | л2/моль2*с | Ca = Cb =Сс |
| Метод | 1 | 2.1 | 2.2 | 3 |
Задачи на семинар построены не по реакциям различного порядка, а по типу экспериментальных данных.
Для преподавателей – На семинар , лекцию и лабораторные занятия каждый студент должен иметь указанную таблицу для эффективной работы.
Таблица в электронном виде будет разослана в каждую группу.
Дата добавления: 2019-11-16; просмотров: 145; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
