При этом происходит понижение общего порядка реакции ( другое название -метод понижения порядка)
Температурная зависимость константы скорости.
Температурная зависимость константы скорости описывается уравнением Аррениуса :
k = A * 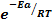 или
или  , где
, где
k - константа скорости; R = 8,314 [Дж/моль K]
A - предэкспоненциальный множитель
Ea - энергия активации [Дж/моль]
Множитель A пропорционален общему числу соударений между молекулами в единицу времени. Размерность А совпадает с размерностью константы скорости и, следовательно, А зависит от суммарного порядка реакции. Число столкновений для 1 моля газа представляет большую величину. Среднее теоретическое значение А1теор = 109 - 1010 для реакции 1 порядка и А2теор = 1011 - 1012 для реакции 2 порядка.
Экспонента 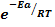 равна доле активных соударений от их общего числа, т.е. столкнувшиеся молекулы должны иметь достаточную энергию взаимодействия.
равна доле активных соударений от их общего числа, т.е. столкнувшиеся молекулы должны иметь достаточную энергию взаимодействия.
Среднее значение энергии активации составляет 80 – 120 кДж/моль
Параметры уравнения Аррениуса определяются экспериментально при изучении температурной зависимости константы скорости. Если имеются значения константы скорости при двух температурах, то энергия активации рассчитывается по формуле
k = A* 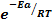 ; lnk1 = lnA – Ea/RT1 и lnk2= lnA – Ea/RT2 , отсюда k = A* ln(k2/k1) = Ea/R*(1/T1 – 1/T2) или
; lnk1 = lnA – Ea/RT1 и lnk2= lnA – Ea/RT2 , отсюда k = A* ln(k2/k1) = Ea/R*(1/T1 – 1/T2) или 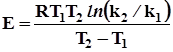
Значения А определяют после подстановки среднего значения Еа в уравнение Аррениуса при любой температуре.
|
|
|
k = A* 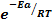 ; lnk = lnA – Ea/RT à lnA = lnk + Ea/RT
; lnk = lnA – Ea/RT à lnA = lnk + Ea/RT
Задача 5. Для реакции йодистого этила с алкоголятом натрия в этиловом спирте
CH 3 I + C 2 H 5 O - = CH 3 OC 2 H 5 + I -
найдены следующие значения константы скорости второго порядка
| t, 0C | 0 | 6 | 12 | 18 | 24 |
| k×105, л/(мол××с) | 5,00 | 11,8 | 24,5 | 48,8 | 100 |
Определить энергию активации реакции и предэкспоненциальный член уравнения Аррениуса, рассчитать константу скорости при 15 о С.
Решение. Рассчитаем необходимые для построения графика 2.2 величины
| T, K | 273 | 279 | 285 | 291 | 297 |
| T-1×103, К- 1 | 3,663 | 3,584 | 3,508 | 3,436 | 3,367 |
| ln k | 1,609 | 2,468 | 3,199 | 3,888 | 4,605 |
(Обращаем Ваше внимание на то, что при расчете величин 1/T нужна учитывать третий знак после запятой, так как область изменения аргумента составляет всего 0,3 единицы и в противном случае точность определения искомой величины не будет соответствовать точности экспериментальных данных)
Построим график ln k - 1/T и найдем угловой коэффициент его наклона (рис. 2.1)
|
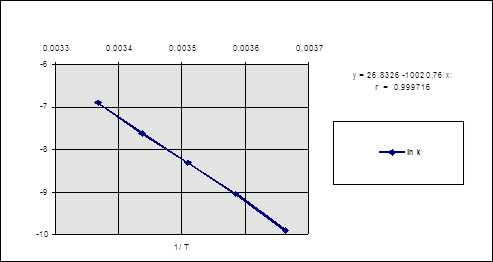
Рис. 2.1. Зависимость логарифма константы скорости реакции от обратной температуры.
|
|
|
t g a = -9,74 + 7,237/(3,65 - 3,4) ×10-3 = -10,02 ×103 К, такое же значение коэффициента при аргументе в регрессионном уравнении.
E = - R × tg a = 8,314 Дж/(моль×К) ×10,02×103 К = 83306 Дж/моль = = 83,3 кДж/моль.
Для расчета предэкспонента используем значение k при 24оС (точка хорошо лежит на графике)
ln А = ln k + E / RT = - 6,905 + 10020/297 = - 6,905+33737 =26,83.
Можно использовать также значение свободного члена в регрессионном уравнении. Отсюда А = 4, 50 ×1011 л/(моль×с)
Используя найденные параметры уравнения Аррениуса можно определить константу скорости данной реакции при любой температуре в рабочем интервале, например при 15оС
k15 =4,50×1011×exp[-83300/(8,314×288)]= 4,50 ×1011 ×7,786 ×10-16 =
=35,0.10-5 л/(моль.с) или так
ln (k15/k24) = E × (T2 -T1) /R × T2 × T1 = 83300 ×(- 9)/ (8,314 ×288 ×297 ) = - 1,054
k15/k24 = 0,349 Þ k15 = 0,349 × 10-3 = 3,49 ×10-4 л/(моль×с)
Дата добавления: 2019-11-16; просмотров: 267; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
