Описание химико-турбулентного взаимодействия.
Моделирования самовоспламенения углеродно-воздушных смесей.
Было обращено внимание на процессы разработки воспламенения углеродно-воздушных смесей. В этом играют роль термохимические операции, которые приводят к построению бассейна радикалов в зажигательной смеси. В то же время будет достигаться определенная критическая концентрация реактивного вида, поскольку происходит основной оборот топливно-воздушной смеси и спонтанное высвобождение энергии. В этой работе турбулентное течение рассматривается в пределах сгорания, потому что происходит взаимодействие химических и турбулентных процессов. При этом статический просмотр течения к нераскрытым понятиям в переходных уравнениях, которые должны быть определены с помощью дополнительных моделей.
Чтобы понять термохимические операции при основных связях описания химических реакций необходимо ознакомиться с разделом. Основные определения химических источников изложены в уравнениях. В разделе содержится обзор описания самовоспламенения различной глубины детализации и модернизации усилий. Подраздел предоставляет различные возможности рассмотрения химической турбулентности, конкретно ссылаясь на модель, используемую в этой работе, получен частично перемешанный реактор (ЧПР).
Основные химические реакции.
Оборот моля любого топлива F при помощи α молей окислителя к b моли продуктов сгорания Pr можно определить по грубой реакции:
|
|
|
 (5.1)
(5.1)
Временный расход в концентрации топлива определяется следующим образом, обыкновенное дифференциальное уравнение:
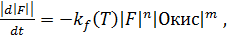 (5.2)
(5.2)
В размерах, указанных в квадратных скобках, молярные концентрации веществ. Уравнение 5.2 утверждает, что потребление F пропорционально концентрациям из реагентов, где коэффициент  называется коэффициентом скорости реакции брутто (5.1). Показатели n, m являются порядками реакции, основанными на отдельные виды. Сумма показателей соответствует общему порядку реакций.
называется коэффициентом скорости реакции брутто (5.1). Показатели n, m являются порядками реакции, основанными на отдельные виды. Сумма показателей соответствует общему порядку реакций.
Проблема использования грубых реакций состоит в том, что они имеют сложные законы времени, и категории реакции не являются прямыми числами, могут быть отрицательными, зависят от времени и условий реакции. Кроме того, грубые реакции не подходят для глубокого понимания истинных химических процессов. Поэтому вместо этого используются элементные реакции. Они работают на молекулярном уровне так же, как его описывает уравнение реакции. Кроме того, порядок элементарной реакции в каждом случае постоянен и равен молекулярности элементарной реакции.
Для того чтобы определить степень превращения этих элементарных реакций необходимо, чтобы участвующие виды связывались с  элементарных реакций формы:
элементарных реакций формы:

|
|
|
Стехиометрические коэффициенты, представляющие количества молекул отдельных веществ α указывают в реакции здесь с v . Там химические реакции как вперед так и назад с использованием соответствующего производства. Химические реакции протекают как вперед, так и назад с использованием соответствующего производства, откаты могут работать здесь с различной скоростью обратной реакции. Скорость реакции неявно становиться химической мерой времени реакции. Измерение времени может быть рассчитано с помощью анализа собственных значений. С учетом всех видов, участвующих в реакции k скорость реакции может быть R (f вперед, b назад) определены:
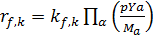 и
и 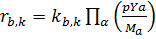 ;
;
Коэффициенты Kf и Kb обозначают коэффициенты скорости k-й реакции. Мα представляет молярный вес вида α. Суммируя все в механизме реакции, занесенные элементарным реакциям, химический первоначальный термин видов α в уравнение транспорта может быть вида:

Для расчета скорости реакции требуются коэффициенты скорости Kf и Kb соответственно. Вывод Kf , основанный на теории столкновений молекул, можно найти, перевернув на, однако подход Аррениуса обычно используется для получения расчета коэффициента скорости.
|
|
|
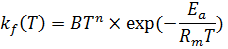
B называется предэкспоненциальным множителем, который слегка зависит от температуры и выражается фактором Тn, Ea - энергия активации, а Rm – универсальная газовая постоянная. С помощью уравнения можно объяснить сильную зависимость химических реакций. Для многих элементарных реакций Н2-СО-С1-С2О2-System указаны факторы для определения коэффициента скорости. Химический источник, возникающий в уравнении получении энергии, записывается следующим образом:
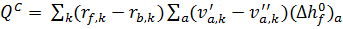 ;
;
где 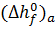 – стандартная энтальпия образования вида a.
– стандартная энтальпия образования вида a.
Стратегии моделирования операций зажигания
Так как считается моделирование зажигания до центральной точки в вычислительном захвате VE, здесь следует дать представления о возможных стратегиях. Напоследок предложения о том, какая стратегия выглядит наиболее перспективной. Подробный обзор дает, на котором должна основываться следующая презентация.
1. Подробный механизм реакции: Было показано, что процесс зажигания длинных углеводородов только путем детального представления комплексных химических операций могут быть показаны. Детальные механизмы химических реакций для высших углеводородов содержат несколько сотен и тысяч видов элементарных реакций. Например: применяется механизм реакции для описания сжигания метана. Большое преимущество детальными механизмами реакции являются их действительность через большое пространство состояний, то есть они охватывают большой диапазон давления и температуры. Недостаток, однако, влияет их применение к вычислительной производительности, потому что для всего содержится в механизме вид, является собственным уравнением баланса массы видов.
|
|
|
2. Уменьшенная кинетика: В приведенном выше пункте было сказано, что детальная кинетика означает высокое вычислительное усилия. Чтобы обойти это обстоятельство возможно использование снижение кинетики. Одна из возможностей заключается в том, чтобы предположить что, частичный баланс и квазистационарность сводят весь механизм к тому, чтобы это было применимо для 3D-моделирования. С помощью расчетов гомогенных реакторов определены важные этапы реакции. Для этой цели доступно несколько программ. В пунктах уравнений для предположения о частичном равновесии и квазистационарности каждый показал пример. Проблема такого подхода заключается в том, что для вида, которая была принята квазистанционарностью, искусно разработанной алгебраической системой уравнений, что в свою очередь, отрицательно сказывается на производительности симуляции.
3. Глобальная кинетика: В отличие от только что обсуждавшихся сниженных кинетики, определение реакций при использовании глобальной кинетики, аналогично элементарным реакциям с помощью простого подхода Аррениуса. Решение сложных систем уравнений для недифференциальных уравнений видовой концентрации, для которых было выбрано квазистационарность, опущено. Глобальные кинетики можно использовать с помощью квазистационарности или частичного равновесия, однако можно найти интуитивно. В отличие от детальных механизмов, которые применимы в широком спектре влияния, в кинетике, нужно убедиться за тем, чтобы скорость реакции в этой области можно было надежно определить. Показатели степени, входящие в закон скорости времени больше не связаны со стехиометрическими коэффициентами и поэтому может быть таким образом, чтобы он был согласован с результатами подробного механизма.
4. Линейная модель хода зажигания: Эта модель предполагает, что самовоспламенение возникает тогда, когда модель устанавливается.
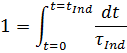
Время, после которого любая смесь самовоспламеняется, происходит через интеграцию, время задержки зажигания τ Ind, действительное в течение времени t, действительно для мгновенного состояния. Модель основана на предположении, что прогресс воспламенения является линейным, что со временем поднимается, час скорость реакции зависит только от внешних параметров в течение времени индукции такие как в зависимости от давления и температуры, а не от процесса воспламенения. Мгновенные времена задержки зажигания могут быть определены на основе моделирования реактора параметр влияния или корреляции рассчитываются. Впоследствии они становятся в таблице, так что расчет поля потока отделен от химии. несмотря на использование детального механизма позволяет моделировать CFD без особых потерь быть выполненным на работе.
5. Вид индикатора: Массовая доля становится представление радикальных бассейнов СО используемых массовых взрывов. СО характеризуется тем, что во время индуктивной фазы она меньше концентрации, но происходит резкое повышение, как только зажигается взрывоопасная смесь. С помощью моделирования реактора 0D скорость образования СО может зависеть от параметров давления, температуры, доли смеси и концентрации СО. Значения могут быть занесены в таблицу таким образом, чтобы могли быть представлены для моделирования СFD. Взаимодействие химии и турбулентности объясняется использованием подхода PDF , где свертка скорости реакции в течении PDF разрыва смеси, температура и массовой доли СО. Для формирования композитной вероятности (JPDF) предполагается статистическая независимость между отдельными переменными, так чтобы JPDF можно записать как произведение отдельных PDF файлов. Массовая доля СО достигает определенной величины и происходит воспламенение. После сжигания следует фаза тепловыделения. На данном этапе ILDM (собственный низкоразмерный коллектор) используется для определения скорости реакции. С ILDM механизм химической реакции может быть определен меньшим количеством переменных хода реакции. В случае для этой цели используется массовая доля СО2 . Используя подход PDF, метод ILDM может быть применен к турбулентным потокам. В этом случае свертка текущего термина химического источника через PDF, так это приводит к среднему термину источника.
При рассмотрении отдельных подходов преимущества и недостатки уже обсуждаются. Четвертый подход не учитывает смешивание реагентов в течение времени индукции и, по-видимому, не подходит для рассмотрения заявки здесь. Пятый подход формирование составной вероятности, предполагающей статистическую независимость с ошибками, что может привести к недостаточному прогнозированию самовоспламенения. Использование подробной кинетики реакции представляется наиболее подходящим для комплекса. Опишите процессы при самовоспламенении топливовоздушных смесей. Тем не менее, результат от применения детальной кинетики реакции высокие требования к вычислительной мощности и требования к памяти. Это может быть достигнуто путем целевой оптимизации механизма реакции на условия экспертизы и предполагаемое использование уменьшены.
В этой работе используется механизм Ахмед и др. Это описывает сложные термодинамические и химические операции при сжигании iso-октана/н гептана-воздуха. Смешивание по большому диапазону начальных условий (давление, температура, соотношение воздуха, октановое число). При сокращении с самого начала фокусируется на химических процессах в диапазоне низких температур. Критерием считается соответствие между подробными и пониженными механизмами при временном возникновении события воспламенения. Результат процесса свертывания - механизм реакции, состоящий из 176 видов и 280 реакций.
После того, как процедура моделирования самовоспламенения была показана, будет объяснено впоследствии , как химические процессы могут быть организованы с турбулентным потоком. Основная проблема химико-турбулентного взаимодействия и подход, выбранный в данной диссертации действовать в следующем разделе.
Описание химико-турбулентного взаимодействия.
Турбулентные потоки обусловлены сильными колебаниями концентрации видов, скорости и температура помечена. Для лечения таких течений выделялись статистические подходы. Они являются предметом раздела 3.3. результатом этих методов являются усредненные уравнения сохранения для общей массы, массы компонентов, импульса и энергии, документированной системой уравнений (3.26) до (3.29). Для решения уравнения требуют средних коэффициентов химической реакции и средних химических источников, которые можно определить различными способами. Как правило, скорость реакции от величины - это температура, давление и спектральные концентрации зависимо, в вектор помещения состояния Φ = (p, Т, Y1..., YN) обобщаются мочь. По причине сильной нелинейности между химическим источником и величинами в Φ, s. уравнения (5.4 и (5.6), средний химический первоначальный терм считается т.е. базируя на временной стоимости вектора состояния, не равняется среднему первоначальному терму, базируя на средних величинах от Φ.
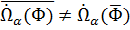 ,
,
Несмотря на это понимание в некоторых приложениях вычисляет средний источник по средним значениям величин из помещения состояния Φ предпринятый, что к большим ошибкам в результатах может вести.
Поскольку флуктуации величин от вектора пространства состояний не являются частью решения по усредненной по частоте уравнения баланса, они должны быть описаны с соответствующими моделями. Одной из возможностей является свертка термина мгновенного химического источника, основанного на среднем значении, через функцию плотности вероятности PDF о турбулентных колебаниях. PDF основан на нескольких зависимых переменных они назвали составную функцию плотности вероятности или объединенный PDF (JPDF). Определение, тем не менее, совместное с PDF сложно и является реальной статистической проблемой описания. В принципе, JPDF может быть определен путем решения уравнения переноса здесь снова открытые термины и результат высокой вычислительной сложности. Кроме того, история формы для отдельных PDF-файлов может быть принята априори, в которой часто между переменными предполагается статистическая независимость, поэтому JPDF от продукта отдельных результатов PDF. Другие недостатки этого подхода, с одной стороны в её большом вычислительном усилии и сложном применение в детальной реакции.
Другая категория моделей постулирует основные предположения (подход Флеймлета) или основан на эмпирических подходах для описания химического взаимодействия турбулентности. Концепция Флеймент основана на предположении, что турбулентное пламя, в котором происходит химическая реакция, работает как ансамбль при небольшой очень тонкой пламени (зон реакции). Поскольку пламенные частицы меньше турбулентных вихрей, они будут, несмотря на то, что находятся в турбулентном вихре, поток встраивается, интерпретируется и рассматривается как ламинарное пламя. Описание зоны реакции осуществляется путем решения уравнения переноса пассивных скаляров (например, фракция смешения для систем без предварительного смешивания), без источника в уравнении их баланса из-за химических реакций. Это делает их лечение статистическим методы проще. С помощью уравнения Флеймента реактивные скаляры, например, массовые перерывы участвующих видов как функция пассивного скаляра.
Модели, основанные на эмпирических подходах, включают модель "Breakup Eddy" и Eddy-Dissipation-Concept после Magnussen и Hjertager . Эти модели первоначальны для бесконечно быстрой химии, поскольку они не учитывают химическую кинетику и опирается на ВВП. Происходит химический оборот (mixed = burrt). Вы также можете использовать химически контролируемые процессы.
Модель PaSR, используемая в этой работе, является расширением модели Eddy-Discipation , которая восходит к Magnussen и Hjertager. Быстрая химия расширяется с учетом детализированной кинетики. Основная идея и расчет среднего химического источника на основе модели PaSR является темой следующего раздела.
Концепция модели с частично перемешиваемым реактором.
Турбулентные потоки с достаточно большими размерами показывают широкий диапазон вихрей разных размеров, масштабируется растягивающие и сдвиговые напряжения возникают на стыках между позвонками что, в свою очередь, является основой энергетического каскадного процесса. Еще один момент. Эти передаваемые напряжения являются увеличением разности концентраций, что, в свою очередь, увеличить молекулярную диффузию и основу для смешивания топлива и окислителя. Процесс турбулентного перемешивания находит наименьшие массы, так называемые тонкие структуры. Эти тонкие структуры образуют пространство реакции и характеризуются следующими признаками:
1. Они занимают лишь небольшую часть объема жидкости,
2. В них происходят диссипативные процессы,
3. Их характерные размеры находятся в области длины Колмогорова или меньше.
Основная идея концепции Partially-Stirred-Reactor заключается в создании ячейки решетки как в двух областях См. рисунок 5.1, где серым цветом определяется реакция. Доля ячейки на уровне тонкой структуры (Konzentration1 c), а в остальном Часть клетки не проходит никаких химических реакций. C1 - это концентрации, разделенные по времени, входящие или выходящие в ячейку. Как предположение для реакционной зоны считается идеально смешанным реактором. Это привело к: Флуктуации размеров состояний игнорируются и, таким образом, ламинарные химические исходный элемент может быть вычислен с помощью детального механизма реакции. Состав в нештрихованном районе меняется путём массового обмена с зоны реакции. Это может быть получено и перенесено в следующее уравнение. При этом κ∗ массовое участие помещения реакции в клеточной массе. Уравнение также можно построить, как показано на графике. На первом этапе (I) химические реакции изменяют концентрации в реакционном пространстве. Это в реакционном пространстве такая же начальная концентрация С0 раньше. Затем (II) происходит турбулентная пропускная смесь концентраций из реагирующей и нереагирующей области клетки. Два подпроцесса могут быть связаны с различными шкалами времени:
1. Поскольку c0 и c1 - это концентрация в начале или конце процесса, период времени: между тем временной такт общего процесса τ,
2. Время от c до c1 является характерным временем турбулентности.
Из рисунка, отношения между концентрациями и характеристикой шкалы времени настроены. Из этого следует, что снова приводит к выражению для c1. В настоящее время проблема заключается в том, что концентрация c, а также член химического источника ˙ΩC (c) информация из тонких структур, которые неизвестны. Теперь задача состоит в том, чтобы заменить неразрешенную информацию области тонкой структуры разрешенными размерами. Нордин выполняет ряд математических преобразований в этой точке не должно повторяться. В уравнении (5.14) κ представляет отношение химической шкалы времени τc и τmix. Шкала времени определяется эталонной техникой вида. Вид ограничивает один химическая реакция, риск стать отрицательным, если шаг по времени слишком длинный, шаг по времени интеграции. Такой вид присутствует в самой низкой концентрации и, кроме того, потребляется в реакции. Следовательно, комплементарный член реакции контрольных видов находится более высокой концентраций. Для определения химической шкалы времени используемый здесь kf - коэффициент скорости прямой реакции, а cmax – максимум концентрация видов, участвующих в реакции.
Уравнение (5.13) представляет собой корреляцию, представляющую термин химического источника на основе информации тонкой структуры, возвращается к значениям в точке состояния 1 и, таким образом, разрешается известным информация , где Cmix - модельная константа, а µeff - эффективная вязкость. Сообщается о низком влиянии Cmix на результат. Это приводит к исчезновению влияния до тех пор, пока Cmix <1. Эта работа следует предложению Nordin для исправления из Cmix, согласно уравнению (5.16).
Модель PaSR, представленная в этой главе, позволяет моделировать взаимодействие турбулентное перемешивание и сложные химические реакции. При этом происходит детальная химия, учитывающая крупнодисперсную и турбулентную смеси. Неоднородная структура зоны реакции в тонких структурах не рассматривается. Так что возможно средний химический термин источника, относящийся к термину ламинарного источника согласно уравнению (5.13). Модель PaSR используется для расчета явления предварительного зажигания с использованием числового метода.
Подведение итога.
Описание химических процессов, включая процесс самовоспламенения, может варьироваться в различные уровни. Высочайший уровень детализации обладает элементарными реакциями. Прежде всего, детальная кинетика реакции, кажется, очень подходит для рассмотрения процесса самовоспламенения. Недостатком этого способа является высокая потребность в вычислительных мощностях, потому что есть подробные механизмы реакции для сжигания высших углеводородов от большого количества видов и элементарных реакций. Для всех видов должны быть в CFD решения уравнения собственного получения. Кроме того, крупные химические механизмы в основном очень жесткие. Механизмы реакции, оптимизированные для желаемого применения (например, давление и температура) предлагают преимущество высокой степени моделирования в сочетании с более низкой степенью моделирования вычислительных усилий.
Терминологический словарь
1. Die Differentialgleichung – дифференциальное уравнение.
2. Das Zustandsgrößen – свойства.
3. Die Strömung - ток.
4. Der Stoff – материал.
5. Die Anzahl - количество.
6. Die Zeitmass – мера времени.
7. Die Berechnung – вычисление.
8. Die Zündungsmodellierung – моделирование зажигания
9. Das Gleichgewicht – равновесие.
10. Die Übereinstimmung – соответствие.
11. Das Ergebnis – результат.
12. Das Selbstzündung – воспламенение от сжатия.
13. Das Gemisch – смесь.
14. Die Korrelation – соотношение.
15. Die Anforderung – претензия.
16. Das Zustandsgröße – свойство.
17. Die Gesamtmasse – общая масса.
18. Der Geschwindigkeit – скорость.
19. Die Oktanzahl – октановое число.
20. Die Schwankung – колебание
Дата добавления: 2020-01-07; просмотров: 82; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
