Тема 5. Окислительно-восстановительные реакции и электрохимические процессы
Задание 1
Для водного раствора электролита:
1. напишите уравнения процессов, которые идут на электродах при электролизе;
2. рассчитайте, сколько и каких веществ выделится на катоде и аноде, если вести электролиз при силе тока равной I=… A,в течение t часов;
3. определите, как будет меняться среда у электродов.
Таблица исходных данных
| Вариант | Электролит | Электроды | I,A | t , ч |
| 18 | ZnSO4 | Цинковые | 25 | 2 |
Для водного раствора электролита:
1. Напишите уравнения процессов, которые идут на электродах при электролизе;
Диссоциация в растворе:
ZnSO4 « Zn2+ + SO42-
Катод (-): Zn2+ + 2e- ® Zn0 – осаждение цинка на катоде
Анод (+): Zn0 – 2e- ® Zn2+ – растворение анода
Метод очистки цинка.
Альтернативный вариант:
2H2O – 4e- ® 4H+ + O20 (в случае нейтрального анода) – выделение кислорода.
2. Рассчитайте, сколько и каких веществ выделится на катоде и аноде, если вести электролиз при силе тока равной I=… A,в течение t часов;
По закону Фарадея:
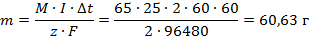
Таким образом, на катоде выделится 60,63 г чистого цинка, а на аноде растворится такая же масса цинка.
3. Определите, как будет меняться среда у электродов.
У катода среда будет щелочная за счет реакции
SO42- + H2O « HSO4- + OH-
У анода среда будет кислая за счет реакции
Zn2+ + H2O « ZnOH+ + Н+
Задание 2.
Для пары металлов:
1. определите, возможна ли коррозия металла из пары Fe – Cd в среде рН=4 при контакте с воздухом;
2. напишите уравнение катодного и анодного процесса;
|
|
|
3. предложите для данной пары катодное и анодное покрытие.
Номинально кадмий имеет по сравнению с железом больший потенциал (-0,44 В < -0,40 В), следовательно, в гальванопаре номинально кадмий должен быть катодом, а железо – анодом.
Вид деполяризации определяют по наличию в коррозионной системе деполяризатора – катионов водорода (воды) или кислорода. В атмосферных условиях деполяризация кислородная.
Термодинамическую возможность коррозии оценивают путем сравнения стандартных потенциалов каждого из металлов с потенциалами водородного и кислородного электродов, рассчитанных по формулам E(H2) = -0,059 · pH и E(O2) = 1,23 -0,059 · pH (с учетом вида деполяризации). Если потенциал металла меньше потенциала водородного или кислородного электрода, то коррозия термодинамически возможна, если потенциал металла больше – соответственно, наоборот. Для определения фактической возможности коррозии следует учитывать склонность металлов к пассивации в той или иной коррозионной среде.
Ниже приведены значения потенциалов водородного и кислородного электродов и указаны катодные реакции восстановления деполяризатора.
В кислой среде:
E(H2) = -0,059 · pH = -0,059 · 4 = -0,236 В
|
|
|
2H2O + 2e- = H2 + 2OH-
E(O2) = 1,23 - 0,059 · pH = 1,23 - 0,059 · 4 = 0,994 В
O2 + 2H2O + 4e- = 4OH-
Схема коррозионного элемента и электродные реакции представлены ниже.
E(H2) = -0,059 · pH = -0,059 · 4 = -0,236 В
2H2O + 2e- = H2 + 2OH-
Термодинамически возможна коррозия и железа, и кадмия с кислородной деполяризацией,
(-0,44 В < -0,40 В < -0,236 В).
анод ( + ) Cd | H2O, O2 | Fe ( - ) катод
2. Напишите уравнение катодного и анодного процесса;
Анодная реакция: 2H2O + 2e- = H2 + 2OH-
Катодная реакция: Fe – 2e- = Fe2+
Суммарная реакция: 2H2O + Fe = Fe2+ + H2 + 2OH-
Тема 6. Химия металлов
Задание 1.
Написать уравнения реакций взаимодействия Al с водным раствором сильного основания. Расставить стехиометрические коэффициенты методом электронного баланса.
2Al + 6NaOH + 6H2O ® 2Na3[Al(OH)6] + 3H2
Al0 – 3e- ® Al3+ ½ 2 ½ восстановитель, процесс окисления
2H+ + 2e- ® H2 ½ 3 ½ окислитель, процесс восстановления
Задание 2.
Написать уравнения реакций взаимодействия Cu с HNO3(конц)(t) при нагревании. Расставить стехиометрические коэффициенты методом электронного баланса.
Cu + 4HNO3(конц)(t) ® Cu(NO3)2 + 2NO2 + 2H2O
Cu0 - 2e- ® Cu2+ ½ 1 ½ восстановитель, процесс окисления
N5+ + e- ® N4+ ½ 2 ½ окислитель, процесс восстановления
Тема 7. Химия комплексных соединений
|
|
|
Задание
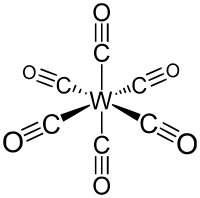
Для комплексного соединения [W(CO)6]определите;
1. Составные части этого соединения: комплексное нейтральное соединение [W(CO)6] карбонильный комплекс вольфрама, центральный атом- комплексообразователь W0, лиганды СО0,
2. Заряд комплесообразователя равен нулю W0
3. Тип гибридизации, реализующийся при образовании связей: sp3d2
4. Пространственную конфигурацию комплекса – октаэдр
Дата добавления: 2019-11-25; просмотров: 142; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
