Обработка результатов эксперимента
Часть1 – Изотермический процесс
1. Вычислить V , P , T и заполнить таблицу 2.

2. Абсолютное давление в исследуемом объеме равно сумме атмосферного давления (P1) и избыточного в полости цилиндра (Р2):
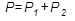
3. Абсолютная температура находится по формуле:
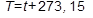
4. Вычислить для каждого шага сжатия N произведение PV.
Данные занести в таблицу 2.
5. Построить график зависимости P = f ( V ).
Таблица 2
Исследование изотермического процесса
| Параметр | измерено | вычислено | |||||
| положение штока | избыточное давление | температура процесса | объем камеры | абсолютное давление в камере | температура процесса | PV | |
| N | L, мм | P2, кПа | t, 0C | V, м3 | Р, кПа | T, K | - |
| 1 | |||||||
| 2 | |||||||
| 3 | |||||||
| 4 | |||||||
| 5 | |||||||
график зависимости P = f ( V ) .

Часть 2 – Изохорный процесс
1. Вычислить P , T и заполнить таблицу 3.
2. Вычислить для каждой точки нагрева N отношение P / T. Данные занести в таблицу 3.
3. Построить график зависимости P = f ( T ).
Таблица 3
Исследование изохорного процесса
| измерено | вычислено | ||||
| Параметр | избыточное давление | температура процесса | абсолютное давление в камере | температура процесса | P/T |
| N | P2, кПа | t, 0C | Р, Па | T, K | - |
| 1 | |||||
| 2 | |||||
| 3 | |||||
| 4 | |||||
| 5 | |||||
|
|
|
график зависимости P=f(T).
 |
Контрольные вопросы
1. Уравнение Менделеева-Клапейрона.
2. Первый закон термодинамики.
3. Идеальный газ.
4. Изохорный процесс в p-v и T-s координатах.
5. Изохорный процесс. Основные уравнения.
6. Изобарный процесс в p-v и T-s координатах.
7. Изобарный процесс. Основные уравнения.
8. Изотермический процесс в p-v и T-s координатах.
9. Изотермический процесс. Основные уравнения.
10. Адиабатный процесс в p-v и T-s координатах.
11. Адиабатный процесс. Основные уравнения.
Лабораторная работа № 2
ИССЛЕДОВАНИЕ КРИВОЙ УПРУГОСТИ
ВОДЯНОГО ПАРА
Цель работы: экспериментальное установление зависимости абсолютного давления насыщенного водяного пара 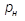 от его температуры
от его температуры 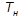 в процессе парообразования; ознакомление с методом определения теплоты парообразования водяного пара
в процессе парообразования; ознакомление с методом определения теплоты парообразования водяного пара 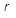 на основании экспериментально полученной упругости
на основании экспериментально полученной упругости 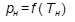 .
.
Теоретическая часть
Процесс превращения вещества из жидкого состояния в газообразное называется парообразованием.
|
|
|
Процесс кипения заключается в том, что если к жидкости подводить теплоту, то при некоторой температуре, зависящей от физических свойств жидкости и давления, наступает процесс парообразования как на свободной поверхности жидкости, так и внутри ее.
Пар, соприкасающийся с жидкостью и находящийся с ней в термическом равновесии, называется насыщенным. С изменением температуры жидкости равновесие нарушается, вызывая соответствующее изменение плотности и давления насыщенного пара.
Насыщенный пар, в котором отсутствуют взвешенные мельчайшие частицы жидкой фазы, называется сухим насыщенным паром. Состояние сухого насыщенного пара определяется только одним параметром - давлением или удельным объемом, или температурой. Насыщенный пар, в котором содержатся взвешенные высокодисперсные частицы жидкой фазы, равномерно распределенные по всей массе пара, называется влажным насыщенным паром.
Отношение массы сухого насыщенного пара к суммарной массе влажного насыщенного пара (пар+жидкость) обозначается 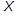 и называется степенью сухости пара или паросодержанием.
и называется степенью сухости пара или паросодержанием.
Если сухому насыщенному пару сообщить некоторое количество теплоты при постоянном давлении, то температура его будет возрастать. Пар, получаемый в этом процессе, называется перегретым. Он по своим физическим свойствам приближается к газу и тем ближе, чем выше степень перегрева.
|
|
|
Фазовая диаграмма воды представляет собой график зависимости удельных объемов воды и пара от давления (рисунок 1). Кривая АЕ выражает зависимость удельного объема воды от давления при температуре 0 °С. Так как вода − вещество почти несжимаемое, то кривая АЕ почти параллельна оси ординат. Если при постоянном давлении сообщить воде теплоту, то ее температура будет повышаться (линия 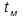 вода закипает (точка А/). В случае дальнейшего подвода теплоты при постоянном давлении начинается процесс парообразования. В момент окончания парообразования в точке В/ пар будет сухим насыщенным. Процесс парообразования А/В/ является одновременно изобарным и изотермическим.
вода закипает (точка А/). В случае дальнейшего подвода теплоты при постоянном давлении начинается процесс парообразования. В момент окончания парообразования в точке В/ пар будет сухим насыщенным. Процесс парообразования А/В/ является одновременно изобарным и изотермическим.

Рисунок 1 График зависимости давления от удельных объемов воды и пара
Кривая АК − нижняя пограничная кривая ( 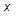 =0) − это геометрическое место точек, отображающих состояние кипящей жидкости при различных давлениях.
=0) − это геометрическое место точек, отображающих состояние кипящей жидкости при различных давлениях.
Кривая КВ − верхняя пограничная кривая ( 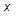 =1) − это геометрическое место точек, отображающих состояние сухого насыщенного пара при различных давлениях; обе кривые делят диаграмму на три части. Влево от кривой АК располагается область жидкости. Между кривыми АК и КВ располагается двухфазная система, состоящая из смеси воды и сухого пара. Вправо от КВ и вверх от точки К − располагается область перегретого пара. К − критическая точка. Количество теплоты, затраченное на парообразование 1 кг воды при температуре кипения до сухого насыщенного пара, называется удельной теплотой парообразования. Удельная теплота парообразования расходуется на изменение внутренней энергии (
=1) − это геометрическое место точек, отображающих состояние сухого насыщенного пара при различных давлениях; обе кривые делят диаграмму на три части. Влево от кривой АК располагается область жидкости. Между кривыми АК и КВ располагается двухфазная система, состоящая из смеси воды и сухого пара. Вправо от КВ и вверх от точки К − располагается область перегретого пара. К − критическая точка. Количество теплоты, затраченное на парообразование 1 кг воды при температуре кипения до сухого насыщенного пара, называется удельной теплотой парообразования. Удельная теплота парообразования расходуется на изменение внутренней энергии ( 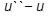 ) и на внешнюю работу расширения
) и на внешнюю работу расширения  . Теплота парообразования:
. Теплота парообразования: 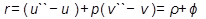 , Дж/кг.
, Дж/кг.
|
|
|
Величина 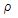 – внутренняя, а
– внутренняя, а  – внешняя теплота парообразования.
– внешняя теплота парообразования.
Переход вещества с заданным давлением 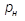 из жидкой фазы в газообразную происходит при определенной температуре
из жидкой фазы в газообразную происходит при определенной температуре  , называемой температурой насыщения, и осуществляется за счет подвода теплоты парообразования r. Очевидно, что каждое равновесное состояние фаз «жидкость-пар» изобразится точкой фазовой
, называемой температурой насыщения, и осуществляется за счет подвода теплоты парообразования r. Очевидно, что каждое равновесное состояние фаз «жидкость-пар» изобразится точкой фазовой  -диаграммы, а кривая, соединяющая такие точки, представляет зависимость
-диаграммы, а кривая, соединяющая такие точки, представляет зависимость 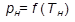 и называется кривой фазового равновесия.
и называется кривой фазового равновесия.
Фазовая диаграмма водяного пара приведена на рисунке 2. На ней изображена соответствующая кривая фазового равновесия − так называемая кривая упругости.
Точки, лежащие на кривой фазового равновесия, соответствуют двухфазной системе «жидкость-пар». Точки, лежащие на  -диаграмме по обе стороны от кривой упругости, соответствуют однородным состояниям вещества, т.е. отдельным фазам.
-диаграмме по обе стороны от кривой упругости, соответствуют однородным состояниям вещества, т.е. отдельным фазам.
Кривая фазового равновесия, как видно из рисунка 2, начинается в «тройной точке», где достигается равновесное состояние трех фаз − жидкость, твердое тело, пар, и заканчивается в критической точке  , для которой плотность жидкой и газообразной фаз одинаковы.
, для которой плотность жидкой и газообразной фаз одинаковы.
Параметры критической точки определяются значениями критического давления 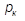 − наибольшего давления, при котором возможно существование двухфазной системы «жидкость-пар», и критической температуры
− наибольшего давления, при котором возможно существование двухфазной системы «жидкость-пар», и критической температуры 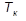 − наивысшей температуры, при которой возможно существование жидкой фазы. При давлениях, превосходящих
− наивысшей температуры, при которой возможно существование жидкой фазы. При давлениях, превосходящих 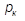 , переход из жидкого состояния в газообразное отсутствует, поскольку при таких давлениях нет принципиального различия между жидкостью и газом.
, переход из жидкого состояния в газообразное отсутствует, поскольку при таких давлениях нет принципиального различия между жидкостью и газом.
В технической термодинамике ко всяким изменениям агрегатного состояния химически однородных веществ (сублимация, плавление, конденсация) применимо уравнение Клайперона-Клаузиуса, которое для процесса парообразования имеет вид:
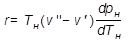 , (1)
, (1)
где 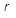 – теплота парообразования, кДж/кг;
– теплота парообразования, кДж/кг;
 – температура фазового перехода (для процесса парообразования − температура насыщения), К;
– температура фазового перехода (для процесса парообразования − температура насыщения), К;
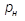 – абсолютное давление насыщенного водяного пара, кПа;
– абсолютное давление насыщенного водяного пара, кПа;
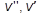 – удельные объемы находящихся в равновесии фаз (для процесса парообразования – удельные объемы сухого насыщенного пара и кипящей воды) м3/кг;
– удельные объемы находящихся в равновесии фаз (для процесса парообразования – удельные объемы сухого насыщенного пара и кипящей воды) м3/кг;
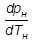 – производная от давления по температуре, взятая на кривой фазового перехода или кривой упругости, кПа/К.
– производная от давления по температуре, взятая на кривой фазового перехода или кривой упругости, кПа/К.
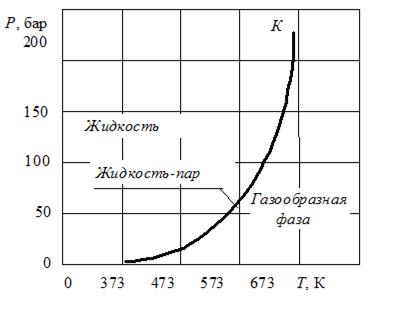
Рисунок 2 Кривая упругости водяного пара
Входящие в формулу (1) абсолютное давление 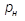 и температура
и температура  вычисляются по формулам:
вычисляются по формулам:
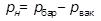 , (2)
, (2)
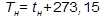 , (3)
, (3)
где 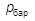 ,
,  – соответственно, барометрическое и вакуумметрическое давления, кПа;
– соответственно, барометрическое и вакуумметрическое давления, кПа;
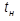 – температура насыщения, °С.
– температура насыщения, °С.
Дата добавления: 2019-11-16; просмотров: 75; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
