ТЕОРИЯ И РАЗОБРАННЫЕ РЕШЕНИЯ ЗАДАЧ
ТЕРМОХИМИЧЕСКИЕ РАСЧЁТЫ (к заданию 1)
Основные понятия и закономерности
· Энтальпия химической реакции – тепловой эффект реакции при постоянном давлении:
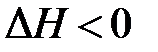 – экзотермическая реакция;
– экзотермическая реакция;
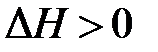 – эндотермическая реакция.
– эндотермическая реакция.
· Энтальпия образования вещества – энтальпия реакции образования 1 моль данного вещества из простых веществ, устойчивых в стандартных условиях.
· Следствие 1 закона Гесса:
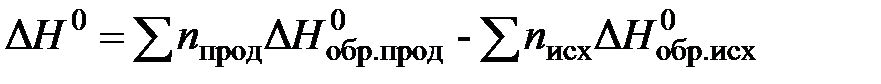 ,
,
где 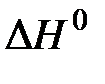 – стандартная энтальпия химической реакции;
– стандартная энтальпия химической реакции;
 ,
, 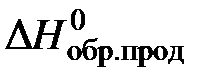 – стандартные энтальпии образования исходных
– стандартные энтальпии образования исходных
веществ и продуктов реакции (справочные величины);
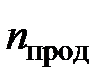 ,
, 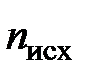 – стехиометрические коэффициенты
– стехиометрические коэффициенты
(коэффициенты в уравнении реакции).
· Следствие 2 закона Гесса: энтальпия прямой реакции равна по модулю и противоположна по знаку энтальпии обратной реакции.
Примеры решения задач
· Задача 1. Рассчитайте стандартную энтальпию образования PCl3(г), если известно термохимическое уравнение:
2P(т) + 3Cl2(г) = 2PCl3(г), 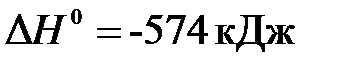 .
.
Решение.
Энтальпией образования называют энтальпию реакции образования 1 моль данного вещества из простых веществ, устойчивых в стандартных условиях. Уравнение приведенной реакции соответствует образованию 2 моль PCl3(г) из простых веществ – фосфора и хлора. С термохимическими уравнениями можно проводить простейшие математические действия: складывать, вычитать, умножать или делить на какое-либо число. Разделим уравнение реакции на два, чтобы оно соответствовало образованию 1 моль вещества:
|
|
|
P(т) + 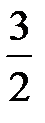 Cl2(г) = PCl3(г),
Cl2(г) = PCl3(г), 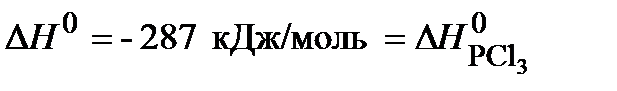 .
.
Ответ: 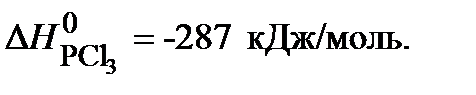 .
.
· Задача 2. Взаимодействие 2,1 г железа с серой в стандартных условиях сопровождается выделением 3,77 кДж теплоты. Рассчитайте стандартную энтальпию образования сульфида железа (II).
Решение.
Уравнение реакции образования сульфида железа (II):
Fe(т) + S(т) = FeS(т).
Стандартная энтальпия данной реакции равна стандартной энтальпии образования сульфида железа (II)
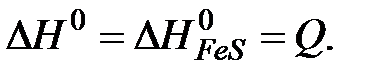
Необходимо определить количество теплоты, выделяющейся при взаимодействии с серой 1 моль железа. Рассчитываем количество вещества железа, содержащееся в 2,1 г (молярная масса железа 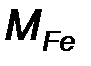 = 55,85 г/моль):
= 55,85 г/моль):


Количество теплоты Q, выделяющейся (Q<0) при взаимодействии с серой 1 моль железа:

Таким образом, стандартная энтальпия образования сульфида железа (II) 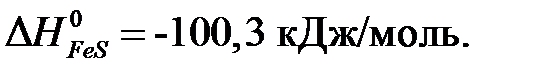
Ответ: 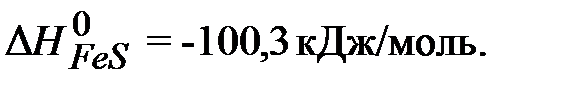
· Задача 3. Определите стандартную энтальпию реакции
2C2H6(г) + 7O2(г) = 4CO2(г) + 6H2O(г).
Решение.
Значения стандартных энтальпий образования веществ:
| Вещество | 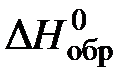 , кДж/моль , кДж/моль
|
| C2H6(г) CO2(г) H2O(г) | -89,7 -393,5 -241,8 |
Согласно первому следствию закона Гесса:
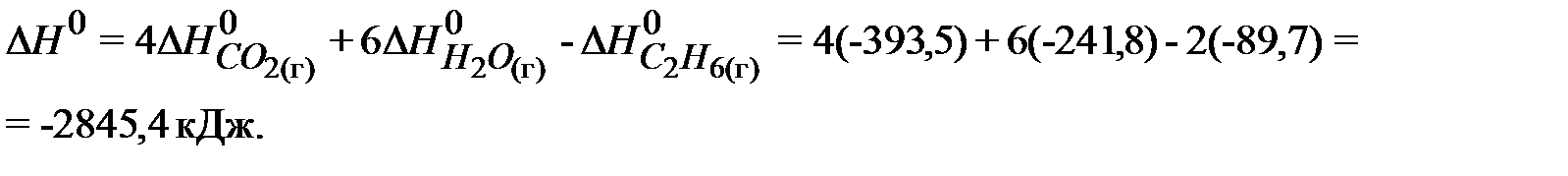 Ответ:
Ответ: 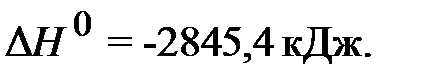
· Задача 4. Рассчитайте стандартную энтальпию образования метилового спирта CH3OH(ж), термохимическое уравнение реакции горения которого:
|
|
|
CH3OH(ж) + 3/2O2(г) = CO2(г) + 2H2O(ж) , 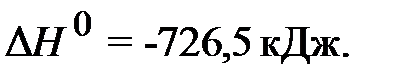
Решение.
Значения стандартных энтальпий образования веществ:
| Вещество |  , кДж/моль , кДж/моль
|
| O2(г) CO2(г) H2O(ж) | 0 -393,5 -285,8 |
Согласно первому следствию закона Гесса:
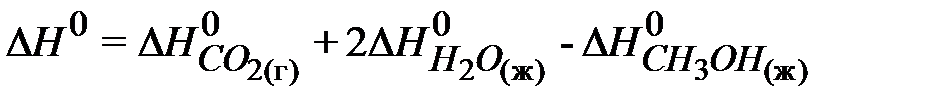 .
.
Уравнение содержит одно неизвестное, 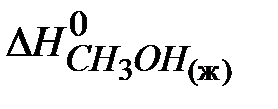 , стандартную энтальпию образования метилового спирта, выражаем его:
, стандартную энтальпию образования метилового спирта, выражаем его:
 Ответ:
Ответ: 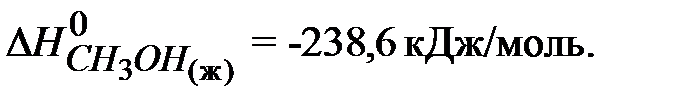
· Задача 5. Образование 37 г гидроксида кальция по реакции
CaC2(т) + 2H2O(ж) = Ca(OH)2(т) + C2H2(г)
в стандартных условиях сопровождается выделением 62,6 кДж теплоты. Определите стандартную энтальпию образования карбида кальция.
Решение.
Значения стандартных энтальпий образования веществ:
| Вещество |  , кДж/моль , кДж/моль
|
| H2O(ж) Ca(OH)2(т) C2H2(г) | -285,8 -986,6 226,8 |
Согласно первому следствию закона Гесса:
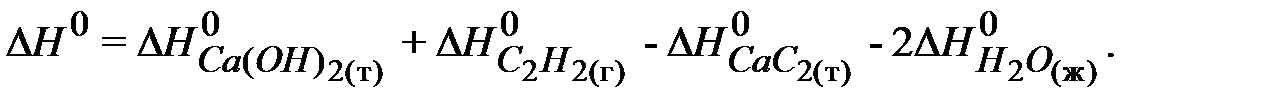
Стандартная энтальпия образования карбида кальция:
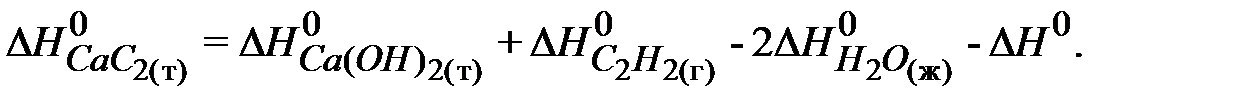
Правая часть уравнения содержит одно неизвестное, стандартную энтальпию реакции 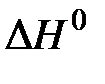 , которая может быть найдена по условиям задачи.
, которая может быть найдена по условиям задачи.
Количество вещества гидроксида кальция, содержащееся в 37 г:
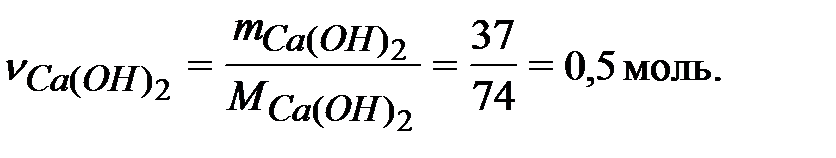
Количество теплоты Q, выделяющейся (Q<0) при образовании 1 моль гидроксида кальция:
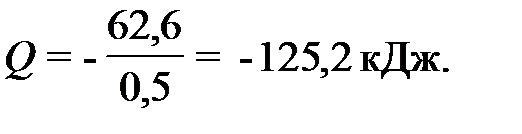
 , подставляем найденное значение в выражение для расчёта
, подставляем найденное значение в выражение для расчёта  :
:
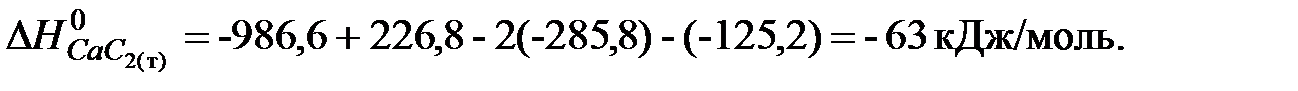
Ответ: 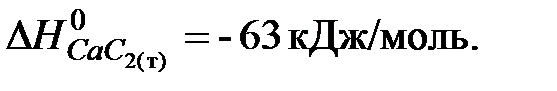
Дата добавления: 2019-09-13; просмотров: 176; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
