Адиабатный (изоэнтропийный) процесс
Прямая 2-2’, проходящая через точку 0 параллельно оси координат (О – 2 – адиабатное сжатие (dT > 0); О – 2’ – адиабатное расширение (dT < 0)).
Изохорный процесс
Кривая3-3’. dS = 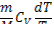 (O – 3 – изохорное нагревание: dS > 0, dT > 0; O – 3’ – изохорное охлаждение: dS < 0, dT < 0).
(O – 3 – изохорное нагревание: dS > 0, dT > 0; O – 3’ – изохорное охлаждение: dS < 0, dT < 0).
Изобарный процесс
Кривая 4-4’. dS = 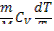 (O – 4 – изобарное расширение: dS > 0, dT > 0; O – 4’ – изобарное сжатие dS < 0, dT < 0).
(O – 4 – изобарное расширение: dS > 0, dT > 0; O – 4’ – изобарное сжатие dS < 0, dT < 0).
Поскольку С p > CV, кривая 4-4’ (изобарный процесс) более пологая, чем кривая 3-3’ (изохорный процесс).
Рассмотрим энтропию в необратимых процессах. Все естественные процессы необратимы. Поэтому важно выяснить, как изменяется энтропия в необратимых процессах.
Рассмотрим цикл, в котором система (тело) переходит из состояния А в состояние В по необратимому пути А1В, а возвращается из В в А по другому пути В2А, который является обратимым (рис. 8.2.4).
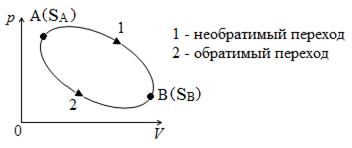
Рис. 8.2.4
Цикл, в котором хотя бы одна часть необратима, в целом необратим. Запишем для необратимого цикла неравенство Клаузиуса:
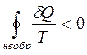
и раскроем его по отдельным участкам:
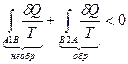 .
.
Учитывая, что второе слагаемое в левой части неравенства представляет собой сумму приведенных теплот в обратимом процессе, согласно формуле (8.2.5) запишем последнее выражение в виде:
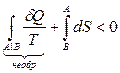
или
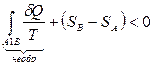 .
.
И, наконец,
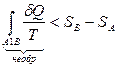 . (8.2.7)
. (8.2.7)
Если необратимый процесс протекает в изолированной системе, т.е. без теплообмена с окружающей средой, то d Q = 0, и в этом случае выражение (8.2.7) имеет вид
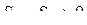
или
 .
.
Отсюда следует важный вывод: в изолированной системе необратимые процессы произвольно протекают только в сторону возрастания энтропии. Это является общим законом природы.
Итак, если в изолированной системе совершится процесс, при котором энтропия осталась неизменной, то этот процесс обратим, т.е. он может пройти и в обратном направлении. Если же в некотором процессе энтропия изолированной системы возросла, то обратный процесс невозможен, т.е. рассматриваемый процесс необратим.
Это свойство энтропии позволяет судить о том, какое направление процесса в той или иной системе возможно, а какое нет. какое состояние системы является начальным, а какое конечным.
Если, например, привести в соприкосновение два различных газа, то они сами собой, без внешнего воздействия, перемешаются благодаря их взаимной диффузии. Обратный же процесс, т.е. разделение газовой смеси на ее компоненты, сам собой не происходит, и возможен только при определенном внешнем воздействии.
Поэтому перемешивание газов в результате диффузии является необратимым процессом, который должен сопровождаться ростом энтропии. Действительно, можно показать, что энтропия смеси больше, чем сумма энтропий обоих компонентов до смешивания.
Рост энтропии в любом необратимом процессе происходит не беспредельно, а лишь до определенного максимального значения, соответствующего состоянию равновесия. Из состояния равновесия система не может выйти без внешнего воздействия.
Итак, в изолированной системе, представленной самой себе, процессы всегда происходят в направлении роста энтропии. Этот закон возрастания энтропии составляет содержание второго закона термодинамики. Его наиболее общая формулировка: энтропия изолированной системы может только возрастать или оставаться неизменной (в случае обратимого процесса).
Математически это записывается так
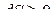 . (8.2.8)
. (8.2.8)
Знак неравенства относится к необратимым процессам, знак равенства – к обратимым процессам.
Рассмотрим пример изменения энтропии к процессу изотермического расширения идеального газа в пустоту. Пусть газ сначала находится в левой части сосуда (рис. 8.2.5).
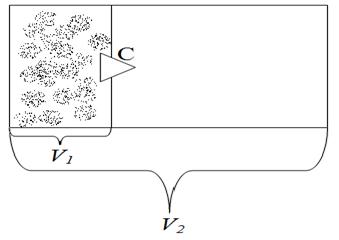
Рис. 8.2.5
Уберем пробку С и дадим возможность газу изотермически расширяться. Газ займет объем всего сосуда V 2. Определим изменение энтропии в этом процессе.
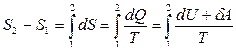 .
.
Но для изотермического процесса  , а
, а 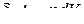 , тогда
, тогда
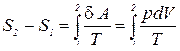 .
.
Выразим из уравнения Менделеева – Клайперона  и запишем:
и запишем:
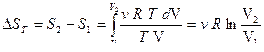 .
.
Поскольку  , то
, то  или
или 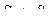 . Энтропия возросла, следовательно, изотермическое расширение газа – процесс необратимый.
. Энтропия возросла, следовательно, изотермическое расширение газа – процесс необратимый.
Определим изменение энтропии при изопроцессах.
Изобарный:
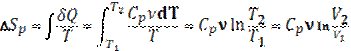
Изохорный:
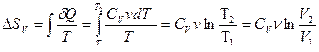
8.3 . с татистический смысл второго начала
Термодинамики
Из рассмотренного примера расширения газа видно, что равномерное распределение молекул газа по всему объему более вероятно, чем скопление их в одной половине сосуда (при условии, что внешние силы отсутствуют), т.е. процесс равномерного распределения молекул по всему объему сосуда сопровождается увеличением вероятности состояния. Этот процесс необратим: вероятность того, что молекулы сами по себе соберутся в одной половине сосуда, бесконечно мала.
Необратимый характер процессов связан с переходом от состояний менее вероятных к состояниям более вероятным. Отсюда ясно, что и энтропия, определяющая направление протекания процессов, должна быть связана с вероятностью.
Ряд макроскопических параметров, таких как давление р, температура Т, объем V, характеризуют состояние тела (газа) в целом. Охарактеризованное таким способом состояние называется макросостоянием.
Состояние макроскопического тела, охарактеризованное настолько подробно, что оказываются заданными состояния всех образующих тело молекул, называется микросостоянием.
Всякое данное макросостояние может быть осуществлено различными способами, каждому из которых соответствует некоторое микросостояние тела.
Число различных микросостояний, соответствующих данному макросостоянию, называется термодинамической вероятностью макросостояния W или статистическим весом.
Чтобы пояснить понятие статистического веса, рассмотрим способы, которыми молекулы газа могут распределиться между двумя половинами закрытого сосуда, в котором заключено N тождественных молекул газа. В качестве характеристики состояния газа примем за n число молекул, находящихся в левой половине сосуда, тогда, соответственно, число молекул в правой половине сосуда будет равно 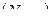 . Поскольку все молекулы газа тождественны, то с макроскопической точки зрения не имеет значения, какие именно молекулы находятся в левой и правой половине сосуда. Для полного задания состояния газа надо указать только общие числа молекул n и
. Поскольку все молекулы газа тождественны, то с макроскопической точки зрения не имеет значения, какие именно молекулы находятся в левой и правой половине сосуда. Для полного задания состояния газа надо указать только общие числа молекул n и 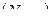 в каждой половине сосуда, но не их номера. Состояние газа, описанное таким способом, называется макросостоянием. Всякая перестановка молекул без изменения чисел n и
в каждой половине сосуда, но не их номера. Состояние газа, описанное таким способом, называется макросостоянием. Всякая перестановка молекул без изменения чисел n и 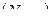 не меняет макросостояния.
не меняет макросостояния.
Если пронумеровать все молекулы, то состояние газа можно охарактеризовать указанием не только чисел молекул, но и их номеров в каждой половине сосуда. Состояние газа, описанное таким образом, называется микросостоянием. Очевидно, всякое перемещение данной молекулы в пределах одной и той же половины сосуда не меняет микросостояния газа. Переход же молекулы из одной половины в другую приводит к изменению микросостояний.
В таблице 1 приведены все мыслимые способы распределения молекул между половинами сосуда (вес микросостояния газа) для частного случая, когда полное число молекул N = 4.
Таблица 1
| Состояние | Способы реализации состояния | Число способов реализации данного состояния (W) | ||
| Число молекул слева | Число молекул справа | Номер молекул, находящихся слева | Номера молекул, находящихся справа | |
| 0 | 4 | - | 1, 2, 3, 4 | 1 |
| 1 | 3 | 1 2 3 4 | 2, 3, 4 1, 3, 4 1, 2, 4 1, 2, 3 | 4 |
| 2, 4 3, 4 | 1, 3 1, 2 | |||
Окончание табл. 1
| 0 | 4 | - | 1, 2, 3, 4 | 1 |
| 3 | 1 | 1, 2, 3 1, 2, 4 1, 3, 4 2, 3, 4 | 4 3 2 1 | 4 |
| 4 | 0 | 1, 2, 3, 4 | - | 1 |
| Всего способов | 24 = 16 | |||
Например, состояние, характеризуемое тем, что в левой части сосуда находится одна молекула (безразлично какая), а в правой части – три молекулы, представляет собой макросостояние. Из таблицы видно, что такому макросостоянию соответствуют 4 микросостояния. Следовательно, статистический вес (или термодинамическая вероятность) данного макросостояния W= 4, а обычная вероятность равна 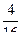 . Макросостояние, при котором в обеих половинах сосуда находится одинаковое число молекул, реализуется с помощью шести микросостояний. Соответственно его статистический вес W = 6, а вероятность (обычная) равна
. Макросостояние, при котором в обеих половинах сосуда находится одинаковое число молекул, реализуется с помощью шести микросостояний. Соответственно его статистический вес W = 6, а вероятность (обычная) равна 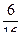 .
.
Найдем число микросостояний, посредством которых может быть осуществлено макросостояние, характеризуемое тем, что в левой половине сосуда находится n молекул из общего числа N, а в правой -  молекул. Для этого пронумеруем молекулы, приписав им номера от 1 до N. Затем станем собирать по одной молекуле и помещать их в левую половину сосуда. Первую молекулу можно выбрать N способами, вторую (N – 1) способами, третью – (N – 2) способами и т.д., последнюю n-ю молекулу можно выбрать
молекул. Для этого пронумеруем молекулы, приписав им номера от 1 до N. Затем станем собирать по одной молекуле и помещать их в левую половину сосуда. Первую молекулу можно выбрать N способами, вторую (N – 1) способами, третью – (N – 2) способами и т.д., последнюю n-ю молекулу можно выбрать 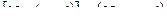 способами. Таким образом, число Z способов, с помощью которых можно отобрать случайным образом n молекул для левой половины сосуда из общего числа N молекул, равно
способами. Таким образом, число Z способов, с помощью которых можно отобрать случайным образом n молекул для левой половины сосуда из общего числа N молекул, равно
 .
.
Умножив и разделив это число на  , получим выражение
, получим выражение 
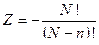 .
.
Однако не все Z способов приводят к отличающимся друг от друга микросостояниям. Отдельные способы отличаются только совокупностью номеров молекул, отобранных для каждой из половин сосуда, но не последовательностью, в которой эти молекулы отобрались. Таких выборок для левой половины сосуда будет n!, все они отличаются только перестановкой n номеров молекул, но соответствуют одному и тому же микросостоянию. Следовательно, для получения числа микросостояний, соответствующего макросостоянию  , нужно разделить число Z на n! В результате для статистического веса получается выражение
, нужно разделить число Z на n! В результате для статистического веса получается выражение
 .
.
Легко убедится в том, что 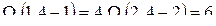 .
.
Больцман показал, что энтропия
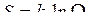 ,
,
где k – постоянная Больцмана.
Итак, энтропия является функцией состояния, характеризующей вероятность данного состояния. Чем больше вероятность данного состояния, тем больше энтропия системы. Вероятность состояния термодинамического равновесия максимальна, поэтому и энтропия системы, находящейся в равновесном состоянии, максимальна.
Изучая эти вопросы, Больцман высказал следующие основные идеи.
Необратимость всех природных процессов объясняется тем, что всякий необратимый процесс представляет собой переход от менее вероятного состояния к более вероятному состоянию системы.
Все формы движения (механическое, электрическое, световое) в конечном счете, переходят в тепловую форму хаотического молекулярного движения, т.к. неупорядоченное тепловое движение молекул является самым вероятным состоянием.
Исходя из этих идей, Больцманом было сформулировано второе начало термодинамики, приведенное в предыдущем параграфе.
Второе начало термодинамики является статистическим законом: оно отображает закономерности движения огромного числа частиц тел, входящих в состав изолированной системы.
Статистическая закономерность указывает поведение всей системы в целом и в этом смысле отражает ее объективные свойства. Каждое отдельное явление случайно, но весьма большое число случайных явлений приводит к необходимости. Статистическая закономерность служит наглядным примером диалектического единства случайности и необходимости.
Отсюда следует, что второй закон термодинамики неприменим к системам, состоящим из сравнительно небольшого числа частиц. Нельзя применить второе начало к малому числу молекул (как, например, не имеет смысла говорить о температуре одной, двух молекул, т.к. температура связана со средней кинетической энергией, а усреднение приводится по огромному числу молекул).
Другая область ограничения применимости второго начала термодинамики относится к космическим масштабам. Нельзя применять второе начало 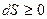 к такой вообще незамкнутой системе, как вся Вселенная в целом, - которая безгранична и безгранично развивается. Такую незакономерную попытку сделал Клаузиус в 1867 г.
к такой вообще незамкнутой системе, как вся Вселенная в целом, - которая безгранична и безгранично развивается. Такую незакономерную попытку сделал Клаузиус в 1867 г.
Рассматривая вселенную как замкнутую систему и применяя к ней второе начало термодинамики, Клаузиус пришел к выводу, что рано или поздно ее энтропия должна достигнуть своего максимума. А это значит, что со временем все формы движения – механическое, электрическое, световое - должны перейти в тепловую форму хаотического молекулярного движения, и температура всех тел во Вселенной должна сравняться. Энергия же теплового движения молекул качественно деградирует и не сможет переходить в другие формы, которым соответствует меньшая энтропия. Все процессы при этом прекратятся, наступит так называемая «тепловая смерть Вселенной».
Эта теория Клаузиуса была подвергнута критике Больцманом, который показал, что в связи с бесконечностью Вселенной в отдельных ее частях неизбежны флуктуации, нарушающие тепловое равновесие. (Флуктуации представляют собой такие изменения состояния, которые сопровождаются уменьшением энтропии).
Распространение второго закона термодинамики на всю вселенную есть экстраполяция, для которой нет оснований. Вселенная в целом может эволюционировать непрерывно и монотонно, никогда не приходя в состояние термодинамического равновесия. Такая теория допускается и общей теорией относительности: благодаря наличию гравитационных полей гигантские космологические системы могут непрерывно развиваться в сторону возрастания энтропии, никогда не достигая состояния с максимумом энтропии.
Подводя итоги, следует иметь ввиду, что второе начало термодинамики, являясь статистическим законом, имеет свои границы применимости. Его можно применять к изолированным системам с большим числом частиц.
Лекция 9

Дата добавления: 2019-09-13; просмотров: 219; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
